改良的幽门螺杆菌噬菌体裂解酶在大肠杆菌和毕赤酵母中表达的活性差异
2020-03-10徐登圆赵珊珊窦俊方宏清徐晓峰支艳艳李晓稳文良柱
徐登圆,赵珊珊,窦俊,方宏清,徐晓峰,支艳艳,李晓稳,文良柱
1.中国药科大学,江苏 南京 211198;2.江苏万邦医药科技有限公司,江苏 徐州 221004
幽门螺杆菌(Helicobacter pylori)是革兰阴性菌,感染率极高,95%的胃病由它引起,甚至导致胃癌[1-2]。目前,临床多采用抗生素治疗幽门螺杆菌感染,最常用的治疗方法是标准三联疗法和四联疗法,例如铋剂+甲硝唑+四环素+奥美拉唑、奥美拉唑+阿莫西林+克拉霉素、铋剂+替硝唑+克拉霉素等[3]。这些治疗方法患者依从性差,且由于抗生素的滥用,幽门螺杆菌对抗生素的耐药性问题越来越严重。经过多年研究和开发,很难筛选出新的抗生素,抗生素已无法满足临床对于抗幽门螺杆菌感染的治疗需求。因此,当务之急是寻找一种新型抗菌制剂来应对耐药菌的威胁,迫切需要新型药物替代传统疗法,以达到根治幽门螺杆菌的目的。
噬菌体是一种细菌病毒,广泛存在,特异性高,易于分离获得。但噬菌体是一个独立的生命体,当它直接用作抗菌制剂时,生物安全性一直饱受质疑[4]。噬菌体双组分裂解系统由裂解酶和穴蛋白组成,是双链DNA噬菌体在侵染细菌后期所表达的水解酶[5]。研究认为噬菌体双组分裂解系统具有以下优点:特异性强,在杀灭病原菌的同时不会干扰正常菌群;不易使细菌产生耐药性,由于裂解酶是噬菌体在与细菌共同进化过程中产生的,针对细菌细胞壁上高度保守的肽聚糖,所以产生耐药性的几率很小;没有噬菌体的增殖能力;具有高效的杀菌机制,能在短时间内裂解细菌[6]。
噬菌体双组分裂解系统的作用机制分为体内裂解和体外裂解。体内裂解时先由穴蛋白在宿主细胞膜打孔,之后裂解酶作用于细胞壁进而裂解细菌。体外裂解时由裂解酶直接作用于细胞壁,进而裂解细菌。由于革兰阳性菌与阴性菌之间细胞壁结构的差异,其各自的裂解酶也存在明显差异。目前,革兰阳性菌噬菌体裂解酶发展较为成熟,可利用结构域设计,其中包括2个模块,即细胞壁结合结构域(可用于细菌细胞壁识别)和酶催化活性结构域(发挥酶促活性作用,裂解肽聚糖结构中的特异性键)[7-9]。针对革兰阴性菌为宿主的噬菌体裂解酶主要是单域球状蛋白,分子较小(相对分子质量为15 000~20 000),通常没有特定的细胞壁结合结构域模块[10]。相比于阳性菌的噬菌体裂解酶,阴性菌噬菌体裂解酶可能会更好地发挥酶的催化作用[11]。细菌裂解后,不会被细胞壁碎片紧密地结合,一定程度上可脱落进而裂解下一个宿主菌。而对于革兰阴性菌,细胞壁周围存在细菌外膜(outer membrane,OM),可以限制裂解酶从外部进入肽聚糖层。目前,对于幽门螺杆菌噬菌体双组分裂解系统的研究较少。因此,探究幽门螺杆菌噬菌体双组分裂解系统的生物学特性,并将其与外膜渗透剂联用,或对其进行修饰改造以达到穿透外膜的效果是目前的研究方向[12]。
我们根据已公开的幽门螺杆菌噬菌体KHP30的全基因组序列,利用生物信息学软件分析可能的双组分裂解系统基因序列,并在其N端连上一段具有穿透外膜作用的疏水性多肽GFFIPAVILPSIAFLIVP,得到改良型幽门螺杆菌噬菌体裂解酶(下文简称改良型裂解酶),经密码子优化后,分别在大肠杆菌BL21(DE3)和毕赤酵母X33中表达,并在体外验证其溶菌活性差异,为其在抗幽门螺杆菌感染中的应用与发展奠定基础。
1 材料与方法
1.1 材料
大肠杆菌BL21(DE3)、DH5α,毕赤酵母 X33购自MERCK公司;幽门螺杆菌标准菌株ATCC700392购自上海北诺生物科技有限公司;质粒pSUMO和pGAPZαA购自淼灵生物科技有限公司;LB培养基、YPD培养基购自北京索莱宝科技有限公司;幽门螺杆菌固体及液体培养基购自青岛海博生物技术有限公司;溶菌酶购自SIGMA公司;其他化学试剂均购自国药集团化学试剂有限公司。
JFCH280制冷摇床、SW-CJ-1FD超净工作台(上海京孚仪器有限公司);JY92-Ⅱ超声波细胞粉碎机、基因导入仪(宁波新芝生物科技股份有限公司);高速超低温冷冻离心机(ThermoFisher Scientific公司);AKTA蛋白纯化仪(GE公司);伯乐电泳仪(Bio-Rad公司)。
1.2 构建重组表达载体pSUMO-改良型裂解酶和pGAPZαA-改良型裂解酶
在改良型裂解酶N端再连上一段VDDDK肠激酶酶切位点基因,按照大肠杆菌BL21(DE3)系统进行密码子优化,将设计的改良型裂解酶基因交由金斯瑞公司合成并亚克隆进质粒载体,通过XhoⅠ和SacⅠ连接入pSUMO载体,得到重组表达载体pSUMO-改良型裂解酶。
在改良型裂解酶N端连上Kex2、Ste13酶切位点KREAEA,按照毕赤酵母X33系统进行密码子优化,通过XhoⅠ和XbaⅠ连接入pGAPZαA载体,且目的基因中不能有AvrⅡ和BspHⅠ线性化酶切位点。将设计的基因交由南京金斯瑞公司合成并亚克隆进质粒载体,得到重组表达载体pGAPZαA-改良型裂解酶。
1.3 构建重组工程菌BL21(DE3)-pSUMO-改良型裂解酶
采用氯化钙法制备大肠杆菌BL21(DE3)感受态细胞,热击法转化重组质粒pSUMO-改良型裂解酶,经卡那霉素抗性筛选及测序验证得到重组工程菌BL21(DE3)-pSUMO-改良型裂解酶。
1.4 构建重组工程菌X33-pGAPZαA-改良型裂解酶
采用氯化钙法制备大肠杆菌DH5α感受态细胞,热击法转化重组质粒pGAPZαA-改良型裂解酶,经博来霉素抗性筛选得到重组工程菌DH5αpGAPZαA-改良型裂解酶。利用重组工程菌DH5α-pGAPZαA-改良型裂解酶富集重组质粒,经AvrⅡ酶切回收得到10 μg线性化质粒L-pGAPZαA-改良型裂解酶。采用山梨醇法制备毕赤酵母X33感受态细胞,电转化L-pGAPZαA-改良型裂解酶,经博来霉素抗性筛选及测序验证得到重组工程菌X33-pGAPZαA-改良型裂解酶。
1.5 2种表达系统表达与纯化改良型裂解酶
取300 μL工程菌BL21(DE3)-pSUMO-改良型裂解酶甘油菌,接种于30 mL LB培养基中,30℃、250 r/min摇床过夜活化后,全部转接于3 L LB培养基中,37℃摇床培养至菌液D600nm值约1.0时,加入IPTG,使其终浓度为0.5 mmol/L,20℃诱导12 h进行改良型裂解酶的表达,诱导表达结束后8500 r/min离心20 min收获菌体沉淀,用Tris-HCl缓冲液(50 mmol/L Tris-HCl,pH7.5)洗涤沉淀2次,将沉淀重悬于30 mL Tris-HCl缓冲液中,并使用冰浴在低于10℃的温度下超声波破碎细胞(400 W,超声 5 s,间隔 10 s,工作 180次),收集上清液(超声处理后的可溶性蛋白)和沉淀物(溶解在8 mol/L尿素中),取同等体积样品进行SDS-PAGE分析[16-17]。
将收集得到的超声破菌上清液经Ni-NAT填料进行亲和层析柱纯化,用20个柱体积的含250 mmol/L咪唑的洗脱缓冲液洗脱柱子,按0~100%,40个柱体积进行梯度洗脱,收集洗脱峰,测蛋白浓度并进行SDS-PAGE验证[18]。
收集得到的洗脱峰采用肠激酶进行酶切激活,将脱盐后的SUMO-改良型裂解酶融合蛋白经肠激酶(1∶200)在室温下过夜即可得到具有活性的改良型裂解酶,并进行电泳分析。
另外,取100 μL重组工程菌X33-pGAPZαA-改良型裂解酶甘油菌接种入10 mL YPD培养基中,30℃、250 r/min摇床培养过夜,取过夜活化的菌液100 μL转接入50 mL YPD培养基中,装液量为20%,30℃、250 r/min摇床培养。分别在0、24、48、72和96 h取样1 mL离心收集上清液,并进行SDS-PAGE分析。在表达量最高的时间点,以8500 r/min离心20 min收集发酵液上清,上清采用3K超滤浓缩,用50 mmol/L Tris-HCl(pH7.5)置换体系3次,得到改良型裂解酶粗提溶液[19]。
1.6 滤纸片法抑菌试验
取幽门螺杆菌固体培养基,平板划线接种幽门螺杆菌ATCC700392培养物,于37℃、微需氧环境(50 mL/L O2,100 mL/L CO2,850 mL/L N2)中培养72 h,用灭菌生理盐水洗下菌苔,混匀[20]。采用快速尿素酶试验(rapid urease test,RUT)、过氧化氢酶试验和涂片革兰染色后显微镜下观察等对菌种进行鉴定[21]。鉴定为阳性的菌液用灭菌生理盐水溶液溶解,酶标仪测定D600nm值为4.8~8.4之间,即得1×109CFU/mL的菌液。取幽门螺杆菌固体培养基,将幽门螺杆菌菌液均匀涂布在其表面,用无菌镊子贴加滤纸片,向滤纸片上滴加30 μL药液,37℃微需氧环境中培养48 h观察平板是否有抑菌圈,并用游标卡尺测定抑菌圈直径。
阳性对照为2 mg/mL溶菌酶;阴性对照为50 mmol/L Tris-HCl(pH7.5);样品分别采用大肠杆菌表达系统和毕赤酵母表达系统表达的改良型裂解酶,浓度均为2 mg/mL。
1.7 电镜观察幽门螺杆菌裂解状态
取幽门螺杆菌固体培养基,平板划线接种幽门螺杆菌ATCC700392培养物,于37℃、微需氧环境中培养72 h,用PBS缓冲液洗下菌苔,2000 r/min离心5 min收集菌体,菌体中加入1 mg/mL溶菌酶及改良型裂解酶,以加入缓冲液50 mmol/L Tris-HCl(pH7.5)为阴性对照组。摇床孵育20 min,取样离心后用2.5%戊二醛固定液和1%锇酸固定液固定,再经脱水干燥后进行电镜观察。
1.8 液体法抑菌试验
取幽门螺杆菌固体培养基,平板划线接种幽门螺杆菌ATCC700392培养物,于37℃、微需氧环境中培养72 h,用灭菌幽门螺杆菌液体培养基洗下菌苔,混匀。取250 μL菌液加入比色皿,酶标仪测其D600nm值。在四分格平板中加入药液及菌液,使菌液D600nm值为0.55,且溶菌酶浓度为1 mg/mL,样品浓度为0.5 mg/mL,以加入缓冲液50 mmol/L Tris-HCl(pH7.5)为阴性对照组,总体积为2 mL。将四分格平板放入2.5 L厌氧罐,厌氧罐内放入微需氧产气袋,再将厌氧罐放入摇床,37℃、150 r/min 培养[22]。在 0、6、24、30 h 分别取样200 μL,酶标仪测其D600nm值,绘制柱状裂菌效果图。
2 结果
2.1 改良型裂解酶生物信息学分析
利用生物信息学软件分析推测的幽门螺杆菌噬菌体穴蛋白和裂解酶相对分子质量分别为12 090和16 870。基于二者设计的改良型裂解酶相对分子质量为31 350,等电点为9.1。其中穴蛋白存在3段跨膜区域,改良型裂解酶不含信号肽序列,且无相似的三级结构模型。
2.2 大肠杆菌表达系统BL21(DE3)表达改良型裂解酶
重组质粒pSUMO-改良型裂解酶成功转化大肠杆菌BL21(DE3),经卡那霉素抗性筛选和测序验证得到重组工程菌BL21-pSUMO-改良型裂解酶,经3 L培养基发酵后得到12 g菌体。诱导前后全菌电泳在相对分子质量约45 000处条带有一定的加深,但并不明显,可能由于蛋白可溶性表达量低(图1)。超声波破菌后,SUMO-改良型裂解酶融合蛋白多存在于上清中,沉淀中基本无(图2)。破菌上清液经Ni柱纯化,在咪唑浓度为25 mmol/L时有较纯的洗脱峰,得到较纯的融合蛋白(图3)。SUMO-改良型裂解酶融合蛋白经超滤脱盐后,由肠激酶酶切得到粗纯的改良型裂解酶,浓度为2 mg/mL,纯度约80%(图4)。由于改良型裂解酶具有一定的酶活性,不再多次反复进行纯化,直接用粗纯液进行体外抑菌试验。

图1 菌体诱导前后电泳图
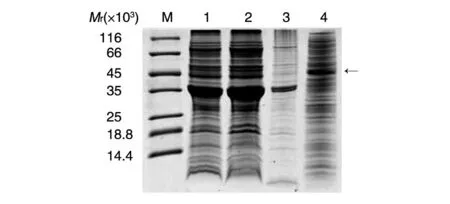
图2 超声破菌后电泳图

图3 Ni柱纯化电泳图

图4 肠激酶激活改良型裂解酶电泳图
2.3 毕赤酵母表达系统X33表达改良型裂解酶
重组质粒pGAPZαA-改良型裂解酶电转化毕赤酵母X33,经博来霉素抗性筛选和测序验证,得到重组工程菌X33-pGAPZαA-改良型裂解酶。该重组工程菌由组成型GAP启动子表达目的蛋白,不需要甲醇诱导。在50 mL YPD培养基摇瓶发酵培养72 h时,改良型裂解酶表达量最高,此时蛋白浓度为0.04 mg/mL(图5)。发酵液上清3k超滤浓缩并置换体系得到浓度为2 mg/mL的改良型裂解酶粗体液,纯度达80%以上(图6)。

图5 不同时间点发酵液上清电泳图
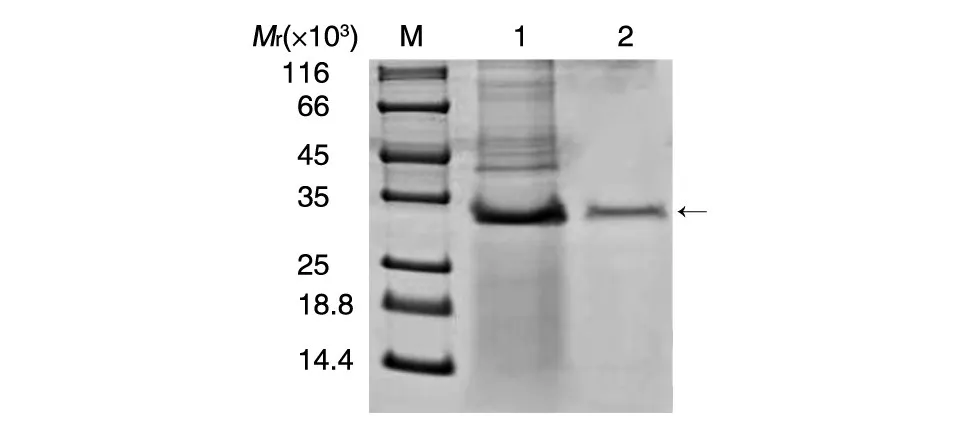
图6 3k超滤前后电泳图
2.4 2种表达系统表达的改良型裂解酶体外活性分析
2.4.1 滤纸片法 滤纸片法证明由大肠杆菌和毕赤酵母表达得到的改良型裂解酶均可以裂解幽门螺杆菌标准菌株ATCC700392。在浓度为2 mg/mL时,大肠杆菌表达的改良型裂解酶可形成直径约0.75 cm的抑菌圈,而毕赤酵母表达的改良型裂解酶可形成直径约0.5 cm的抑菌圈(图7)。初步证实了改良型裂解酶对幽门螺杆菌具有一定的裂菌活性,且对于裂菌活性而言,大肠杆菌表达的改良型裂解酶强于毕赤酵母。由于幽门螺杆菌本身呈透明片状生长,且血琼脂平板底色过深,肉眼可观察到明显的抑菌圈,但拍照得到的图片无法准确显示结果。

图7 改良型裂解酶滤纸片法抑菌效果
2.4.2 电镜观察 在改良型裂解酶和幽门螺杆菌标准菌株ATCC700392共同摇床孵育20 min后,电镜可观察到幽门螺杆菌表面有明显的孔洞,菌体周围出现病变的丝状物,整个视野里存在细菌碎片(图8)。进一步证实了改良型裂解酶对幽门螺杆菌的裂菌作用。大肠杆菌表达的改良型裂解酶和幽门螺杆菌标准菌株ATCC700392共同摇床孵育20 min时,对幽门螺杆菌产生的裂菌作用更强,在幽门螺杆菌表面形成的孔洞较毕赤酵母表达的改良型裂解酶更多,且更多的菌体形成球状的近溶菌状态,而毕赤酵母表达的改良型裂解酶作用后菌体大多仍呈杆状。

图8 改良型裂解酶裂解菌体电镜图
2.4.3 液体法抑菌试验裂菌效果图 幽门螺杆菌在液体培养基中摇床培养,初始D600nm值为0.55,从培养6、24和30 h的D600nm值可以看出加入溶菌酶和改良型裂解酶的幽门螺杆菌生长受到抑制,相较于未加入二者之一的阴性对照,菌体生长差异明显。且加入大肠杆菌表达的改良型裂解酶的幽门螺杆菌生长被抑制状态与溶菌酶基本一致,而加入毕赤酵母表达的改良型裂解酶的幽门螺杆菌被抑制状态稍弱于溶菌酶(图9)。

图9 改良型裂解酶对幽门螺旋杆菌的裂菌效果
3 讨论
相对于抗生素的广谱抗菌作用,从幽门螺杆菌噬菌体基因组获得的裂解系统是特异且高效的[23]。噬菌体裂解系统对宿主细菌的裂解分为内部裂解和外部裂解。外部裂解过程,即在宿主菌体外裂解细菌,主要适用于革兰阳性细菌,因为革兰阳性菌的肽聚糖层直接暴露于外部,有利于裂解酶和肽聚糖的直接接触和作用;而用于革兰阴性菌裂解酶的研究面临很大的问题,主要原因是裂解酶的靶标是细胞壁的肽聚糖成分,而革兰阴性肽聚糖层周围的细菌外膜阻碍了裂解酶与肽聚糖之间的接触,使得它不起作用。然而,经过研究人员的不断研究和努力,革兰阴性菌溶菌素的问题可以通过以下方式解决:①寻找并确定可以穿透外膜的天然裂解酶;②利用溶血素与EDTA、柠檬酸、苹果酸和阳离子肽等外膜渗透剂的协同作用,促进裂解酶的裂解效果;③融合蛋白表达可穿透外膜的肽等[17,24]。本研究中,我们从幽门螺杆菌噬菌体KHP30中筛选得到可有效裂解幽门螺杆菌的双组分裂解系统即噬菌体穴蛋白和裂解酶,通过设计改造得到改良型裂解酶基因,采用穴蛋白-裂解酶和疏水多肽的融合表达来达到穿透外膜并裂解幽门螺杆菌的效果。在以后的研究中,可以设计更多具有膜渗透性的多肽,进而筛选出融合表达后具有更好裂解效果的改良型裂解酶。
本研究分别构建了具有裂解幽门螺杆菌作用的改良型裂解酶基因在大肠杆菌BL21(DE3)和毕赤酵母X33中的表达载体,并表达出改良型裂解酶。大肠杆菌中的表达载体pSUMO-改良型裂解酶须IPTG诱导,在胞内可溶性表达,需要经过破菌处理和Ni柱纯化再酶切激活,才能得到改良型裂解酶粗提物;而毕赤酵母中的表达载体pGAPZαA-改良型裂解酶无须诱导剂诱导,由组成型GAP启动子表达改良型裂解酶,直接分泌到胞外,发酵上清处理后可得到改良型裂解酶粗提物。因此,毕赤酵母表达系统在培养发酵及纯化方面更具优势,简单方便,有利于工业规模放大生产。然而,体外活性检测试验表明在相同浓度等条件下,大肠杆菌表达系统所表达的改良型裂解酶的裂菌效果强于毕赤酵母表达系统所表达的改良型裂解酶。可能由于幽门螺杆菌与大肠杆菌均属于原核细菌,亲缘性更近,表达的作用于原核细菌的蛋白酶活性更强;而毕赤酵母表达系统对表达的外源蛋白可进行糖基化等修饰,可能会对改良型裂解酶的活性有所影响。研究者可根据不同的试验需求选择不同的表达系统,为治疗幽门螺杆菌新型制剂的研究奠定了基础。自然界广泛存在噬菌体,大量的噬菌体裂解酶有待发现探索。对于难以攻克的革兰阴性菌噬菌体裂解酶,也可以通过基因重组技术设计改造,将其发展为新的生物酶抗菌制剂,用于治疗新出现的革兰阴性超级耐药细菌造成的感染[12,25-26]。
