铜绿假单胞菌waaL突变体构建及糖基化系统的建立
2020-03-10徐涵潘超黄竞冯尔玲朱力王恒樑
徐涵,潘超,黄竞,冯尔玲,朱力,王恒樑
军事医学研究院 生物工程研究所,北京 100071
铜绿假单胞菌(Pseudomonas aeruginosa,Pa)又名绿脓杆菌,是一种非发酵革兰阴性菌,菌体细长,有单鞭毛和荚膜,无芽胞,具有易定植、易变异和多耐药的特点,常感染于烧伤创面或皮肤、尿路和心脏瓣膜等解剖部位,引起术后感染[1-2],或在机械通气或慢性肺囊性纤维化患者中引起肺部感染[3]。目前对Pa感染的治疗主要依靠抗生素,但Pa耐药现象严重,泛耐药甚至全耐药的菌株不断增多,使其可用的敏感药物越发有限,因此Pa感染的治疗也越来越困难[4-5]。除了抗Pa感染的药物治疗,疫苗接种也是其防控的重要策略,已有许多不同的抗Pa感染疫苗和几种单克隆抗体被研制出来,但只有少数达到了临床阶段,尚无相应的产品上市[5]。
脂多糖(lipopolysaccharides,LPS)是革兰阴性菌外膜的主要成分,在细菌黏附和防御中起重要作用,同时也是Pa重要的毒力因子[6]。LPS由脂质A、核心多糖和O-抗原多糖(O-antigen polysaccharide,OPS)三部分组成,OPS位于脂多糖的最外层。Pa的O-抗原连接酶由waaL基因编码,负责将合成于内膜胞质侧的OPS在周间质中连接到脂质A核心上合成LPS[7]。研究表明,针对OPS的抗体可介导针对Pa感染的高水平免疫力[8]。
多糖结合疫苗是目前最为成功的细菌性疫苗形式[9-10]。它是将病原菌表面多糖与底物蛋白偶联,使T细胞得以参与免疫应答并产生高亲和力的抗体和免疫记忆。近年来,多个利用化学法生产的多糖结合疫苗已经上市。研究发现,糖蛋白在细菌体内的合成途径与LPS合成非常相似,存在于周间质的游离多糖在糖基转移酶或O-抗原连接酶的催化下,可以从脂质载体转移至底物蛋白或脂质A核心。利用这种相似性,可以通过对LPS合成途径改造,将OPS连入目标载体蛋白,从而制备多糖结合疫苗。
在本研究中,我们首先通过同源双交换法缺失了编码铜绿假单胞菌PAO1株O-抗原连接酶的基因waaL,使PAO1株无法合成完整的LPS,并在周间质中积累“游离”的OPSPa。之后,我们在缺失株中转入构建的具有四环素抗性的O-连接糖基化工程载体,即共表达脑膜炎耐瑟球菌的糖基转移酶PglL和带有糖基化序列的重组霍乱毒素B亚 单 位(recombinantcholera toxin B subunit,rCTB),细菌周间质中的“游离”OPSPa在PglL催化下转移到rCTB,形成糖蛋白,证明了利用这种生物方法制备Pa多糖结合疫苗的可行性,为下一步糖蛋白纯化、疫苗制备及效果评估奠定了基础。
1 材料和方法
1.1 材料
铜绿假单胞菌PAO1株由本实验室保存,培养于液体LB培养基(0.5%酵母粉、1%氯化钠和1%蛋白胨)或含1.5%琼脂的固体LB培养基,培养温度为37℃;大肠杆菌DH5α感受态细胞购自全式金生物有限公司,培养基及培养温度同上。为了诱导蛋白表达,细菌首先在37℃的液体LB培养基中培养至D600nm值约为0.6时,加入IPTG至终浓度为1 mmol/L,并在30℃继续培养10 h。根据需要,加入四环素(50 μg/mL)用于质粒的选择。
糖基工程质粒pET28a-PglL-rCTB(表达PglL和底物蛋白rCTB)[10],仅表达底物蛋白rCTB的质粒pET28a-rCTB,抗性扩增质粒pCasPA、pJQ200SK以及自杀质粒pCVD442均由本实验室保存;限制性内切酶BglⅡ、XbaⅠ及SmaⅠ购自NEB公司;质粒提取试剂盒、DNA凝胶产物回收及PCR产物回收试剂盒购自江苏康为世纪生物科技有限公司;API50CHB试纸条购自Biomerieux公司;引物由北京天一辉远公司合成。
1.2 铜绿假单胞菌PAO1株waaL基因的敲除及验证
用同源双交换法敲除PAO1株的waaL基因,流程如图1。根据PAO1株waaL基因及上下游序列,设计构建打靶片段所需引物(表1)。以PAO1株为模板,用引物waaL-5F/waaL-5R扩增上游同源臂,用引物waaL-3F/waaL-3R扩增下游同源臂;以pJQ200SK质粒为模板,用引物Gm-F/Gm-R扩增庆大霉素抗性基因(Gm);之后将waaL基因上游同源臂、Gm抗性基因、waaL基因下游同源臂通过融合PCR技术连接,得到完整打靶片段ΔwaaL::Gm(上游同源臂-Gm抗性基因-下游同源臂),再将其与SmaⅠ酶切的自杀质粒pCVD442相连,获得打靶质粒pCVD442-ΔwaaL::Gm。将pCVD442-ΔwaaL::Gm电转化具有性菌毛的大肠杆菌β2155,获得供体菌β2155/pCVD442-ΔwaaL::Gm,并将供体菌与Pa受体菌接合,在Gm平板(含Gm 50 μg/mL)上筛选获得Gm抗性的Pa克隆(基因组整合有打靶质粒),命名为PAO1/pCVD442-ΔwaaL::Gm。以基因组上waaL上下游同源臂以外的一对引物waaL-outF/waaL-outR及Gm内部引物Gm-seqF/Gm-seqR组合成5′端交叉引物(waaL-outF/Gm-seqR)和3′端交叉引物(Gm-seqF/waaL-outR)进行此次重组的验证。取数个验证成功的PAO1/pCVD442-ΔwaaL::Gm克隆菌液涂布于含10%蔗糖(含Gm 50 μg/mL,不含NaCl)的LB平板上,培养至生长出单克隆,利用SacB基因内部引物SacBF/SacB-R、waaL基因内部引物waaL-F/waaL-R和外部引物waaL-outF/waaL-outR筛选waaL基因被Gm抗性基因插入打断的克隆,命名为PAO1ΔwaaL。

表1 基因敲除引物

图1 同源双交换法基因敲除简图
1.3 铜绿假单胞菌PAO1株及waaL基因缺失株的LPS银染
取培养后的菌液1 mL,5000 r/min离心1 min后收集菌体,加入 100 μL 1×SDS缓冲液重悬。沸水浴10 min,冷却至室温,加入10 μg蛋白酶K,60℃消化2 h。离心取上清进行SDSPAGE,待溴酚蓝出胶后,将胶取出浸没于固定液(10%冰乙酸,40%无水乙醇)中振荡30 min,其间更换一次固定液,置于增敏液(0.1%硫代硫酸钠,6.8%乙酸钠,30%无水乙醇,0.25%戊二醛)中振荡30 min,用ddH2O洗3次,每次15 min;加入银染液(0.25%硝酸银,0.04%甲醛)反应20 min,用ddH2O洗2次,每次1 min;加入显影液(2.5%碳酸钠,0.04%甲醛,0.006%硫代硫酸钠),观察LPS的颜色,在反应到颜色最佳时倒入终止液(1.46%乙二胺四乙酸二钠)终止反应。
1.4 铜绿假单胞菌PAO1株及waaL基因缺失株的生长代谢状况测定
将铜绿假单胞菌PAO1株及waaL基因缺失株同时接种培养于50 mL液体培养基中,记录12 h的菌液D600nm值;将PAO1野生株和waaL基因缺失株同时在LB固体培养基上培养过夜,用API 50CHB试纸条对野生株和缺失株的糖代谢水平进行测定,比较2株菌的糖代谢差异。
1.5 四环素抗性表达载体构建
由于Pa为耐药菌株,因此我们选择PAO1菌株敏感的四环素(tetracycline,Tet)抗性,以质粒pCasPA为模板扩增Tet片段[引物为Tet-F(5′-G AAGATCTTGGCGTACTGTTGTGGT-3′,下划线序列为BglⅡ酶切位点)、Tet-R(5′-GCTCTAGATATAG CTTGCCGGAAGTC-3′,下划线序列为XbaⅠ酶切位点)]后用限制性内切酶BglⅡ和XbaⅠ双酶切,并与经同样双酶切的糖基工程质粒pET28a-PglL-rCTB和对照质粒pET28a-rCTB连接,得到带有Tet抗性的糖基工程质粒pET28a-PglL-rCTB-Tet及对照质粒pET28a-rCTB-Tet,将2个质粒分别电转PAO1野生株和PAO1ΔwaaL感受态细胞。
1.6 铜绿假单胞菌PAO1株及waaL基因缺失株的糖蛋白诱导表达及验证
挑取含有对应质粒的克隆(pET28a-PglL-rCTB-Tet/PAO1,pET28a-rCTB-Tet/PAO1,pET28a-PglL-rCTB-Tet/PAO1ΔwaaL,pET28a-rCTB-Tet/PAO1ΔwaaL)接种于5 mL LB液体培养基,培养至菌液D600nm至2.0时,按1∶100转接于5 mL LB液体培养基,37℃培养至菌液D600nm为0.6~0.8时,加入终浓度为1 mmol/L的IPTG,30℃培养10 h诱导蛋白表达。次日,每个样品取1 mL,5000 r/min离心1 min收集菌体沉淀,加入1×SDS缓冲液重悬,沸水浴10 min后进行SDS-PAGE,用鼠源HRP-Anti-His tag抗体进行Western印迹检测。
2 结果
2.1 铜绿假单胞菌PAO1株waaL基因缺失株的PCR验证
用同源双交换法敲除PAO1株的O-抗原连接酶waaL基因,首先在受体菌PAO1与供体菌大肠杆菌β2155/pCVD442-ΔwaaL::Gm接合后,在Gm抗性平板上随机挑选10个克隆,在插入位置两端分别用上游交叉引物waaL-outF/Gm-seqR和下游交叉引物Gm-seqF/waaL-outR进行PCR鉴定,在5′端插入位置用waaL-outF和Gm-seqR引物PCR验证将有1644 bp的片段产生,在3′端插入位置用Gm-seqF和waaL-outR引物验证将有1369 bp的片段产生,结果(图2A、B)显示多个克隆两侧插入位置都有预期长度的扩增片段,即第一次交换成功。
选择第9号克隆接种于5 mL LB培养基,于30℃培养过夜,次日取50 μL培养液铺于含10%蔗糖的LB平板(含Gm 50 μg/mL),30℃培养至单克隆形成。随机挑选10个单克隆,分别接种于5 mL LB 培养基(含 Gm 50 μg/mL),30℃培养过夜。取少量菌液用自杀质粒pCVD442上SacB基因的内部引物进行PCR鉴定,结果见图2C,全部克隆均为阴性扩增,即已发生二次重组。
选取3号阳性克隆用waaL基因外部引物和内部引物进行PCR扩增,发现野生株、缺失株均有特异性扩增产物且长度与预期符合。外部引物Gm基因插入菌株的扩增长度为2989 bp,野生株扩增长度为2427 bp(图2D);内部引物Gm基因插入菌株的扩增长度为1046 bp,野生株扩增长度为208 bp(图2E)。同时经测序比对,与设计一致,将这一缺失株命名为PAO1ΔwaaL。
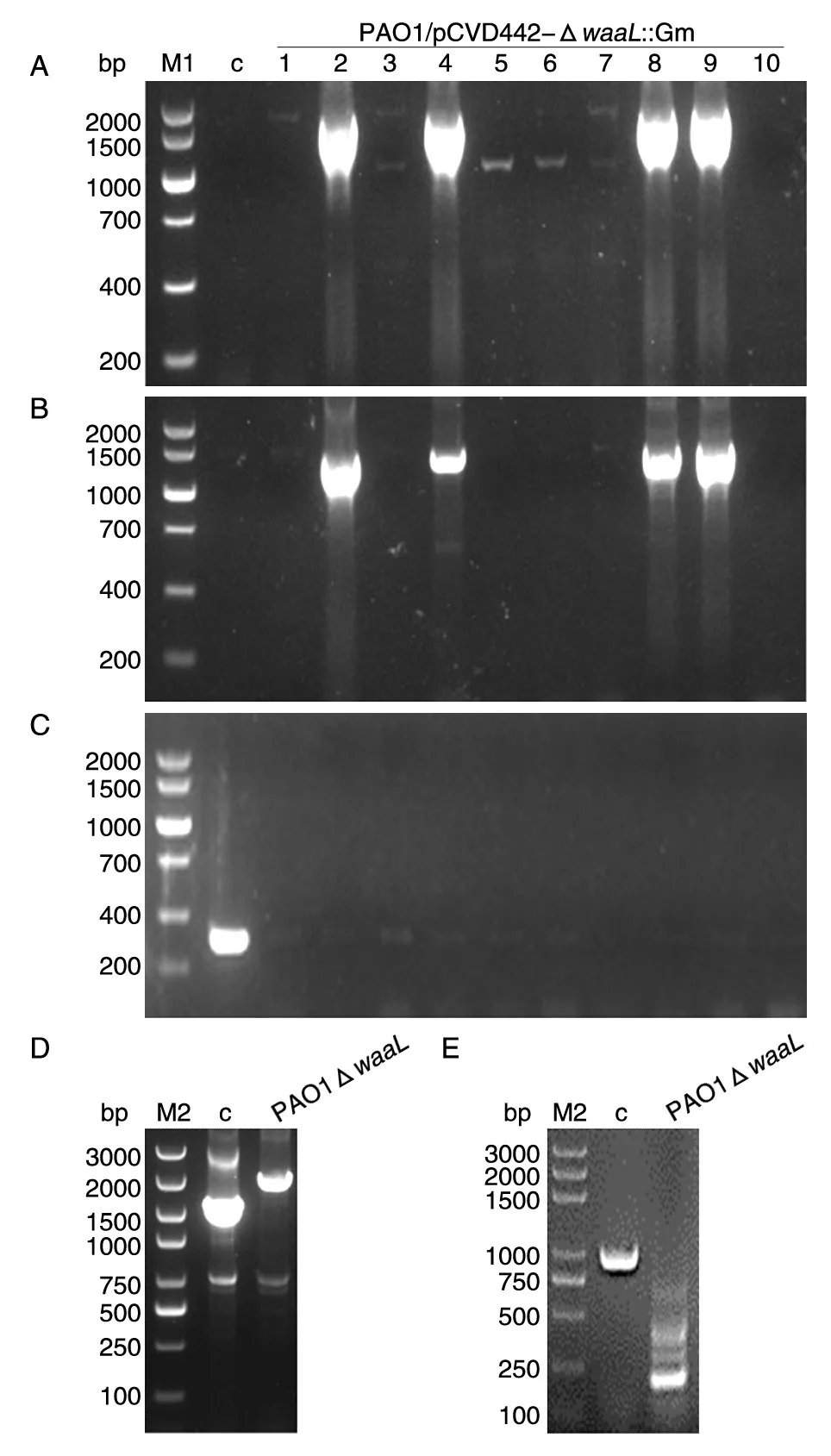
图2 铜绿假单胞菌PAO1株waaL基因缺失株的PCR鉴定
2.2 铜绿假单胞菌PAO1株及waaL基因缺失株的表型和生长代谢状况验证
用PCR验证了PAO1株waaL基因缺失之后,采用LPS银染在菌株表型上对敲除进一步验证,结果如图3A。敲除waaL基因后,PAO1ΔwaaL无法检测到LPS典型的梯状条带,表明PAO1ΔwaaL中的waaL基因O-抗原连接功能已失活,无法将OPSPa连接于脂质A核心。进一步对waaL缺失后的生长代谢进行评估,通过对野生株和缺失株的生长曲线进行测定,发现二者的生长速度和趋势无明显差异(图3B);利用API50CHB试纸条分析糖利用情况,除了甘油、核糖代谢稍有差异之外,其他糖代谢无明显差异(图3C,表2),表明waaL缺失对菌株生长和代谢无明显影响。

表2 API50CHB试验条0~9管底物

图3 PAO1野生株和waaL基因缺失株的表型及生长代谢状况验证
2.3 底物蛋白的表达及糖基化验证
在确定waaL基因缺失成功后,我们对缺失株中的“游离”OPSPa能否被PglL识别并催化连接于底物蛋白进行了验证。将糖基工程载体分别导入野生株PAO1和缺失株PAO1ΔwaaL,同时以只表达底物蛋白的载体为对照,得到含有对应质粒的克隆(pET28a-rCTB-Tet/PAO1,pET28a-PglL-rCTB-Tet/PAO1,pET28a-rCTB-Tet/PAO1ΔwaaL,pET28a-PglL-rCTB-Tet/PAO1ΔwaaL),IPTG 诱导后,通过Western印迹检测糖基化表达情况,结果如图4。野生株和缺失株中转入只表达底物蛋白的载体pET28a-rCTB-Tet时,均能观察到底物蛋白rCTB的表达,相对分子质量约为15 000。rCTB与PglL共表达时,理论上“游离”的OPSPa在PglL催化下连接于rCTB,因此相对分子质量增加,在Western印迹上显示为蛋白条带向上迁移;然而,在野生株中糖基化条带非常微弱,几乎不可见(图4A)。而当缺失株中转入糖基化表达载体并诱导表达后,与野生株条带相比,在相对分子质量35 000~45 000处有明显的梯状糖基化条带,说明糖基转移酶PglL能将OPSPa转移到载体蛋白rCTB上,产生了糖蛋白rCTB-OPSPa(图4B)。与野生株相比,waaL基因的缺失使得糖基化效率显著增加。

图4 底物蛋白rCTB的糖基化验证
3 讨论
Pa的LPS是其重要的毒力因子,在对常用抗生素产生耐药性方面具有重要作用,LPS结构的持续变化是Pa适应慢性感染的关键因素[11]。特别的是,Pa能产生2种不同形式的LPS,分别称为A带和B带,二者均具有免疫原性。A带为普通多糖抗原,普遍存在于Pa,一般是D-鼠李糖(DRhaB)的均聚物;B带是一种血清型特异性脂多糖,可作为血清分型的依据,一般是由3~5种不同单糖组成的杂聚物。PAO1菌株的B带为2-乙酰氨基-3-乙酰氨基-2,3-二脱氧甘露醛酸(Man[2NAc3N]a)、2,3-二乙酰氨基-D-甘露糖酸(2,3-diNAcManA)和2-乙酰氨基-2,6-二脱氧-D-半乳糖(N-乙酰岩藻糖胺;Fuc2NAc)组成的重复单元[12-13]。OPS通常被认为是Pa的主要保护性抗原,也是细菌的主要毒力因子,因此可以作为疫苗研发的靶点[14]。因此,我们对PAO1的waaL基因进行敲除,在缺失株中建立了糖基化系统,将其OPS连入载体蛋白,可用于后期制备Pa的多糖结合疫苗。
Pa的耐药机制较为复杂,能够通过多种方式对抗生素产生耐药性[15],给临床治疗用药的选择带来了困难。目前尚无安全可靠的抗Pa感染疫苗,亚单位疫苗是研究热点。有研究者将纯化的Pa的OPS分子与Pa外毒素A结合,合成了八价多糖结合疫苗,尽管免疫效果较好,但由于种种原因仍未能上市[14]。多糖结合疫苗已成为预防病原菌感染最有效的手段之一,因此它可能会成为抗Pa传染的重要手段。糖基化系统的建立是多糖结合疫苗研发过程中的关键一步[16]。本研究中,我们应用了本实验室自主构建的O-连接糖基化系统,得到了连接有PAO1株OPSPa的糖蛋白。糖基工程载体由PglL和CTB两个关键部分组成,PglL宽松的底物特异性已在多个菌株中得到验证;CTB是已知的最有效的黏膜佐剂之一,具有五聚体结构,可以为抗原提供更复杂的结构,有利于抗原提呈激发更有效的免疫应答[9-10],我们在CTB基础上添加了糖基化识别位点,成功使其糖基化。PAO1株O-抗原连接酶waaL基因的敲除使得OPS在周间质累积,导入糖基工程载体之后,由于缺少waaL的竞争,“游离”的OPSPa被PglL转移到rCTB底物蛋白上,糖基化效率远远高于PAO1野生株,证明了敲除waaL基因的必要性。通过建立糖基化系统,我们合成了Pa糖蛋白结合物,下一步将会对糖基化产率以及多糖特异性进行进一步验证。
综上,我们敲除了PAO1株的O-抗原连接酶基因,并在菌体内表达了连接有OPS的糖蛋白,为后续抗体制备、菌株进一步减毒以及其他表达验证做了前期准备,并验证了O-连接糖基化系统可以在Pa中成功应用,进一步扩宽了该系统的应用范围。虽然尚有一些问题需要解决,比如目前还不确定与底物蛋白结合的OPS为A带还是B带,以及糖蛋白结合疫苗的保护性仍待评价,但缺失株的构建以及糖蛋白的成功表达作为Pa多糖结合疫苗的前期探索,已经为后续糖蛋白的纯化和免疫实验打下了坚实的基础,具有极大的拓展性。
