asm基因表达量与安丝菌素P-3产量相关性分析
2020-03-10朱佳琪王微朱晨陈飞3程宏3冯宝民刘刚陈惠鹏
朱佳琪,王微,朱晨,陈飞3,,程宏3,,冯宝民,刘刚,陈惠鹏
1.大连大学,辽宁 大连 116622;2.廊坊师范学院,河北 廊坊 065000;
3.安徽大学,安徽 合肥 230601;4.军事科学院 军事医学研究院,北京 100850
安丝菌素(ansamitocins)是由珍贵束丝放线菌(Actinosynnema pretiosum)生产的美登素类生物碱,是一种聚酮大环内酰胺苯安莎类抗生素[1-2],1977年首次由Hgashide等在诺卡菌的发酵液中分离得到[3]。安丝菌素类化合物共有20多种[4],其中在大环母核C-3位侧链连接有异丁酰基的安丝菌素 P-3(ansamitocin P-3,AP-3)为发酵液中的主产物,含量最多,抗肿瘤活性最强。AP-3不仅对肿瘤细胞微管蛋白聚合有强烈的抑制作用[5],同时表现出可诱导激活基于免疫的抗肿瘤机制[6-7],目前以AP-3为化学前体合成的抗体偶联药物已经获批上市用于治疗乳腺癌[8]。
安丝菌素的生物合成主要分为三个阶段,第一阶段由葡萄糖进入糖酵解(EMP)途径生成的葡萄糖-6-磷酸(G6P)经葡萄糖磷酸变位酶转化为葡萄糖-1-磷酸(G1P),在谷氨酰胺参与下经莽草酸途径合成3-氨基-5羟基苯甲酸(AHBH)[9-10];第二阶段由AHBH经asmA、asmB、asmC和asmD编码依次添加乙酸、丙酸和羟基乙酸合成单元形成安丝菌素母环结构[11];第三阶段由安丝菌素母环经氯代、甲基化和酰基化等后修饰步骤最终合成为AP-3[12]。
安丝菌素的代谢调控包括基因asm1~asm48参与结构域载入的催化与调控、基因asmA~asmD负责AHBH聚酮碳链的延伸,两部分共同分布在AP-3生物合成的2条合成基因簇上[10],其中还有一些基因的功能尚不明确。本研究选取asm合成基因簇中6种功能尚不明确的基因,通过实时定量PCR检测这些基因在AP-3生产过程中的动态表达,分析其与AP-3产量的相关性。
1 材料与方法
1.1 材料
珍贵束丝放线菌橙色亚种(A.pretiosumATCC31565)(本实验室);安丝菌素P-3标准品(Enzo);色谱级甲醇(Thermo Fisher);QuantScript RT Kit、RealMaster Mix(SYBR Green)(北京天根生化科技有限公司);TRIzol试剂(Invitrogen);Q5 High-Fidelity DNA 聚合酶、dNTPs(NEB);DNA marker(TaKaRa);溶菌酶(Solarbio)。
ISP2培养基(g/L):酵母粉4,麦芽提取物10,葡萄糖4,琼脂粉20,110℃灭菌20 min。种子培养基(g/L):酵母提取物4,麦芽糖10,葡萄糖4,NaCl 1.5,110℃灭菌20 min。发酵培养基(g/L):酵母提取物4,麦芽糖10,可溶性淀粉20,NaCl 1.5,121℃灭菌20 min。
Symmetry Columns C18色谱柱、600高相液相色谱仪(Waters);DNA Engine PTC-200 PCR仪、IQ5实时荧光定量 PCR仪(Bio-Rad);Nanodrop 2000核酸定量分析仪(Thermo Fisher)。
1.2 AP-3检测与提取方法
采用高效液相色谱(HPLC)法检测AP-3,固定相为Symmetry Columns C18色谱柱,流动相为超声脱气的甲醇/水(体积比85∶15),流速1 mL/min,柱温28℃,检测波长254 nm,进样量10 μL。
用色谱级甲醇配制AP-3标准品的标准溶液,制作标准曲线,稀释为25、50、125、250、500、750、1000 mg/L的标准溶液分别进行HPLC检测,每浓度重复进样3次。以标准品溶液浓度为横坐标、峰面积为纵坐标绘制标准曲线,直线拟合方程为y=14520x,R2=0.997。
将斜面培养的放线菌孢子刮下接种于种子培养基中摇制种子液,种子液以2%接种至发酵培养基进行发酵培养得到AP-3的发酵液。发酵液经等体积乙酸乙酯重复萃取3次,集中萃取液50℃旋转蒸干,以500 μL色谱级甲醇定容,通过0.22 μm微孔滤膜后进行HPLC检测,根据标准曲线计算发酵液中的AP-3含量。
1.3 反转录合成cDNA
采用TRIzol法提取放线菌总RNA,用Nanodrop 2000核酸定量分析仪检测浓度后,用北京天根生化有限公司的反转录试剂盒合成cDNA第一链。
1.4 引物设计
在NCBI网站检索安丝菌素生物合成基因簇中相关未知基因和调控基因序列,利用软件设计对应的引物(表1),进行25 μL体系的普通PCR扩增,产物经琼脂糖凝胶电泳鉴定,用凝胶成像仪拍照。

表1 引物及序列
1.5 实时荧光定量PCR
扩增的基因经鉴定后进行实时荧光定量PCR分析。以16S rRNA为内参基因,培养1~7 d每天分别提取的放线菌cDNA为模板,与放线菌培养第 1 d 的 cDNA 相比,用 E-ΔΔCt法分析各基因在不同时间的相对表达水平。
1.6 相关性分析
对基因相对表达量与AP-3产量数据进行Pearson相关性分析,计算Pearson相关系数,用以反映二者的相关性。
2 结果
2.1 发酵液中AP-3含量检测
放线菌液体摇瓶连续发酵10 d,每24 h取样,经乙酸乙酯3次萃取后旋转蒸干,再经色谱级甲醇溶解定容后通过滤膜进行HPLC检测发酵液中AP-3的含量,在发酵第7 d时AP-3产量达到最高,约70 mg/L(图1)。
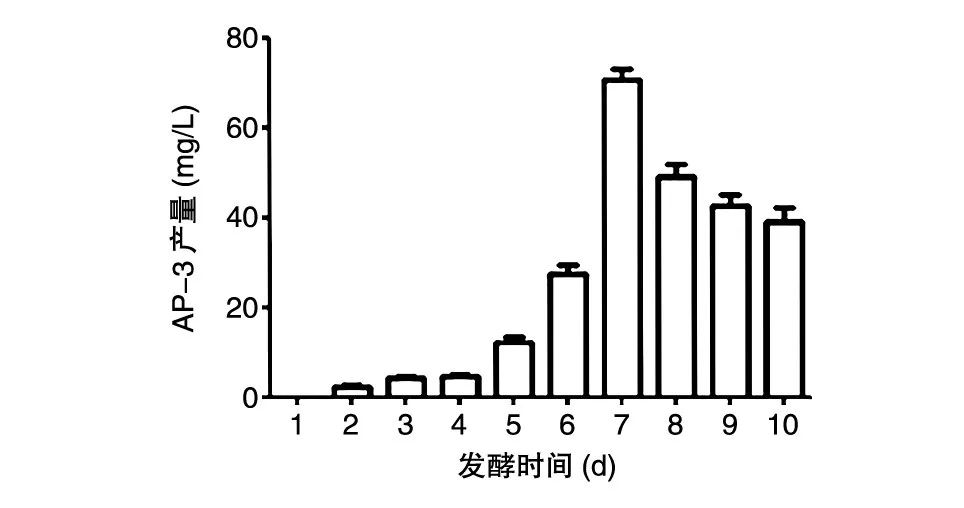
图1 安丝菌素P-3产量
2.2 引物的特异性验证
束丝放线菌的基因组内有较高含量的GC碱基对,因此采用高GC含量扩增效果更好的Q5 High-Fidelity DNA聚合酶进行PCR实验。在进行实时荧光定量PCR前,进行了普通PCR扩增,应用琼脂糖凝胶电泳对扩增效果与引物特异性进行检测。由图2可看出,所选基因经过普通PCR的验证,均可扩增出单一目的条带,说明对应引物具有特异性,可以满足后续实时荧光定量PCR的需要。

图2 PCR扩增产物琼脂糖凝胶电泳结果
2.3 实时荧光定量PCR检测基因表达量
以16S rRNA为对照,实时荧光定量PCR检测各基因的表达量,应用E-ΔΔCt法分析各基因不同时间点的表达水平。结果表明,asm2和asm36基因表达量随时间的增加而提高(图3A、E);asm30基因表达水平最高出现在第6 d,随后降低(图3D);asm20和asm39基因表达在早期维持低水平,第7 d达到高点(图3B、F);asm28基因在第4 d表达水平较高,之后快速下降(图3C)。

图3 asm基因相对表达量
2.4 基因表达量与AP-3产量相关性分析
分析表明,asm2和asm36基因表达量与AP-3产量具有显著正相关性(P<0.001,图 4A、E);asm20和asm39基因表达量与AP-3产量具有正相关性(P<0.05,图4B、F);asm28和asm30基因表达量与AP-3产量未表现出明显相关性(图4C、D)。
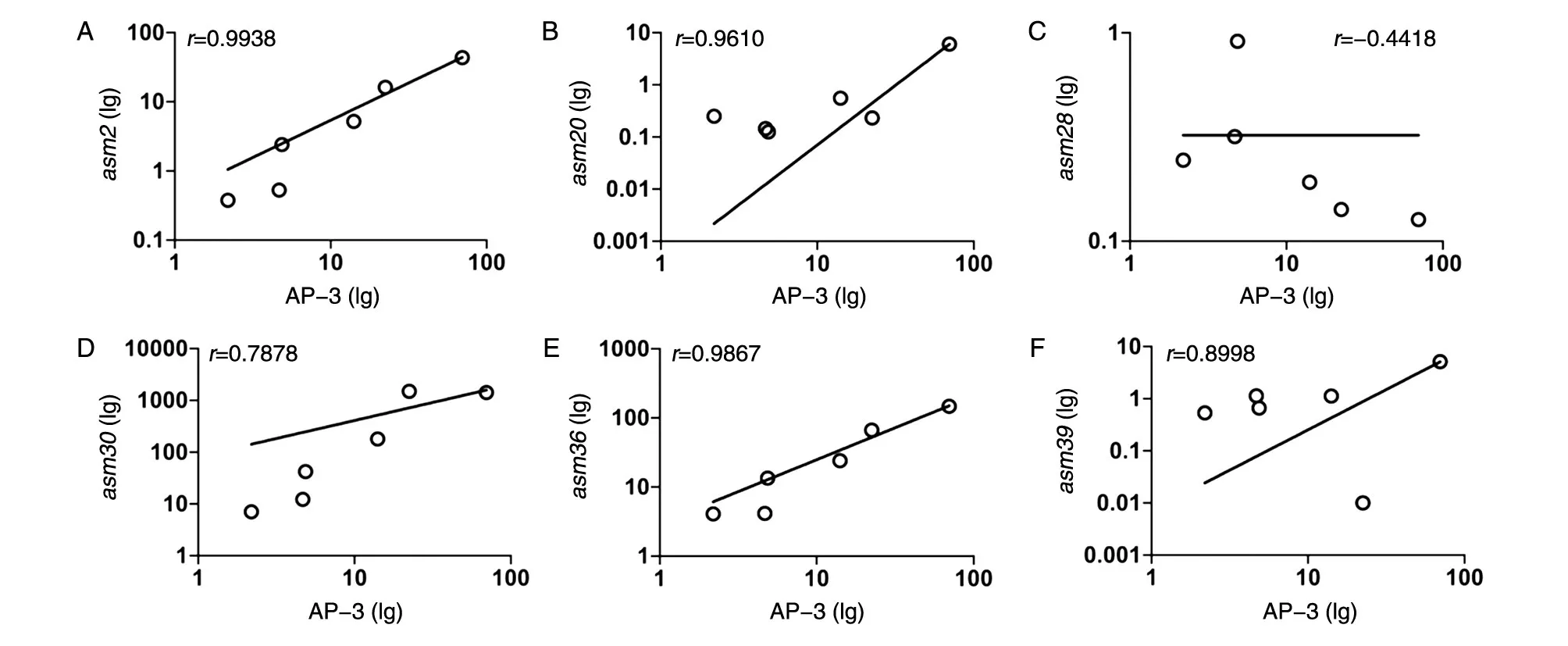
图4 asm基因相对表达量与AP-3产量相关性分析
3 讨论
安丝菌素的天然发酵产率较低,目前国内外研究者提高其产量主要通过对发酵工艺优化和合成途径改造两大方面来实现。在安丝菌素生物合成途径中,已证明asm基因簇内较多基因功能直接决定AP-3的结构与产量,但仍有一些相关基因的功能尚不清楚。研究这些基因的表达与安丝菌素合成之间的关系,可以为提高安丝菌素产量的生物学改造提供候选基因。我们发现在安丝菌素生产过程中,asm2和asm36基因的表达与安丝菌素产量显著正相关;asm20、asm30和asm39基因的表达在安丝菌素生产后期显著升高;而asm28基因的表达在生产早期迅速升高,在后期降低。Ng等[13]的研究表明,asm2和asm39基因过表达菌株,其AP-3产量分别提高1.6和2.5倍;而Ning等[14]的研究显示,asm30基因失活使AP-3产量提高66%。结合我们的结果,可以发现在AP-3生产过程中,表达量与AP-3产量呈正相关的基因对AP-3的产量呈现正向调控作用,如asm2和asm36。对于asm30基因,我们的研究表明其在AP-3生产早期表达上升,第6 d达到高点后下降,而AP-3产量在第7 d显著升高。这与Ning的研究相符合,提示在早期抑制该基因活性可以缩短宿主菌发酵周期,提高安丝菌素产率。
本研究结果与文献报道的相关结论具有很好的一致性。我们猜测某些asm基因的表达量与AP-3产量的相关性可以揭示该基因对于AP-3合成的调控功能,为今后提高AP-3产量的合成途径改造提供了候选基因,进一步明确其调控AP-3合成的基因功能,为后续AP-3产量的提高奠定基础。
