桃仁多肽螯合亚铁的结构表征及体外模拟消化
2020-03-06杨玉蓉李安平钟政昌
杨玉蓉 李安平* 钟政昌 李 刚
(1 中南林业科技大学食品科学与工程学院 长沙410004
2 西藏农牧学院食品科学学院 西藏林芝860000)
缺铁性贫血是一种常见的营养缺乏病[1]。目前补铁主要是补充有机或无机亚铁盐产品,如硫酸亚铁、葡萄糖酸亚铁、富马酸亚铁和乳酸亚铁等[2-3]。这些铁盐补铁剂存在生物利用度低,铁腥异味重,稳定性差,对人体胃肠道有副作用等问题[4],而多肽与亚铁盐形成的多肽螯合亚铁则具有更好的功能特性。Lucia de la Hoz等[5]研究表明,多肽亚铁螯合物可直接被肠道细胞吸收,对肠道没有副作用。Jaiswal A等[6]指出金属元素与多肽螯合后能够有效提高二价金属的生物利用度。斯兴开等[7]研究表明带鱼多肽螯合亚铁能够有效改善缺铁性贫血大鼠症状。廉雯蕾等[8]以米蛋白为原料,制备出的米蛋白肽螯合亚铁具有良好的稳定性。李玉珍等[9]对以花生粕为原料,对亚铁螯合物的制备工艺进行优化,并对其结构进行表征。各种多肽与亚铁盐经适当方式螯合成的多肽螯合亚铁,是当前的研究热点[7]。
桃仁为蔷薇科植物桃或山桃的干燥成熟种子,桃仁脱油后的主要成分为蛋白质。本试验以桃仁蛋白质为原料,探讨经酶解和超滤分离制备的不同分子质量多肽与亚铁离子螯合成多肽螯合亚铁的条件和结构表征,并进行体外模拟消化,以期为进一步开发桃仁多肽螯合亚铁提供理论基础。
1 材料与方法
1.1 材料与试剂
桃仁蛋白粉,实验室自制;碱性蛋白酶(200 U/mg),上海瑞永生物科技有限公司;大豆肽粉、玉米肽粉、鱼胶原蛋白肽粉,河南华悦化工产品有限公司;硫酸亚铁片,山西力玖药业有限公司;乳酸亚铁片,南京市飞弘药业有限公司;胃蛋白酶(3 000U/mg),北京索莱宝科技有限公司;胰蛋白酶(250U/mg),北京索莱宝科技有限公司;氯化亚铁四水合物,西陇化工股份有限公司;盐酸羟胺、邻菲罗啉、乙酸钠,国药集团化学试剂有限公司。
1.2 仪器与设备
UV-1800紫外-可见分光光度计,日本岛津公司;F-4600荧光分光光度计,日本日立公司;IRTracer-100傅里叶变换红外光谱仪,日本岛津公司;S-3400N扫描电子显微镜,日本日立公司;MSC300型杯式超滤系统,上海摩速科学器材有限公司。
1.3 方法
1.3.1 桃仁多肽螯合亚铁的制备 称取桃仁蛋白粉,加入碱性蛋白酶酶解,以8 000 r/min离心15 min,取上清多肽液,用超滤装置超滤分离,获得3个桃仁多肽组分PKP1(>10 ku)、PKP2(5~10 k u)、PKP3(<5 ku)和PKP(未超滤)对照组分,冷冻干燥后于-20℃贮藏备用。
参照林洋[10]的方法,稍作修改。将不同分子质量的桃仁多肽组分配成一定质量浓度的溶液,调pH值至6,加入质量分数为0.1%的抗坏血酸,然后置于37℃恒温振荡水浴锅中,按多肽与铁盐质量比3∶1加入FeCl2·4H2O,反应40min后,用等体积无水乙醇沉淀螯合物,离心后收集沉淀,干燥后得到多肽螯合亚铁粉末。
1.3.2 螯合率的测定 采用邻菲罗啉比色法[11]测定多肽螯合亚铁的铁离子质量,以不加铁离子标准液为空白对照,在510 nm处测定吸光值,绘制标准曲线(y=0.211x-0.0045,R2=0.9991)。计算多肽螯合亚铁中亚铁离子质量(M)。螯合率的计算公式:

式中:M0——反应溶液中亚铁离子质量(mg);M——多肽螯合亚铁的亚铁离子质量(mg)。
1.3.3 紫外光谱分析 取氯化亚铁、不同分子质量的桃仁多肽及其对应的多肽螯合亚铁粉末,用去离子水将其配制成质量浓度为0.5mg/mL的样液,比较它们在波长190~480 nm范围的紫外吸收变化情况。
1.3.4 荧光光谱分析 取不同分子质量桃仁多肽及其多肽螯合亚铁粉末,用去离子水配制成质量浓度为0.1mg/mL的样液,然后在激发波长272 nm,发射波长290~500 nm范围测定样液荧光光谱。激发光与发射光的狭缝宽度均为5 nm。
1.3.5 傅里叶变换红外光谱分析 取1~2mg不同分子质量的桃仁多肽及其多肽螯合亚铁粉末,分别与200mg KBr混合,置于玛瑙研钵中研磨,研细后于压片模具上以150MPa加压5min。用IRTracer-100傅里叶变换红外光谱仪扫描样品,扫描范围4 000~400 cm-1,分辨率2 cm-1。
1.3.6 扫描电子显微镜观察 用棉签沾取少量桃仁多肽及多肽螯合亚铁粉末于涂有胶的盖玻片上,在37℃下干燥6 h以上,真空喷金后置于扫描电镜观察室中,加速电压为15 kV,工作距离4.3~4.6mm,工作温度25℃,放大10 000倍观察样品微观结构。
1.3.7 不同铁补充剂在模拟胃、肠道消化过程中铁离子释放率对比 参照Sitthipong Nalinanon[12]的方法并稍加修改。分别取亚铁离子含量为0.030 g的PKP3-Fe、硫酸亚铁片和乳酸亚铁片,然后将其分散在30mL pH 2的0.03mol/L NaCl溶液中,预热至37℃,按酶与底物比1∶30的比例加入胃蛋白酶,将溶液置于37℃恒温振荡培养箱中2 h,分别在模拟胃消化15,30,60,90,120min时取1 mL沸水浴灭酶5min,5 000 r/min离心5 min,测定上清液中铁离子释放率。
模拟胃部消化结束后,用0.9mol/L NaHCO3溶液将模拟胃部消化液pH值调至5.3,再用1 mol/L NaOH调节pH值至7.4,按酶与底物比为1∶25的比例加入胰蛋白酶,将模拟肠道消化液置37℃恒温振荡培养箱中3 h,然后分别在胃部消化120min的基础上,继续模拟肠道消化30,60,90,120,150,180 min时取1 mL沸水浴灭酶5 min,5 000 r/min离心5min后测定上清液中铁离子释放率。铁离子释放率按下式计算:

式中:Nt——消化液中游离铁离子质量(mg);N——消化液铁离子质量(mg)。
1.4 数据处理
每组试验均重复3次,数据结果表示为平均值±标准偏差。利用SPSS17.0统计软件进行Oneway ANOVA分析,显著性水平为P<0.05。
2 结果与讨论
2.1 不同食物来源多肽与氯化亚铁的螯合率比较
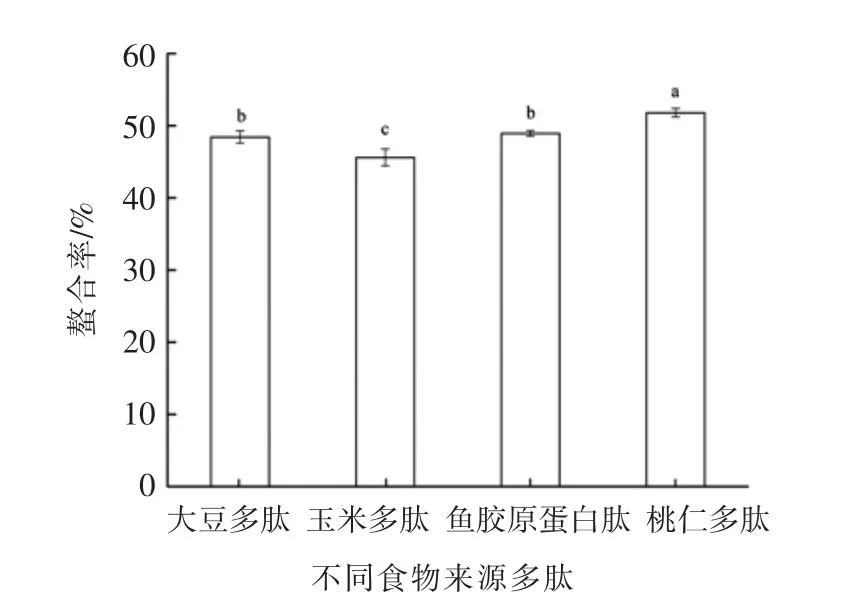
图1 不同食物来源的多肽与氯化亚铁的螯合率Fig.1 Chelating rate of peptide-ferrous complexes from different food sourses
将大豆多肽、玉米多肽、鱼胶原蛋白肽和桃仁多肽等4种多肽分别与氯化亚铁在一定条件下螯合,不同食物来源的多肽对螯合率的影响见图1。可以看出,4种食物来源的多肽与氯化亚铁形成螯合物的比率存在显著性差异(P<0.05),其中桃仁多肽的螯合率显著高于其它3种多肽,达53.81%,其次是大豆多肽和鱼胶原蛋白肽,最低的是玉米多肽,仅46.61%。
2.2 螯合铁源的选择
分别将0.5 g硫酸亚铁和氯化亚铁加入10 mL不同浓度的乙醇溶液中,两者的溶解性能见表1。在体积分数大于60%的乙醇中硫酸亚铁几乎不溶解,而氯化亚铁均能完全溶解。郑炯[13]在试验中也发现,氯化亚铁在乙醇中有更好的溶解性能。螯合反应结束后,可利用乙醇溶解未螯合的氯化亚铁,而多肽螯合亚铁在乙醇中沉淀析出,从而实现多肽螯合亚铁与无机铁的分离。乙醇中的溶解性能是筛选亚铁盐的一个重要参考因素。
将硫酸亚铁和氯化亚铁分别与桃仁多肽螯合,两者的螯合率如图2所示。氯化亚铁与桃仁多肽的螯合率显著高于硫酸亚铁(P<0.01)。最终选择氯化亚铁作为螯合铁源。
2.3 不同分子质量桃仁多肽与亚铁离子的螯合率比较
将超滤分离得到的3个多肽组分PKP1、PKP2、PKP3和桃仁多肽冻干粉PKP分别与氯化亚铁进行螯合,结果见图3。不同分子质量的桃仁多肽组分与氯化亚铁的螯合率存在显著性差异(P<0.05)。分子质量最大的PKP1组分的螯合率最低,仅22.37%,分子质量最小的PKP3组分具有最大亚铁离子螯合率,达58.34%。分子质量越小,螯合率越高。同样,Arvind Jaiswal等[6]在比较牛乳酪蛋白酶解的不同分子质量多肽组分的螯合率时发现,分子质量为3 000 u的多肽组分与亚铁离子螯合率高于分子质量为10 000 u的多肽组分。可能的原因是分子质量较小的组分,相比于大分子质量的组分具有更多的铁离子结合位点。
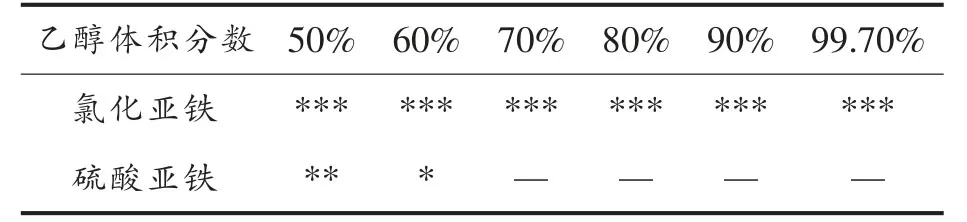
表1 两种铁盐在乙醇中的溶解情况Table1 The solubility of ferrous chloride and ferrous sulfate in ethanol
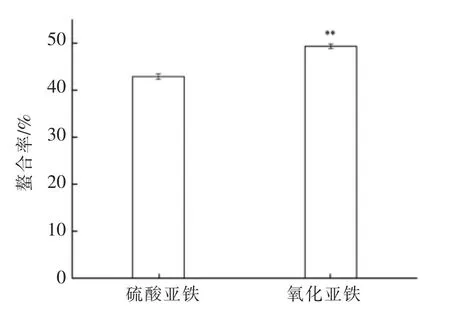
图2 硫酸亚铁和氯化亚铁与桃仁多肽螯合的螯合率Fig.2 The chelating rate of ferrous sulfate and ferrous chloride chelating peptides

图3 不同分子质量桃仁多肽组分与亚铁离子的螯合率比较Fig.3 Chelating rate of different molecular weight peptides and peptide-ferrous complexes
2.4 紫外光谱图分析
分别对相同浓度的氯化亚铁、桃仁多肽组分及其多肽螯合亚铁进行紫外扫描,验证桃仁多肽与亚铁离子的螯合情况,结果见图4。氯化亚铁在200 nm处有最大吸收峰,PKP1、PKP2和PKP3则分别在217.90,214.07 nm和215.08 nm处有最大吸收峰,而PKP1-Fe、PKP2-Fe、PKP3-Fe的最大吸收峰蓝移至207.89,205.68,209.16 nm处,多肽螯合亚铁的特征吸收峰处于氯化亚铁与相应分子质量多肽组分间。与多肽最大吸收峰值相比,相应多肽螯合亚铁的吸收峰值均明显增强。同时,桃仁多肽各组分在波长274 nm附近均有一弱吸收峰,而其多肽螯合亚铁却没有。由此可推断有新物质生成,多肽各组分与亚铁离子间可能螯合生成了多肽螯合亚铁。Sun Na等[14]将海参卵子水解肽与钙离子螯合后,在260 nm处的吸收峰发生偏移和消失的现象。Wang等[15]将钙离子与黄瓜籽多肽螯合后也有类似现象,且结论也类似。
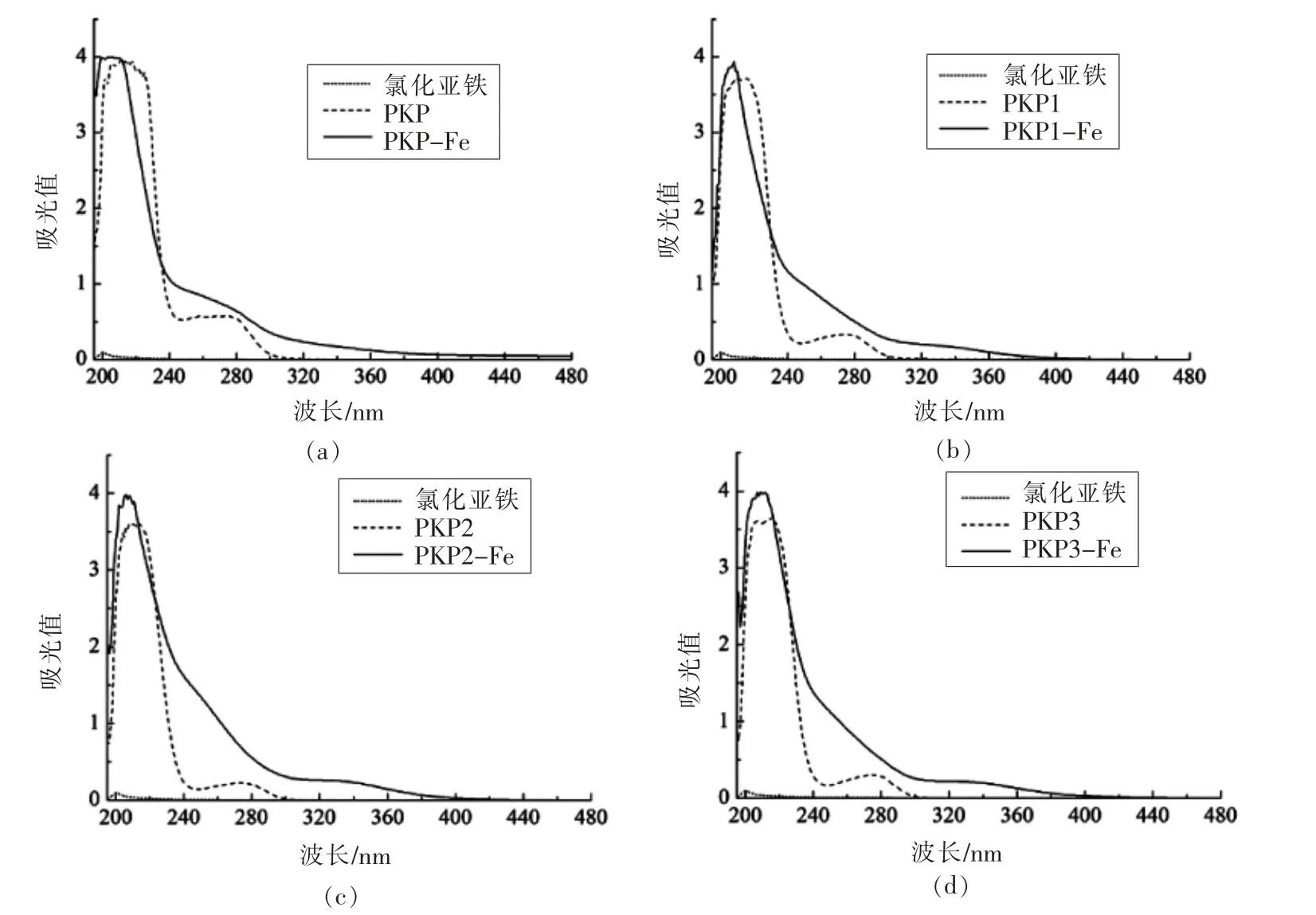
图4 氯化亚铁、桃仁多肽各组分及对应多肽螯合亚铁的紫外光谱图Fig.4 UV spectra of FeCl2,different molecular weight peptides and peptide-ferrous complexes
2.5 荧光发射光谱图分析
多肽各组分PKP、PKP1、PKP2、PKP3和多肽螯合亚铁各组分PKP1-Fe、PKP2-Fe、PKP3-Fe溶液的荧光发射光谱见图5。对比桃仁多肽各组分与相应的多肽螯合亚铁各组分在340 nm附近内源荧光强度可发现,多肽螯合亚铁各组分的荧光强度明显减弱甚至消失。其中分子质量最小的PKP3-Fe的内源荧光强度下降幅度最大,分子质量最大的PKP1-Fe降幅较小,原因可能是PKP3组分具有最强铁离子螯合能力,在螯合过程中分子结构发生较大变化而引起的。Zhao L N等[16]的研究也证实亚铁离子与多肽螯合导致螯合物荧光猝灭。Cai等[17]指出荧光强度减弱是多肽结构改变发生的典型标志。荧光发射光谱图表明多肽与亚铁离子螯合反应的存在。
2.6 傅里叶红外光谱分析
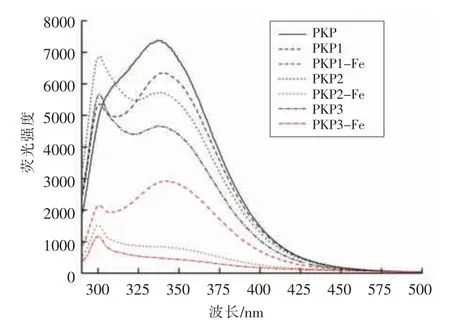
图5 不同分子质量桃仁多肽组分及对应多肽螯合亚铁的荧光光谱图Fig.5 Fluorescence spectra of different molecular weight peptides and peptide-ferrous complexes
多肽各组分PKP1、PKP2、PKP3与对应的多肽螯合亚铁各组分PKP1-Fe、PKP2-Fe、PKP3-Fe的红外光谱见图6。在3 700~3 000 cm-1处有一宽峰,为羟基和氨基伸缩振动导致的叠加峰[18],多肽各组分PKP1、PKP2、PKP3在此处吸收峰分别位于3 296.35,3 367.71 cm-1和3 361.93 cm-1,多肽螯合亚铁的吸收峰发生了位移,分别移至3 307.92,3 356.14 cm-1和3 360.96 cm-1处。
PKP1、PKP2和PKP3分别在1126.43,1126.43 cm-1和1 122.57 cm-1处有吸收峰,当与亚铁离子螯合后吸收峰均发生红移,分别移至1 122.57,1 114.86 cm-1和1 112.93 cm-1处。此处附近的吸收峰是由C-O伸缩振动引起[19],说明桃仁多肽与亚铁离子螯合后可能形成C-O-Fe结构。
1 400 cm-1左右为氨基酸残基侧链基团-COO-伸缩振动引起的吸收峰[20]。桃仁多肽各组分与亚铁螯合后均发生蓝移,PKP1、PKP2和PKP3的吸收峰分别从1398.39,1 400.32 cm-1和1400.32 cm-1蓝移至1411.89,1417.68cm-1和1417.6 cm-1,表明羧基氧也是铁离子螯合位点之一。
酰胺I带(1 700~1 600 cm-1)是由C=O伸缩振动引起的,N-H的弯曲振动和C-N的伸缩振动引起酰胺Ⅱ带(1 600~1 500 cm-1)[21]。桃仁多肽各组分与亚铁离子螯合后在酰胺Ⅰ带吸收峰没有发生位移,而在酰胺Ⅱ带发生位移,PKP1、PKP2和PKP3螯合后吸收峰位置由1 558.48,1 589.3 cm-1和1 597.06 cm-1分别红移至1 541.12,1 541.12 cm-1和1 558.48 cm-1,表明铁离子与多肽酰胺键上的N-H和C-N键配合,导致桃仁多肽在酰胺Ⅱ带的吸收峰红移。
桃仁多肽分子中的-COO-、N-H、C-N、O-H等与亚铁离子形成配位键,说明桃仁多肽中氨基、羧基和酰胺键均与铁离子发生了螯合反应。

图6 桃仁多肽各组分与对应多肽螯合亚铁的傅里叶红外光谱图Fig.6 FT-IR spectra of different molecular weight peptides and peptide-ferrous complexes
2.7 扫描电子显微镜观察
PKP3组分由于具有最大亚铁离子螯合率,因此对PKP3组分螯合前、后放大10 000倍进行扫描电子显微镜观察,结果见图7。二者的外观结构有明显不同,图7a显示PKP3桃仁多肽组分表面光滑,呈现聚集的絮状结构,而图7b显示PKP3组分与亚铁离子螯合形成的PKP3-Fe表面呈现1 μm左右的光滑球状颗粒状结构,表明多肽与Fe2+结合后结构发生变化。汪婧瑜等[22]在研究乌鳢多肽与亚铁螯合形成的物质时,通过SEM也观察到多肽螯合亚铁相似的微观结构。

图7 桃仁多肽PKP3组分及其多肽螯合亚铁SEM图Fig.7 Scanning electron micrograph of PKP3 and PKP3-Fe complex
2.8 不同铁补充剂在模拟胃、肠道消化过程中亚铁离子释放率对比
2.8.1 不同铁补充剂在模拟胃部消化过程中亚铁离子释放率对比 PKP3-Fe与硫酸亚铁片和乳酸亚铁片在模拟胃部消化过程中铁离子释放率变化如图8所示。PKP3-Fe、乳酸亚铁片和硫酸亚铁片3种补铁剂在模拟胃部消化过程中铁离子释放率之间存在显著性差异(P<0.05),其中PKP3-Fe显著低于乳酸亚铁片,而乳酸亚铁片又显著低于硫酸亚铁片。随着消化时间的延长,硫酸亚铁和乳酸亚铁一直处于较高的铁离子释放率状态,而PKP3-Fe的铁离子释放率从15min的49.52%显著增至90min的70.21%(P<0.05),此后PKP3-Fe的铁离子释放率趋于平缓,总体低于硫酸亚铁片和乳酸亚铁片的铁离子释放率。
在强酸性的胃部环境中补铁剂容易游离出铁离子,以游离态进入呈弱碱性的肠道中,容易与OH-形成Fe(OH)3沉淀而不被人体吸收。补铁剂在胃部释放的铁离子越少,在肠道吸收的铁就越多。在胃部,铁离子瞬间浓度过大,对胃部有一定的剌激作用[23]。PKP3-Fe的铁离子释放率在胃部增加的原因:一是胃蛋白酶进一步酶解多肽,破坏亚铁离子与多肽形成的配位键;二是胃液中H+浓度大,H+与Fe2+具有竞争作用,导致多肽螯合亚铁的铁离子释放率增大。相对而言,桃仁多肽螯合亚铁的配位键相比铁盐的离子键不易受到胃液的影响,对亚铁离子有一定的保护作用,而会受到胃蛋白酶酶解作用的影响。
2.8.2 不同铁补充剂在模拟肠道消化过程中亚铁离子释放率比较 PKP3-Fe与硫酸亚铁片和乳酸亚铁片在模拟肠道消化过程中亚铁释放率变化如图9所示。由于硫酸亚铁片和乳酸亚铁片在胃部大量释放,进入肠道后迅速形成Fe(OH)3沉淀,因此在肠道中释放率一直维持在10%以下。PKP3-Fe进入肠道后在胰蛋白酶等的作用下多肽进一步酶解,多肽螯合亚铁的配位键被破坏,亚铁离子的释放率升高,达30.37%,随着时间的推移,释放的亚铁离子一方面与OH-还会形成Fe(OH)3沉淀,另一方面Fe2+重新与酶解后的小肽形成配位键[24],导致释放率降低。300min时PKP3-Fe释放率降到22.94%。
多肽亚铁螯合物可以通过分子的形式直接被小肠细胞吸收[23],也可以游离Fe2+与二价金属离子转运蛋白-1(DMT-1)结合被小肠上皮细胞吸收[25-26]。模拟肠道消化结果表明,乳酸亚铁片和硫酸亚铁片大部分在胃部释放后进入肠道形成Fe(OH)3沉淀,人体对它的吸收利用很少,而桃仁多肽螯合亚铁则有相当一部分以离子态或与多肽以螯合物的状态进入肠道中,因此桃仁多肽螯合亚铁比乳酸亚铁和硫酸亚铁能更好地被人体吸收利用。

图8 不同铁补充剂在模拟胃部消化过程中亚铁离子释放率Fig.8 The ferrous release rate of ferrous sulfate table,ferrous lactate table and PKP3-Fe in simulated gastric digestion
3 结论
桃仁多肽与亚铁离子的螯合率显著高于(P<0.05)大豆多肽、玉米多肽和鱼胶原蛋白肽。在与桃仁多肽的螯合中,氯化亚铁相比硫酸亚铁具有更高的螯合率,在乙醇中具有更好的溶解分离性能。通过超滤分离得到的小分子质量桃仁多肽组分与氯化亚铁螯合时具有更高的螯合率。
由紫外光谱和荧光光谱图可知桃仁多肽与亚铁离子螯合后紫外吸收峰位置、峰值均发生变化,内源荧光强度明显减弱,表明有新物质形成。傅里叶红外光谱分析可知,亚铁离子与桃仁多肽中的-COO-、N-H、C-N、O-H形成配位键。PKP3组分及PKP3-Fe的扫描电镜SEM图显示,PKP3-Fe有光滑球状颗粒生成,桃仁多肽螯合前、后微观结构发生明显改变。

图9 不同铁补充剂在模拟肠道消化过程中亚铁离子释放率Fig.9 The ferrous release rate of ferrous sulfate table,ferrous lactate table and PKP3-Fe in simulated intestinal digestion
在模拟胃部消化过程中,PKP3-Fe铁离子释放率显著低于硫酸亚铁片和乳酸亚铁片(P<0.05),避免了在肠道中大量氢氧化铁沉淀的生成。进入模拟肠液后,硫酸亚铁和乳酸亚铁的释放率显著低于PKP3-Fe(P<0.05)。PKP3-Fe有部分成分在肠道中以离子态或者与多肽螯合物的状态存在,能更好地被人体吸收利用。
