单液滴干燥过程中载体组分对植物乳杆菌的保护作用
2020-03-06蒋苏颖伍文彬朱雪梅
蒋苏颖 伍文彬 朱雪梅 熊 华
(南昌大学 食品科学与技术国家重点实验室 南昌330047)
根据美国食品与农业组织(FHO)及世界卫生组织(WHO)的定义,益生菌是一类当达到足够数量时对宿主产生益处的活性微生物[1],具有调节胃肠,提高机体免疫力,促进钙的吸收等功能[2-3]。在食品和病理学应用中广泛使用的乳杆菌属还可以通过预防或减少病原体的发病率来增强食品安全和消费者的健康[4]。根据Shah等[5]的建议,食品中益生菌含量至少要达到106CFU/g才能发挥其活性,达到有益效果。然而,即使这类食品在被食用前满足这一要求,进入机体后,在低pH的肠、胃以及高胆盐条件下益生菌的存活率仍然是一个问题[6-8]。近年来,采用微胶囊技术来提高益生菌在加工储存及机体摄入过程中的存活率成为科研工作者的一个研究热点[9]。
微胶囊技术是通过添加糖类、蛋白类或其它物质形成物理屏障,使益生菌得到保护,以避免物理损伤而失活的一种最新的高效保持益生菌活力的方法,在食品、医药等领域得到非常广泛的应用[10]。之前,有大量文献报道制作益生菌微胶囊的方法,包括冷冻干燥、喷雾干燥、真空干燥和流化床干燥,这些方法都在一定程度上提高了菌种的存活率[11]。益生菌微胶囊生产的传统方法主要是通过冷冻干燥,该方法需要相对较长的时间且耗能高[4]。利用喷雾干燥将样品加工成粉末的方法已经成为生产活性菌粉的热点[12]。相关报道发现,与冷冻干燥相比,细菌和酵母经喷雾干燥后生存率可高达80%~100%,并且喷雾干燥的成本相对较低[13-14]。由于喷雾干燥塔的设计问题,所以研究塔内液滴的干燥历程有较大难度,单液滴干燥(single droplet drying,SDD)是目前唯一一种可对液滴至颗粒转化过程进行实时监控与定量测量的研究工具[15],可实现对液滴形貌变化全过程监控及对液滴干燥动力学的准确测量,使干燥过程中所发生的状态变化变为透明化[16]。本试验中利用SDD技术,采用不同DE值糖浆,不同熔点棕榈油包埋植物乳杆菌(Lactobacillus plantarum),对其进行微胶囊化前处理,对其单一液滴的干燥历程进行研究,以期对该材料在喷雾干燥壁材配方优化中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌(Lactobacillus plantarum),中国工业微生物菌种保藏管理中心;糖浆(DE25,DE18),江西恒顶食品有限公司;棕榈油,杭州旺源科技有限公司;MRS肉汤培养基,广东环凯微生物科技有限公司;其它化学试剂均为国产分析纯级。
1.2 仪器与设备
微量进样器5μL,宁波市镇海三爱有限公司;高压灭菌锅,上海博迅实业有限公司;无菌工作台,苏净集团安泰公司;单液滴干燥设备,南通东概念材料有限公司;空压机,江苏岱洛医疗科技有限公司。
1.3 方法
1.3.1 菌种的活化及培养 将保存在甘油中的菌种接入已灭菌的MRS液体培养基中,于37℃厌氧培养24 h,以体积分数2.5%转接于新鲜的MRS液体培养基(已灭菌)中37℃厌氧培养24 h,获得处于稳定期的植物乳杆菌。将菌液以4 000 r/min,4℃离心20min,弃上清液,收集菌体,用0.85%的无菌生理盐水洗涤,再次离心,弃上清液,收集菌泥。
1.3.2 植物乳杆菌菌悬液的制备 将一定量的水和磷酸氢二钾水浴加热,当温度30~40℃时加入酪蛋白酸钠,加热并不停搅拌至酪蛋白酸钠全部溶解,分别加入DE25和DE18糖浆,搅拌使之完全溶解。另将不同熔点的棕榈油和一定量的乳化剂(单甘脂、硬脂酸钠)加热搅拌使之熔化。
将制得的油相物料边搅拌边缓慢注入水相物料中,继续搅拌30~45min,得到4种O/W乳液,分别为DE25糖浆/高熔点棕榈油(HMP),DE25糖浆/低熔点棕榈油(LMP),DE18糖浆/高熔点棕榈油(HMP),DE18糖浆/低熔点棕榈油(LMP)(以下简称DE25/HMP、DE18/HMP、DE25/LMP、DE18/LMP),然后将1.3.1节获得的菌泥加入制得的乳液中,通过高速剪切分散机10 000 r/min分散2 min,再经20MPa高压均质机处理制得菌悬液,待用。
1.3.3 单液滴干燥试验 单滴干燥仪由空气供应系统和液滴干燥系统两个系统组成。空气供应系统用于压缩空气,调节成具有可控温度、速度和湿度的气流,液滴可以悬挂在特制玻璃丝的尖端,在调节气流的过程中进行干燥。液滴干燥系统包含3个液滴悬挂模块,每个模块包含专门设计用于干燥过程中测量液滴参数的悬浮玻璃丝,在相同的干燥条件下使用不同悬挂模块测量液滴相应的参数[17-19]。单液滴干燥仪试验装置示意图见图1。

图1 单滴干燥仪试验装置示意图Fig.1 Schematic diagram of drying experimental set-up of the single droplet
在单滴干燥试验中先使用微量注射器在干燥室外生成体积为3μL的液滴并挂于玻璃丝小球末端上,挂定后开始记录干燥视频。单液滴干燥试验的具体参数设定见表1。干燥不同的时间(0,30,60,90,120,150,180,210,240 s)后,分别用盛有1 mL的0.85%无菌生理盐水溶解不同干燥时间的半干颗粒,然后采用十位稀释法,稀释到一定稀释度。取20μL涂布培养平板中,37℃厌氧培养48 h,记录菌落生成数。使用热电偶测量液滴干燥期间温度的变化,并用测温软件得到的数据绘制曲线图。在干燥过程中,利用长玻璃丝的位移获得液滴质量数据。首先,在相同干燥条件下悬浮不同质量的橡皮泥颗粒,记录玻璃丝的相应位移,绘制校准曲线,然后在特定干燥条件下测量样品液滴。液滴质量使用图像处理软件Image J分析图片栈得到,试验结果为3次试验平均值。液滴失水量用Xn表示,计算公式如下:

表1 单液滴干燥条件Table1 The drying conditions of single droplet

式中:X0——液滴最初质量(mg);Xm——干燥一定时间的液滴质量(mg)。
1.3.4 扫描电子显微镜(SEM)观察 将干燥5 min的单个液滴颗粒从悬浮的玻璃丝上取下,每个样品至少取3个干燥颗粒,将其破碎并固定,立即喷金,在加速电压5 kV下用扫描电子显微镜观察样品的微观结构。
1.3.5 乳状液的热稳定性分析 取1.3.2节制得的4种O/W乳状液,在同一干燥条件下干燥后收集10mg,置于差示热量扫描仪(Differential scanning calorimeter,DSC)专用铝盒中,样品盘升温速率为5℃/min,升温范围为0~100℃。
1.3.6 数据分析 试验数据均为3个独立平行样的平均值,采用Origin9.1作图,SPSS16.0软件处理数据,分析其显著性差异。
2 结果与分析
2.1 不同DE值糖浆/不同熔点棕榈油对植物乳杆菌菌活的影响
图2、图3分别为90℃和110℃干燥条件下植物乳杆菌的失活过程。图2a为90℃干燥条件下植物乳杆菌的活菌细胞浓度变化。可以观察到,在单液滴干燥的前150 s,4个样品活菌浓度基本无显著变化,液滴干燥至180 s时,DE25、DE18/LMP的两个样品中活菌浓度开始急剧下降,下降量分别约为1.60 lg(CFU/mL)、1.63 lg(CFU/mL);而含HMP的样品中植物乳杆菌活菌浓度在210 s才开始明显下降。当液滴干燥150 s后,HMP的两个样品液滴活菌浓度始终高于含LMP的两个样品,尤其是DE25/HMP包覆的植物乳杆菌其活菌浓度在干燥后期始终高于其它3个样品,并且整个干燥过程中只下降约2 lg(CFU/mL)。在110℃干燥条件下4个样品的活菌浓度(图3a)有同样的变化趋势。由图3a可以看出,与90℃干燥条件相比,活菌浓度开始大幅度下降的时间提前且不同样品间下降趋势有所不同。这可能是因为在较高温度条件下液滴温度和湿度的快速变化对细菌细胞造成多重压力,包括热损伤、渗透压力以及氧化应激能力,从而对多个细胞结构部位造成损害,使得菌细胞灭活过程变得更为复杂[4,20]。在干燥后期同样可以观察到含HMP的液滴植物乳杆菌菌活浓度高于LMP液滴(图3a)。根据相关文献[21]~[23]报道称,细胞膜外侧的糖类物质对细胞膜起到较好的保护作用,并且糖类保护剂可以降低相变温度,使细胞液晶相不易向凝胶相转变。结合本试验中图2a及图3a可以发现,在单一液滴的干燥过程中不同熔点的棕榈油比不同DE值糖浆对植物乳杆菌的存活率影响更大。
植物乳酸菌在干燥过程中的失活与液滴的温度及失水有关。干燥过程中液滴的质量变化如图2b及图3b所示。4个样品的质量变化即失水速率变化趋势基本相同。图3b与图2b相比,温度更高的情况下,液滴质量下降速率明显更快;然而,在不同干燥条件下,壁材为DE25糖浆的样品在干燥后期液滴质量的变化速率均比DE18糖浆的小,可能是由于DE25/DE18糖浆都是低转化糖浆,并且糖浆DE值越高黏度越大,阻止了水分的蒸发。在干燥过程中4个样品的液滴温度存在一定的差异,如图2c所示,90℃干燥条件下,HMP液滴在干燥前50 s温度均高于LMP液滴,从50 s直到干燥结束,含HMP的液滴温度均低于LMP液滴;在110℃干燥条件下可以观察到整个干燥过程中HMP液滴温度都比LMP液滴温度低(图3c)。Chen X D等[24]发现益生菌在喷雾干燥时温度高于65℃就开始大量死亡,可能是由于65℃是菌体中核糖体开始解体的温度。液滴达到65℃的时间越长,菌体的存活率越高。由图2c和图3c可以发现HMP的液滴到达65℃时所消耗的时间均比含LMP的液滴短。结合图2a和图3a的菌活变化情况,HMP液滴中菌体存活率高,推断出干燥过程中液滴的温度是影响菌活的主要原因。

图2 90℃干燥条件下植物乳杆菌的菌活量及干燥参数变化Fig.2 Inactivation histories of L.plantarum and corresponding Drying kinetics during single droplet drying at 90℃

图3 110℃干燥条件下植物乳干菌的菌活量及干燥参数变化Fig.3 Inactivation histories of L.plantarum and corresponding drying kinetics during single droplet drying at 110℃
2.2 植物乳杆菌失活与液滴干燥参数的相关性
图4显示90,110℃干燥过程中液滴失水量与植物乳杆菌存活率的关系。在喷雾干燥过程中益生菌脱水也是导致其失活的一个重要因素[25]。用N/N0(N为干燥一定时间后的菌活浓度,N0为初始菌活浓度)表示植物乳杆菌存活率是为了避免初始菌活浓度不一致导致的误差(图4,图5)。图4显示:随着Xn的逐渐增大,液滴的水分含量逐渐减小。由图4a和图4b可以看出,不同温度干燥条件下各样品间Xn与N/N0的趋势存在差异。90℃干燥后期HMP液滴中植物乳杆菌存活率明显高于LMP液滴(图4a),说明在低水分含量液滴中棕榈油对植物乳杆菌存活量起关键作用。由图4b观察到在干燥后期当液滴Xn相同时,以DE25糖浆为壁材的液滴中植物乳杆菌存活率大于DE18液滴。在最终阶段,HMP液滴菌活仍高于LMP样品。糖浆与棕榈油对液滴水分含量的作用受到外界干燥条件的影响,对植物乳杆菌菌活的影响效果不一。
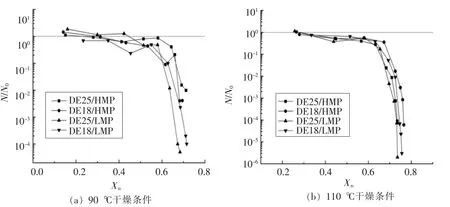
图4 干燥过程中液滴失水量与植物乳干菌存活率的关系Fig.4 The relationship between the decrease in droplet moisture content and the survival rate of L.plantarum during single droplet drying

图5 干燥过程中液滴温度与植物乳干菌存活率的关系Fig.5 The relationship between the droplet temperature and the survival rate of L.plantarum during single droplet drying.
干燥过程中液滴温度与植物乳杆菌存活率关系如图5所示。由图5a观察到,含LMP的样品在液滴温度达到70℃后植物乳杆菌菌活开始大幅度下降。这与Chen X D等[24]研究发现喷雾干燥过程中益生菌在65℃开始大量死亡的结果相一致。而HMP液滴中植物乳杆菌菌活在液滴温度80℃左右才出现显著下降。在110℃干燥条件下(图5b),由于外界温度的升高,液滴的干燥历程更加复杂化[20]。与90℃干燥条件相比,110℃条件下影响植物乳杆菌菌活的因素多。虽然图5b中观察到液滴温度对植物乳杆菌菌活的影响差异变小,但在所有样品的液滴温度达到100℃后,仍能观察到当植物乳杆菌的活菌浓度相同时,HMP的液滴温度始终低于LMP液滴。
2.3 扫描电子显微镜观察
图6显示植物乳干菌菌悬液单液滴干燥5 min后的2 000倍扫描电镜下表面形态结构。可以看出,样品表面虽未有游离的植物乳杆菌,但均出现微孔。出现这种现象主要是液滴在干燥过程中快速失水所致。其中图6b和图6d的干燥颗粒表面有突起,可能是由于DE值越低的糖浆在温度升高时黏性越容易降低,从而导致分子间内聚力变小,液滴在接触到热气流时油脂较容易转移到液滴表面[26]。由此推断,糖浆的DE值越高越利于表面结构的稳定。同样可以解释图2b及图3b中以DE18糖浆为壁材的样品在干燥后期质量下降速率比DE25快,这是由于液滴表面结构越不稳定,水分蒸发速率越快。

图6 干燥5m in后单液滴颗粒扫描电镜图Fig.6 SEM pictures of the droplets of L.plantarum suspension after 5min dried
2.4 乳状液热稳定性质分析
表2列出4种乳状液的融化焓(△H)及在两种干燥条件下与其对应的植物乳杆菌的存活率关系。△H是乳液中结晶态棕榈油在融化时需要的能量。当乳状液用高熔点油脂作芯材时,温度升高,会在其融点附近出现显著的吸热峰[27-28]。由表2可以看出HMP的△H明显高于LMP(P<0.05)。干燥过程中当液滴温度达到结晶态棕榈油融化温度时能够吸收部分热,并且棕榈油的熔点越高吸收的热越多。植物乳杆菌经棕榈油和糖浆包埋后,在干燥过程中不同熔点的棕榈油会吸收部分热,降低其周围温度,使得植物乳杆菌热损伤降低,菌活提高。由表2可知,在90℃及110℃的干燥条件下植物乳杆菌的存活率随着棕榈油熔点的增大而增高,并与其相对应的△H之间呈正相关。Liu H等[29]研究结果与本试验结果一致,并且提出油脂在干燥过程中发生相变。在喷雾干燥试验中,干燥速率过快,因脱水导致的细菌细胞失活可忽略不计,故热损伤是细菌细胞的主要失活机制[30-31]。

表2 不同DE值糖浆与不同熔点棕榈油的乳状液融化焓及植物乳干菌存活率Table2 Melting enthalpy(△H)of emulsions of syrup with different DE and palm oil with different melting points and the survival rate of L.plantarum
3 结论
本试验主要采用单液滴干燥技术模拟喷雾干燥条件,利用不同DE值糖浆和不同熔点棕榈油包埋植物乳酸菌,研究在90℃及110℃的干燥条件下植物乳干菌的存活率情况。其中,含HMP的液滴菌活在两种温度干燥条件后期均明显高于含LMP的样品。相对于不同熔点棕榈油而言,不同DE值糖浆对植物乳干菌的菌活无显著影响。通过SEM观察到干燥颗粒表面均无游离植物乳干菌,结合液滴的质量变化推断糖浆DE值越高越利于液滴干燥后表面结构的稳定。根据对液滴的干燥参数及乳状液的热稳定性质的分析,推断出液滴的温度是影响植物乳干菌菌活的主要因素。与LMP相比,干燥过程HMP可以吸收更多的热使植物乳干菌受到的热损伤低。
