传统清香型白酒发酵过程中细菌群落结构及其动态演替
2020-03-06贾丽艳田宇敏王晓勇耿添霈
贾丽艳 荆 旭 田宇敏 王晓勇 刘 帅 耿添霈 韩 英
(1 山西农业大学食品科学与工程学院 山西太谷030801
2 山西省白酒生物工程研究生教育创新中心 山西太谷030801
3 山西杏花村汾酒厂股份有限公司 山西汾阳032209)
传统清香型白酒主产于山西省杏花村。杏花村位于山西腹地偏西,属于温带季风气候区,冬寒夏暑,四季分明。该环境因素为传统清香型白酒酒醅微生物菌群的生存提供了良好环境。结合优质的高粱、大麦豌豆,凭借6 000年的开放式传统酿造技艺,共同造就了清香型白酒独特的风味和不可复制的产品特点。传统清香型白酒的生产过程主要分为2个阶段:第1阶段是以粉碎蒸馏好的高粱为原料,添加生产用大曲,地缸发酵,甑桶蒸馏获得白酒。该发酵阶段的酒醅称为“大楂”[1]。第2阶段是以大楂发酵蒸馏酒后的酒糟为原料,添加大曲,地缸发酵,甑桶蒸馏获得白酒。该发酵阶段的酒醅称为“二楂”[1]。研究发现大楂和二楂发酵酒的理化指标具有较大的差异,如二楂酸度、酯含量高等,这与其酒醅发酵过程中的微生物有一定的关系。目前,关于传统清香型白酒发酵微生物菌群的研究已有研究报道,多数研究采用微生物纯种培养技术,研究发酵机理并分离获得功能性微生物,包括扣囊腹膜孢酵母、红曲霉、芽孢杆菌、乳酸菌、白地霉等菌株[2-5]。由于微生物对营养及生长条件需求的不同,使得利用传统微生物培养方法不能短时、高效、全面地了解环境中微生物的整体生长代谢情况,所以微生物非培养技术被应用到清香型白酒细菌类群的研究中。雷震河等[6]采用高通量测序技术分析清香型白酒微生物菌群结构。徐瑾等[7]利用聚合酶链式反应-变性梯度凝胶电泳技术(PCR-DGGE)研究了清香型白酒发酵过程中细菌群落结构演替规律。这些研究未对传统清香型白酒大楂和二楂发酵过程中细菌菌群的变化做系统的研究。鉴于传统清香型白酒发酵的复杂性和大楂、二楂酒体风格的差异性,本研究采用Illumina MiSeq高通量测序技术研究传统清香型白酒两个发酵时期的微生物群落及其动态演替规律,确定大楂和二楂发酵期的细菌优势菌群,为传统清香型白酒发酵调控,产品风格的稳定性及安全性提供理论参考。
1 材料与方法
1.1 样品的采集
2015年5月至6月,于杏花村某酒企试验分厂采集样品。采集时间为大楂发酵0,3,7,10,15,17,21,23,28对时,二楂发酵0,3,7,10,15,21,23,28对时(生产上发酵时间用“对时”表示,发酵1对时表示发酵1 d),样品编号分别以发酵时间标记,共17个样本。
1.2 主要试剂
DNA Marker,大连宝生物;Taq DNA聚合酶、dNTPs、溶菌酶,Sigma;蛋白酶K,Merck;去离子甲酰胺,Solarbio;N,N′-亚甲基双丙烯酰胺等。
1.3 酒醅中总DNA提取及高通量测序
采用闫亮珍等[8]描述的DNA提取法提取酒醅中细菌总DNA。采用核酸蛋白仪检测DNA的浓度和纯度。基于上海生物工程公司Illumina MiSeq平台完成测序。V3-V4区序列扩增引物是“GGACTACNVGGGTWTCTAATCC”和“CCTACG GRRBGCASCAGKVRVGAAT”;V4-V5区序列扩增引物是“CTTGTGCGGKCCCCCGYCAATTC”和“GTGYCAGCMGCCGCGGTAA”。利用Mothur和QIIME(v1.8.0)对测序结果分析处理,去掉长度≤50bp的序列、含嵌合体的序列和质量不好的序列,将相似度大于97%的序列聚类为一个操作分类单元(OTU,Operational Taxonomic Unit)。采用Ribosomal Database Program贝叶斯算法[9]对OTU代表性序列进行细菌种群分类学分析。基于OTU分析结果,采用样本序列随机抽样的方法分别计算Chao1、Shannon等α多样性指数,绘制稀释曲线,评估样品微生物多样性。样本间微生物群落差异通过weighted unifrac分析比较,通过PCoA(Principal Co-ordinates Analysis)可视化三维、二维图展示。
2 结果与分析
2.1 样品测序结果
对大楂和二楂17个样品中细菌的16S rRNA基因测序,测得原始序列条数分别为319 872,269 087条,过滤掉长度小于50 bp的序列、含嵌合体的序列和质量不好的序列,获得有效序列数304 961,240 488条。在97%相似度下将有效序列聚类,共获得39 567,22 717个OTUs。
样品稀释曲线可反映测序深度。从图1a可知,大楂8个样品的稀释曲线较平缓,表明所得序列基本反映酒醅中细菌群落结构。样品15的稀释曲线呈上升趋势,表明测序未达到饱和,继续挖掘还可能产生新的OTU。从图1b可知,二楂8个样品稀释曲线较平缓,说明所得序列基本反映酒醅中细菌群落结构。

图1 不同发酵阶段样品稀释曲线Fig.1 Rarefaction curve of samples in different fermentation time
2.2 酒醅样品间Alpha多样性分析
Alpha多样性可通过丰富度指数、Chao1指数、ACE指数、香农指数、覆盖率、辛普森指数等反映。由表1可知,大楂各样品的覆盖率在0.87~0.97之间变化,表明各样品文库的覆盖率较高,基本能反映样品细菌群落组成。细菌丰富度指数和chao1指数呈现低-高-低-高-低的变化趋势,表明各样品细菌多样性有一定差异,菌群在发酵过程中动态变化;香农指数在3.87~5.06之间波动,表明不同发酵阶段微生物的多样性在变化;其它指标也表现出相同的变化规律。以上指数表明大楂发酵过程中细菌菌群多样性呈动态,0~7对时细菌菌群多样性降低;7~10对时细菌多样性升高;10~17对时细菌多样性略有降低;17~21对时细菌多样性升高;21~28对时细菌多样性降低。

表1 大楂样品间Alpha多样性统计Table1 Alpha diversity in different samples of Dacha
由表2可知,二楂样品覆盖率在0.94~0.99间变化,表明各样品文库的覆盖率高,能反应样品细菌群落组成。细菌chao1指数呈现高-低-高-低的变化趋势,表明各样品细菌多样性在发酵过程中动态变化。香农指数在2.84~5.29之间较大波动变化,表明二楂不同发酵阶段微生物的多样性变化较大。其它指标也表现出相同的变化规律。
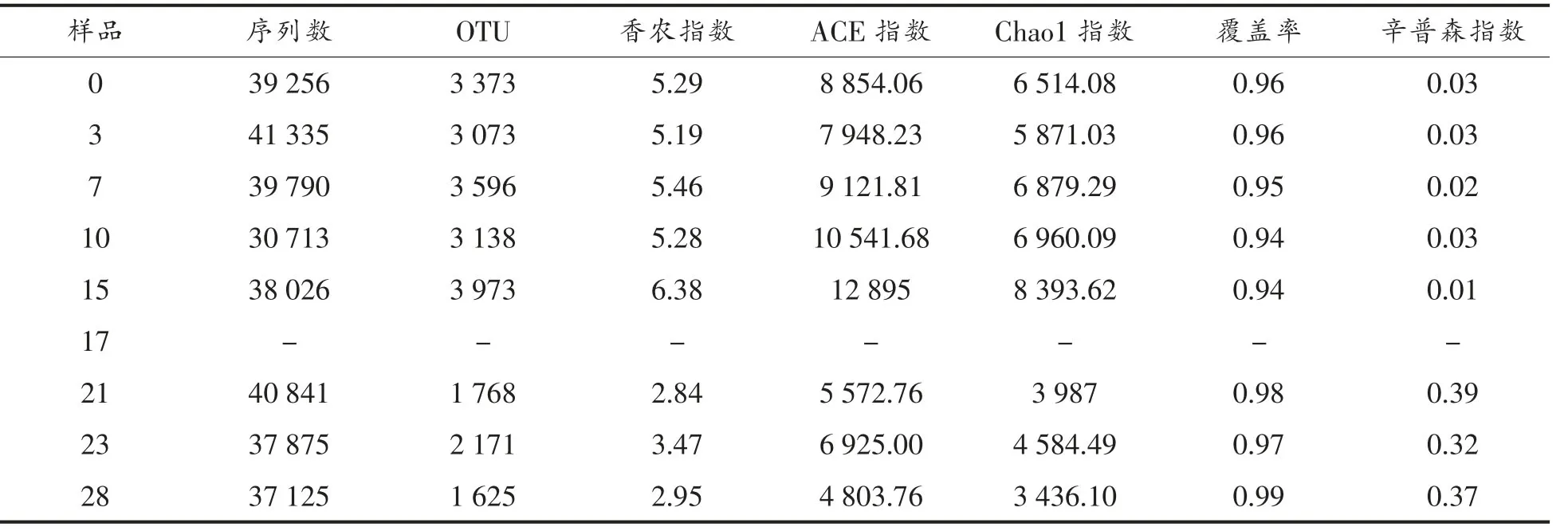
表2 二楂样品间Alpha多样性统计Table2 Alpha diversity in different samples of Ercha
2.3 酒醅样品间的生物多样性分析
酒醅样品间生物多样性分析采用多变量统计学方法PCoA分析实现,并通过三维和二维图显示不同样品中微生物种群的相似性及差异性。图2a,2b是大楂发酵过程中样品间PCoA三维散点图,图中各个点代表不同的样本,样本间相似度越高在空间上越聚集,反之,相似度越低空间距离越远。由图2a可知主成分1(P1)和主成分2(P2)在样品差异性贡献率上分别达到63.4%和14.6%,合计78.0%,是差异的主要来源。图2b是P1和P2主成分分析PCoA二维散点图,图中不同的点代表不同的样本,样本间相似度越高在图中越聚集,反之,相似度越低空间距离越远。以上结果表明大楂酒醅发酵过程中微生物菌群分布显著变化。
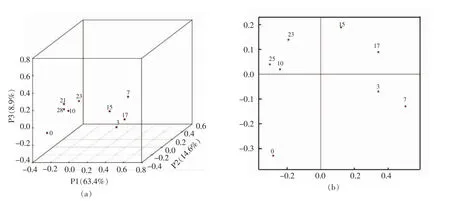
图2 大楂各样品细菌PCoA分析三维(a)和二维(b)散点图Fig.2 PCoA results of microbial communities from the samples of Dacha
图3a是二楂发酵过程中各样品间PCoA三维散点图。P1和P2在样品差异性贡献率上分别达到69.7%和21.2%,合计90.9%,是差异的主要来源。图3b是P1和P2主成分分析PCoA二维散点图。二楂酒醅发酵过程中微生物菌群分布显著变化。
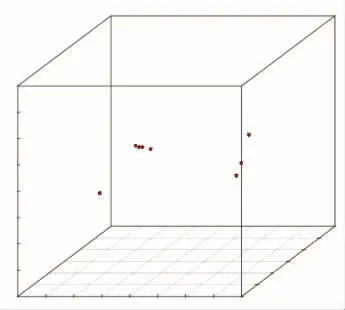
图3 二楂各样品细菌PCoA分析三维(a)和二维散点图(b)Fig.3 PCoA results of microbial communities from the samples of Ercha
通过对大、二楂发酵过程中样品PCoA分析,发现大楂和二楂发酵过程中Beta多样性差异显著,表明微生物菌群中在发酵的各阶段变化规律不同,分析原因,推测是大楂、二楂发酵基质及环境的不同造成的,这必将影响大楂和二楂白酒的质量。
2.4 酒醅样品门水平的细菌群落结构分析
利用RDP classifier对各酒醅样品中的OTU进行门、纲、目、科、属的分类信息分析,结果表明大楂和二楂细菌菌群分布于15个门,分别是厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacterioidetes)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、酸杆菌门(Acidobacteria)、衣原体门(Chlamydiae)、硝化螺旋菌门(Nitrospirae)、蓝细菌门(Cyanobacteria)、广古菌门(Euryarchaeota)、芽单胞菌门(Gemmatimonadetes)、产金菌门(Deinococcus-Thermus)、梭杆菌门(Fusobacteria)。
大楂发酵阶段,厚壁菌门是优势菌群,占到各发酵时期细菌种群的23.26%~97.48%。在0对时,厚壁菌门仅占该时期细菌种群的23.26%;0~7对时所占比例越来越高,达95.35%;7~10对时所占比例下降;10~17对时所占比例又升高;17~21对时所占比例又降低,21~23对时所占比例又略升高,23~28对时又降低。变形菌门为发酵起始的优势群体,占该时期细菌种群的68.39%,发酵过程中变形菌门比例迅速降低,7~10对时升高,10~17对时又降低,17~21对时又升高,21~28对时降低又升高(图4)。以上结果表明在大楂的整个发酵过程中细菌种群此消彼长,动态变化。
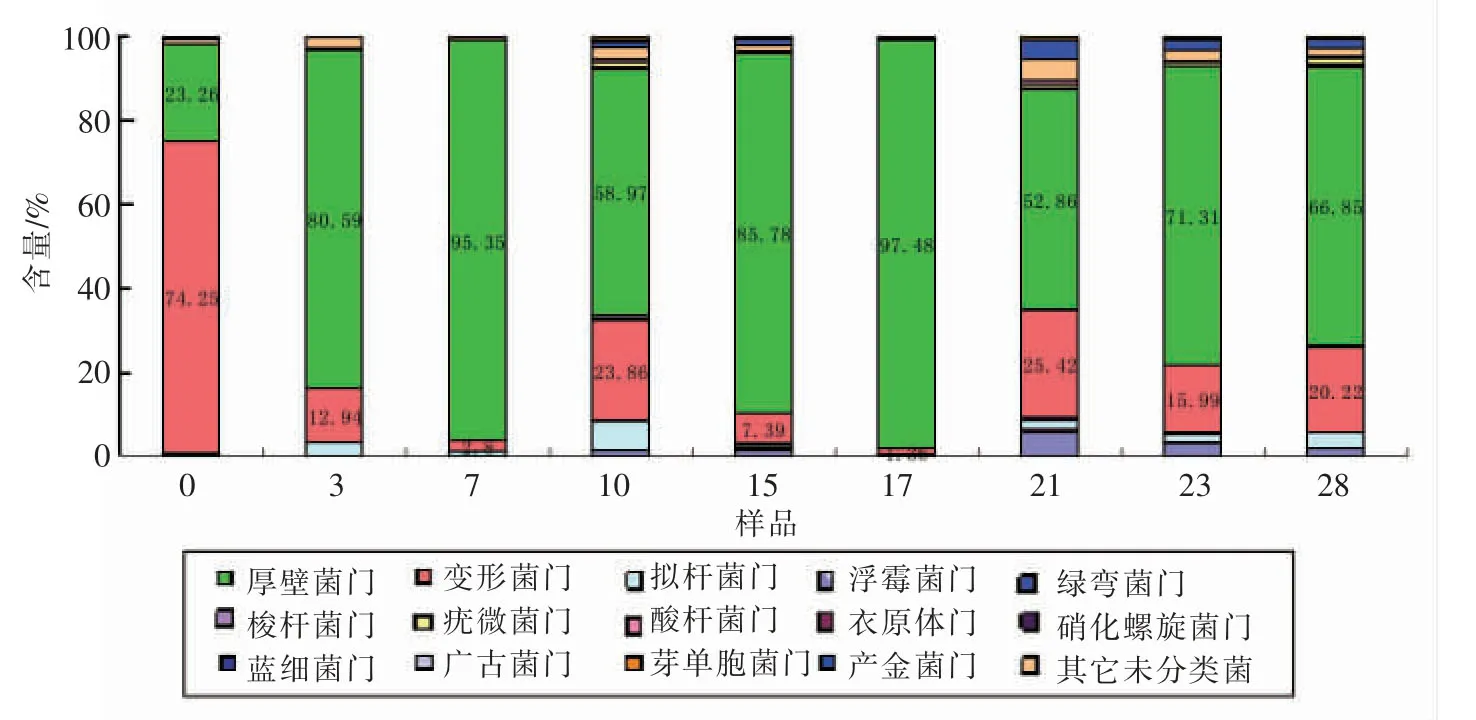
图4 大楂样品细菌在门分类水平上的分布Fig.4 Frequence of phylum in microbial communities from samples of Dacha
二楂发酵阶段,厚壁菌门是优势种群,占到各发酵时期细菌种群的3.48%~98.12%(图5)。0对时样品菌群多样性高,厚壁菌门所占比例较低,仅3.48%;0~3对时,所占比例迅速升高;3对时以后,一直维持较高水平。变形菌门为发酵起始的优势群体,达51.35%,0~3对时降到3.67%,之后一直维持在较低的水平。
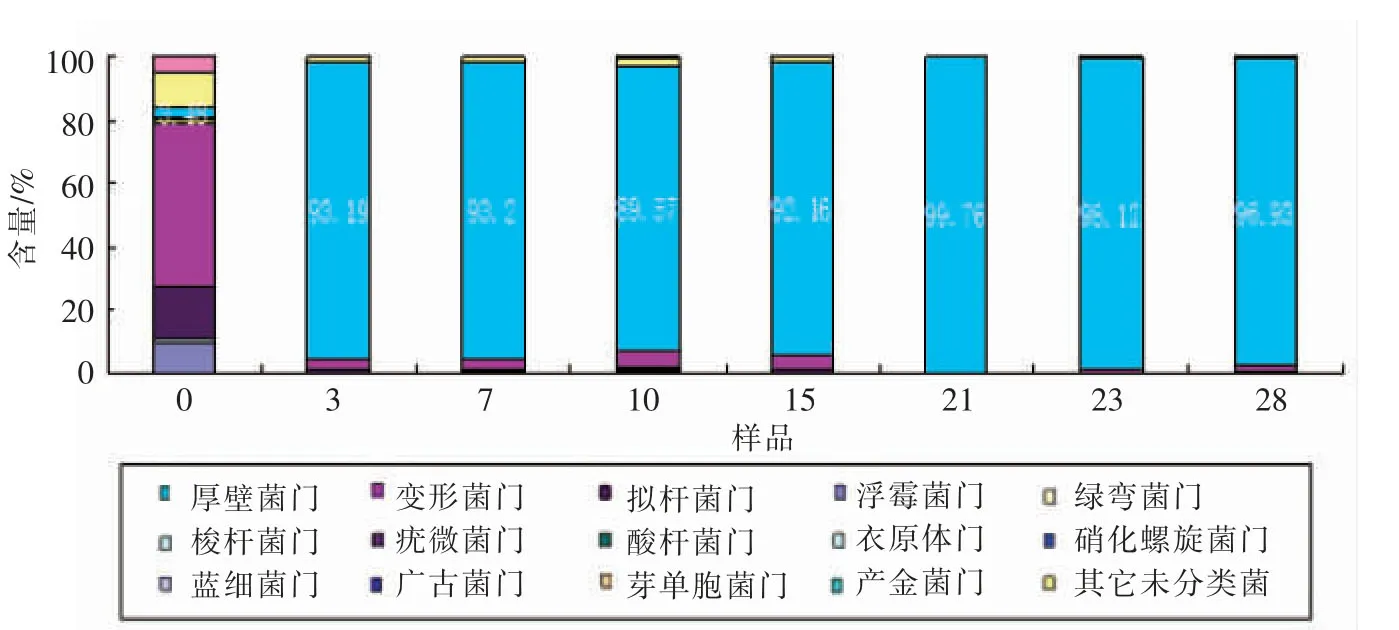
图5 二楂样品细菌在门分类水平上的分布Fig.5 Frequence of phylum in microbial communities from samples Ercha
大楂与二楂发酵过程中细菌多样性变化具有一定的相似性和相异性。相似性是厚壁菌门、变形菌门,它们是发酵过程中主要的细菌类群,在发酵过程中丰度呈动态变化。相异性是大楂发酵过程中菌群结构变动较大。
2.5 酒醅样品间属水平的细菌群落分布
大楂细菌群落测序结果显示,酒醅中细菌组成比例较高的属分别是乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、泛菌属(Pantoea)、明串珠菌属(Leuconostoc)、Anderseniella、浮霉状菌属(Planctomyces)、乳球菌属(Lactococcus)、魏斯氏菌属(Weissella)和其它未分类菌。
大楂细菌群落TOP15热图分析见图6,可知:1)大楂发酵过程中样品间细菌属多样性及组成的相对丰度具有一定差异性。2)将各样品间细菌属水平聚类,可将大楂各样品聚成4类:样品3和7,样品15、17、23和28,样品10和21分别聚在一起,样品0独立分支,这表明发酵过程中各细菌属动态变化,此消彼长,顺序生长。图7是大楂样品在细菌属水平上的分布。乳杆菌属是大楂发酵各阶段的主要微生物,在发酵起始,其含量仅为5.39%;在发酵过程中迅速升高,在40.77%~83.26%之间变化。片球菌属在大楂酒醅中动态变化,在发酵初期仅占0.4%,在0~7对时迅速增长到29.76%,7~10对时降到2.71%,10~15对时升到8.44,15对时逐渐降到1.15%。芽孢杆菌属在发酵0对时含量较高,而在酒醅发酵过程中迅速降低。明串珠菌属在发酵初始含量较高,达11.99%,在发酵过程中逐渐降低后升高;在15对时以后又降低,表明其在发酵的前、中期发挥功能。总之,大楂发酵过程中细菌属水平具有多样性。优势种群的种类和数量的动态变化,影响白酒的品质。

图6 大楂发酵过程中不同样品间的细菌热图Fig.6 Heatmap of the bacteria in different samples of Dacha
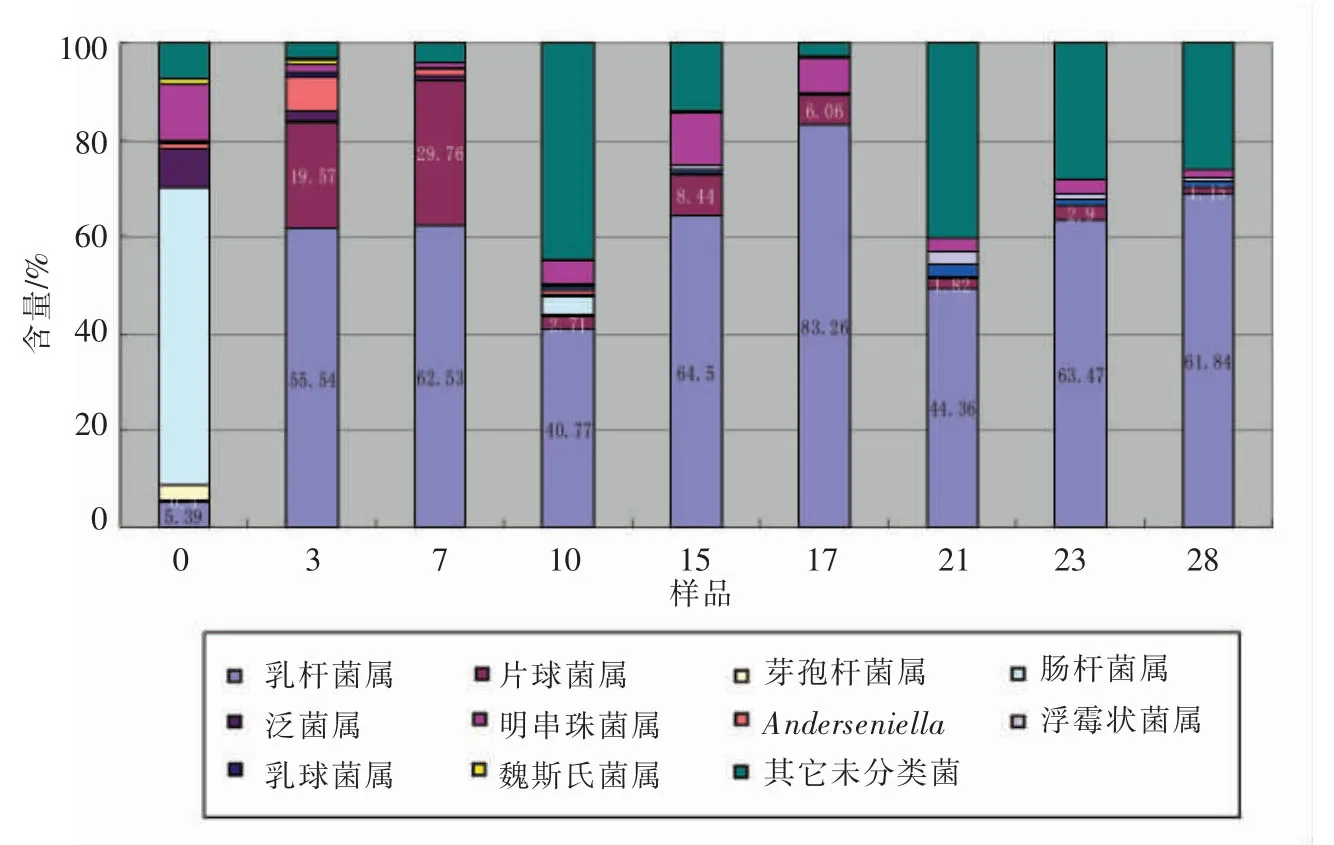
图7 大楂样品细菌在属水平上的分布Fig.7 Frequence of genus in microbial communities from samples of Dacha
二楂细菌群落测序结果显示其细菌组成比例较高的属分别是乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、葡萄球菌属(Staphylococcus)、Anderseniella、浮霉状菌属(Planctomyces)、乳球菌属(Lactococcus)、明串珠菌属(Leuconostoc)、魏斯氏菌属(Weissella)和其它未分类菌。二楂细菌群落TOP15热图分析见图8,可知:1)二楂发酵时期样品间属水平细菌具有一定的丰度,各样品细菌组成有一定的差异性和相似性。2)依据样品间属水平的聚类关系,可将二楂发酵过程样品分成3类,即3,7,10,15对时样品,17,23,28对时样品分别聚在一起,0样品对时独立分支,说明在发酵过程中细菌菌群动态变化较大,且此消彼长,顺序生长,这影响二楂白酒的质量与风味。图9反映二楂发酵过程中属水平细菌群落组成情况。乳杆菌属是发酵各阶段的主要微生物,其含量在发酵初期较低,仅占2.4%,在发酵过程中含量迅速增高,并维持较高的水平,0~15对时占74.32%~78.63%,15对时以后,所占比例迅速升高到99.35%。葡萄球菌属在15对时以前占有一定的比例,15对时以后消失,表明其主要在发酵前期生长繁殖,发酵后期基本消失。总之,二楂起始发酵阶段细菌属菌群丰富,在发酵过程中主要生长的细菌为乳杆菌属,它在二楂的发酵过程中快速生长繁殖,影响白酒的风味和质量。

图8 二楂发酵过程中不同样品间的细菌热图Fig.8 Heatmap of the bacteria in different samples of Eacha

图9 二楂样品细菌在属分类水平上的分布Fig.9 Frequence of genus in microbial communities from samples of Eacha
3 讨论
利用纯培养技术获得的微生物种类不到自然界微生物种类总量的1%[10]。利用传统微生物分离技术,全面了解样品中微生物的种类及作用几乎不可能。高通量测序技术的诞生及技术升级,推动了宏基因组学的快速发展,使得生态环境中微生物的全貌快速地解析成为了可能[11-12]。近年来,高通量测序技术被广泛应用于传统酿造食品生产环境中微生物检测,在传统酿造食品功能性微生物发现、发酵机制研究及发酵条件的控制、有害微生物的防控、产品品质提升等方面具有重要意义[13-15]。
白酒悠久的生产历史,适宜的气候条件,开放式的固态发酵体系,使其发酵过环境中存在大量驯化了的功能性细菌参与酿造,为传统白酒品质的稳定性提供保障[16]。本研究完成了传统清香型白酒大楂、二楂发酵过程中酒醅细菌高通量测序,结果表明,大楂、二楂发酵过程中优势细菌主要为葡萄球菌属、片球菌属、乳杆菌属,这些细菌在种类及数量上随着发酵时间的推移而有所变化,这必将对清香型白酒的品质产生影响。芽孢杆菌属在一些白酒发酵过程中是优势菌群[17],而在清香型白酒酒醅发酵过程中其含量相对较低。另外,还发现片球菌属在大楂和二楂的发酵前期为优势菌群,发酵后期消失;葡萄球菌属在二楂发酵前期可检测到,15对时以后消失。那么,这些菌在酒醅中此消彼长,动态变化,与酒醅理化指标的变化及白酒风味物质的形成具有怎样的相关性,有待后期研究。
