食品中多组分甜味剂和防腐剂同时快速测定方法的建立
2020-03-06程水连何建国卢桂英晏许超付柏婷
程水连 何建国 卢桂英 晏许超 付柏婷
(益阳市产商品质量监督检验研究院,湖南 益阳 413000)
目前人工合成甜味剂和防腐剂在日常食品中的应用范围越来越广泛,使用的剂量也越来越大,而且超剂量、超范围滥用的现象层出不穷,为了改善口感和延长食品的保质期,提高食品口感的稳定性,甚至以多组分协同的形式添加。但是摄入过多的甜味剂和防腐剂会对人体产生不良影响,对身体造成负担、对人体的肝脏和神经系统造成严重危害,特别是对代谢排毒能力较弱的小孩、老人和孕妇危害更加明显,长期食用甚至会致癌、致畸、损害肾功能等副作用[1]。目前食品中常用到的防腐剂主要有纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠和双乙酸钠,人工合成甜味剂主要有甜蜜素、糖精钠、安赛蜜、三氯蔗糖、阿斯巴甜和纽甜。
食品中的甜味剂和防腐剂大多采用高效液相色谱法来测定,但由于这些添加剂各自的物理、化学及光谱性质存在差异,导致不能直接进行检测,如甜蜜素没有紫外吸收基团,需对其进行衍生化才能检测[1],三氯蔗糖要用示差检测器[2],而且甜味剂和防腐剂的检测方法一般都是单一组分测定,如GB 500.97—2016是针对食品中甜蜜素的测定,GB 22255—2014是针对食品中三氯蔗糖的测定,GB 5009.28—2016是针对食品中苯甲酸、山梨酸和糖精钠的测定,GB/T 5009.140—2003是针对食品中安赛蜜的测定,GB 5009.263—2016是针对食品中阿斯巴甜的测定,GB 5009.247—2016是针对食品中纽甜的测定,GB/T 23377—2009是针对食品中脱氢乙酸的测定,GB/T 21915—2008是针对食品中纳他霉素的测定,GB/T 23383—2009是针对食品中双乙酸钠的测定,这些无疑给多种甜味剂和防腐剂的同时检测增加了难度。现有的国家标准中,不利于对食品中多种甜味剂和防腐剂的大规模筛查,导致检测工作量非常大,浪费人力物力,因此有必要开发一种适用性广、可同时快速测定、灵敏度高的高通量检测方法,以便高效应对甜味剂和防腐剂在食品中的滥用现象。
食品中甜味剂和防腐剂现有的测定方法有离子色谱法[2]、液相色谱法[3]、气相色谱法[4]、分光光度法[5]等,其中以液相色谱法测定比较常见。近年来,随着三重四级杆液质联用仪的使用,液质法测定甜味剂和防腐剂的报道也逐渐增多。如:王丽娟等[6]采用高效液相色谱—串联质谱法同时测定葡萄酒中甜味剂、防腐剂和色素,该方法能够满足葡萄酒甜味剂、防腐剂和色素含量测定的分析要求;宗珊盈等[7]采用超高效液相色谱—串联质谱法同时测定食品中7种防腐剂和4种甜味剂,该方法为食品添加剂的测定提供了高效、准确的检测。SN/T 3538—2013中涉及了6种甜味剂的检测,但未涉及三氯蔗糖的检测,且样品处理繁琐,样品需经HLB固相萃取小柱净化。GB 2760—2014中对甜蜜素、糖精钠、安赛蜜、三氯蔗糖、阿斯巴甜、纽甜6种甜味剂和纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠和双乙酸钠5种防腐剂的使用和限量都作了规定,以上这些添加剂标准一般都采用高效液相色谱法,对多种添加剂成分进行分析时,对相邻的色谱峰仅靠保留时间来定性不准确,容易出现假阳性。
高效液相色谱—串联质谱法ESI负离子模式是利用电场产生带电液滴继而通过离子蒸发分析离子的电离过程,在ESI负离子模式下采用不同的碰撞电压对各目标化合物产生的一级质谱进行全扫描,得到的目标化合物的准分子离子作为母离子和最佳的裂解电压,然后使用碰撞气使其分子离子进行二级电离而得到各目标化合物的子离子,确定每种待测化合物的监测离子对,一般选离子丰度最高的两对,一对作为定量离子对,一对作为定性离子对,再采用多反应监测方式(MRM)监测相应的离子对[8]。且ESI负离子模式通过研究化合物碎裂信息,不仅能够解析化合物的碎裂途径以便确认其结构和性质,同时也可以优化其质谱分析条件,为化合物及其降解产物的分析检测提供了强有力的工具[9]。但用高效液相色谱—串联质谱法ESI负离子模式来同时测定食品中甜蜜素、糖精钠、安赛蜜、三氯蔗糖、阿斯巴甜、纽甜6种甜味剂和纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠、双乙酸钠5种防腐剂的方法未见报道。因此有必要建立一种快速测定、准确定性食品中甜味剂和防腐剂的方法。
研究拟利用高效液相色谱—串联质谱同时测定食品中甜蜜素、糖精钠、安赛蜜、三氯蔗糖、阿斯巴甜、纽甜6种甜味剂和纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠、双乙酸钠5种防腐剂的含量,以期为食品中添加剂的检测提供快速、准确、有效的方法。
1 材料与方法
1.1 仪器
三重四级杆液质联用仪:LCMS-8040型,配有电喷雾离子源(ESI),日本岛津公司;
电子分析天平:AEY-210型,湖南长沙湘仪检测设备有限公司;
电子天平:AUW120D型,日本岛津公司;
电热恒温水浴锅:DZKW-D-6型,北京市永光明医疗仪器有限公司;
高速分散匀质机:FJ-200型,上海标本模型厂;
均质器:AVS-100型,转速不低于20 000 r/min,天津奥特赛恩斯仪器有限公司;
离心机:TD5型,转速不低于4 200 r/min,长沙英泰仪器有限公司;
超声波清洗机:PS-80型,深圳洁康超声波清洗机科技有限公司。
1.2 试剂
甜蜜素、糖精钠、安赛蜜、三氯蔗糖、阿斯巴甜、纽甜、纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠和双乙酸钠标准品:质量分数>90%,德国Dr.Ehrenstorfer Gmbh公司;
甲醇:色谱纯,德国默克公司;
乙酸铵:色谱纯,北京迈瑞达科技有限公司;
水相微孔滤膜:0.22 μm,浙江月旭科技有限公司;
亚铁氰化钾、乙酸锌:分析纯,天津科密欧化学试剂有限公司;
冰乙酸:分析纯,国药集团化学试剂有限公司;
浓盐酸、浓氨水:分析纯,株洲石英化玻有限公司;
氨水(1+1):量取50 mL浓氨水于烧杯中,加入50 mL 超纯水;
盐酸(1+1)溶液:量取50 mL浓盐酸于烧杯中,加入50 mL超纯水;
106 g/L亚铁氰化钾溶液:称取106.0 g亚铁氰化钾,用水溶解,并稀释至1 L;
220 g/L乙酸锌溶液:称取220.0 g乙酸锌,先加30 mL 冰乙酸溶解,用水稀释至1 L;
实验室用水:超纯水,湖南中沃水务环保科技有限公司。
1.3 方法
1.3.1 样品处理
(1) 含酒精类食品:准确称取酒样2.000 0 g于50 mL 烧杯中,于60 ℃水浴上加热30 min,冷却至室温后将其全部转移至100 mL容量瓶中,用超纯水定容至刻度并摇匀,经0.22 μm水相微孔滤膜过滤至进样瓶后备用。
(2) 非蛋白质类食品:液体样品充分混匀,半固体样品用高速分散匀质机匀浆,固体样品用粉粹机充分粉粹并混合均匀。准确称取样品2.000 0 g于80 mL离心管中,加入10 mL甲醇超声提取20 min,再加水10 mL超声提取20 min,用氨水(1+1)或盐酸(1+1)调节pH至6.5,用20 000 r/min均质器匀浆提取5 min,在4 200 r/min 离心5 min,上清液转移至100 mL容量瓶中。再重复提取2次,合并上清液,用超纯水定容至100 mL,经0.22 μm水相微孔滤膜过滤至进样瓶后备用。
(3) 蛋白质类食品:液体样品充分混匀,半固体样品用高速分散匀质机匀浆,固体样品用粉粹机充分粉碎并混合均匀。准确称取样品2.000 0 g于80 mL离心管中,加入10 mL甲醇超声提取20 min,再加水10 mL超声提取20 min,并加2 mL亚铁氰化钾溶液和2 mL乙酸锌溶液以沉淀蛋白质,再用氨水(1+1)调节pH至6.5,用20 000 r/min 均质器匀浆提取5 min,在4 200 r/min离心5 min,上清液转移至100 mL容量瓶中。再重复提取两次,合并上清液,用超纯水定容至100 mL,经0.22 μm水相微孔滤膜过滤至进样瓶后备用。
1.3.2 样品测定方法 将处理好的样液放在自动进样器的进样盘上,进样量为2 μL,数据实时分析采用LCMS8040工作站进行采集。采用Postrun 浏览器软件,外标法定量,得出样品中甜味剂的浓度。再根据式(1)计算样品中各甜味剂的含量。
(1)
式中:
w——样品中各甜味剂和防腐剂的含量,g/kg;
v——样品液的定容体积,mL;
c——由谱图中得出各甜味剂和防腐剂的浓度,μg/L;
m——试样的质量,g。
1.3.3 色谱和质谱条件:
(1) 色谱条件:选择Shim-pack XR-ODS III柱(75 L×2.0 mm,1.6 μm);流速0.25 mL/min;柱温35 ℃;流动相B为甲醇,流动相A为10 mmol/L乙酸铵溶液。梯度洗脱条件:0.00~1.00 min,10% B;1.00~4.00 min,10%~90% B;4.00~9.00 min,90% B;9.00~10.00 min,90%~10% B;10.00~15.00 min,10% B;15.01 min,控制器停止。
(2) 质谱条件:选择电喷雾离子源(ESI);采用多反应监测(MRM)负离子扫描;喷雾电压4.5 kV;脱溶剂管温度95 ℃;加热块温度450 ℃;雾化气流量15 L/min;干燥气流量3 L/min;氩气作为碰撞气,碰撞气压力0.6~0.7 MPa。
2 结果与分析
2.1 各标准物质提取离子图谱
将标准物质溶液按1.3.3色谱和质谱条件进样,得到各组分提取离子图谱,见图1。
2.2 样品前处理方法优化
(1) 酒类样品:酒类主要含有水和乙醇,由于乙醇的存在,会导致目标化合物从色谱柱上洗脱下来的时间大大缩短,导致了保留时间不稳定,从而使目标化合物的保留时间前移,以至于目标化合物未在所设的时间窗中,出现假阴性的结果。为了消除乙醇对检测结果的影响,将酒样于60 ℃水浴上加热30 min以除去乙醇,再用超纯水定容,最后经0.22 μm水相微孔滤膜过滤至进样瓶后备用。
(2) 非蛋白类样品:只要加入甲醇超声,再加入水超声,再用氨水(1+1)或盐酸(1+1)调节pH值为6.5,离心提取并定容,最后经0.22 μm水相微孔滤膜过滤至进样瓶后备用。
(3) 蛋白类样品:由于蛋白质的存在,会吸附一定量的目标化合物,故先加入甲醇超声,再加入水超声,用亚铁氰化钾溶液和乙酸锌溶液除去蛋白质,用氨水(1+1)调节pH值为6.5,离心提取并定容,再经0.22 μm水相微孔滤膜过滤至进样瓶后备用。
2.3 色谱条件的选择
对于三重四级杆液质联用仪来说,流动相的选择不仅要考虑色谱系统的洗脱能力,而且还要考虑目标化合物在质谱中的离子化效率。由于试验研究的6种甜味剂和5种防腐剂,除纳他霉素外,都能很好地溶于水,分别采用甲醇—水、乙腈—水为流动相进行比较。试验表明:虽然乙腈在液相中的洗脱能力比甲醇好,但是进入质谱系统后,6种甜味剂和5种防腐剂的离子化程度明显受到抑制,离子丰度比明显降低,导致灵敏度下降,说明了乙腈的离子化效率低,所以流动相的有机相采用甲醇。
为了使6种甜味剂和5种防腐剂的离子化达到最优灵敏度,所以进行了以下试验:在水相中分别添加5 mmol/L 乙酸铵、10 mmol/L乙酸铵、20 mmol/L乙酸铵、0.1%甲酸—5 mmol/L乙酸铵,同一浓度的6种甜味剂和5种防腐剂的峰面积数据见表1。结果表明:加入10 mmol/L 乙酸铵时得到最优的灵敏度,所以最终确定流动相为甲醇—10 mmol/L乙酸铵的水溶液,并采用梯度洗脱,6种甜味剂和5种防腐剂在5 min内得到了最佳分离效果,甜蜜素、糖精钠、安赛蜜、阿斯巴甜、纽甜、三氯蔗糖、纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠和双乙酸钠的保留时间见表2。结果表明:从各物质响应值、保留时间及离子化效率等综合分析,甲醇—10 mmol/L乙酸铵作为流动相时,优于甲醇—其他浓度的乙酸铵溶液,故试验采用甲醇—10 mmol/L乙酸铵作为流动相。
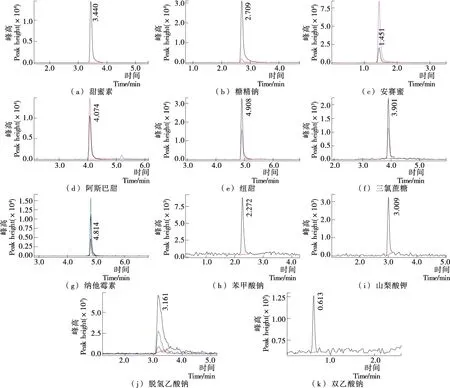
图1 6种甜味剂(甜蜜素、糖精钠、安赛蜜、三氯蔗糖、阿斯巴甜和纽甜)和5种防腐剂(纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠和双乙酸钠)的提取离子色谱图Figure 1 Extraction ion chromatography ofsix kinds of sweeteners (sodium cyclamate, saccharinsodium, acesulfame K, trichlorosucrose, aspartame and neotame) and five kinds of preservatives (natamycin, sodium benzoate, potassium sorbate, sodium dehydroacetate and sodium diacetate)
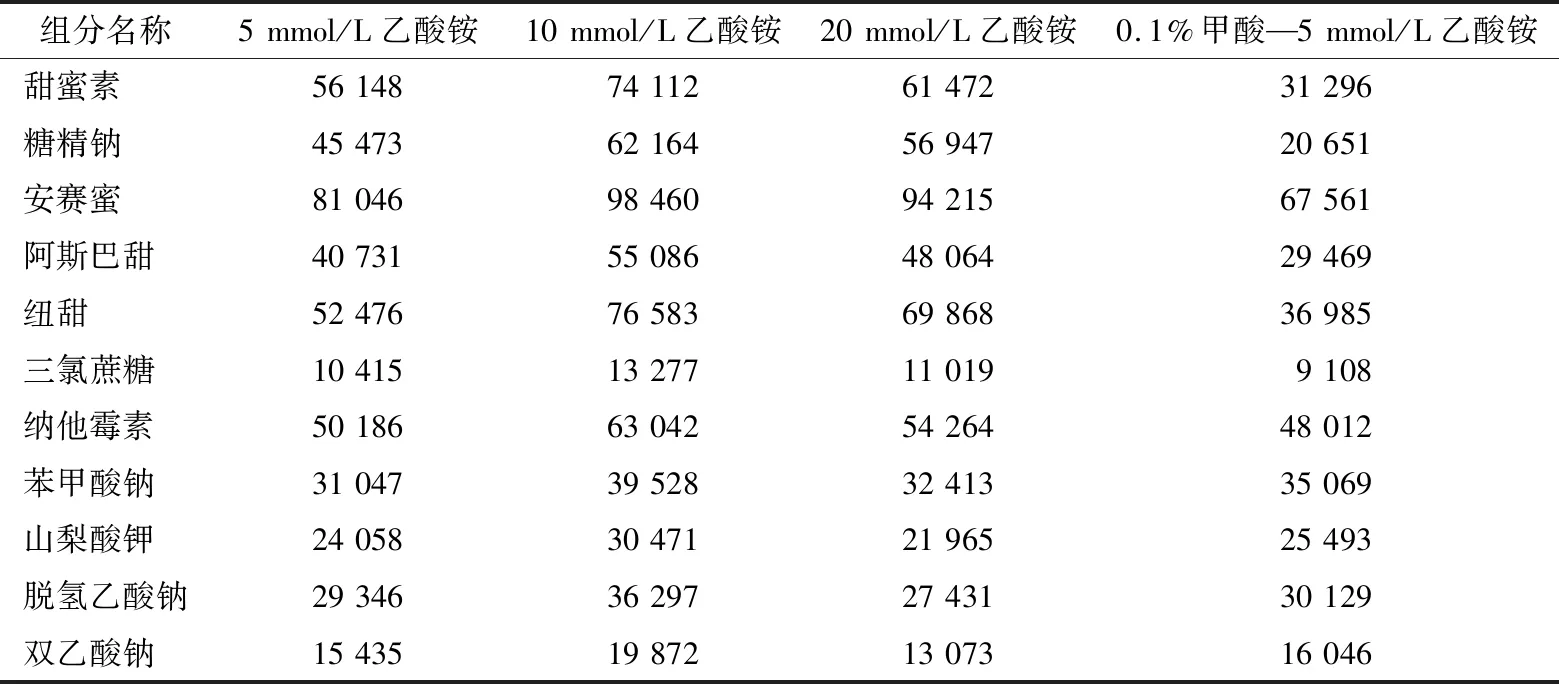
表1 流动相组成对各甜味剂和防腐剂组分峰面积的影响Table 1 The composition of mobile phase to influence on the peak area of sweeteners and preservatives
2.4 质谱条件的建立和定性确证
试验研究的6种甜味剂和5种防腐剂均是极性物质,故采用电喷雾离子源进行离子化。试验中分别采用了正、负离子模式,发现负离子模式下的离子化效率明显高于正离子模式。在全扫描模式下,对于甜蜜素、安赛蜜、苯甲酸钠、双乙酸钠和脱氢乙酸钠来说,确定了M-Na作为母离子;对于糖精钠来说,确定了M-2H2O-Na作为母离子;对于山梨酸钾来说,确定了M-K作为母离子;对于阿斯巴甜、纽甜、三氯蔗糖和纳他霉素来说,确定了M-H作为母离子,通过直接接二通的方式做了MRM自动优化,得到了定量离子、定性离子、Q1预杆电压、碰撞电压(CE)、Q3预杆电压,优化结果见表2。在Pro-scan扫描时,每种甜味剂选择两个响应最强的子离子作为检测的二级子离子,其中丰度高且稳定的离子作为定量离子,并最终确定了甜蜜素、糖精钠、安赛蜜、阿斯巴甜、纽甜、三氯蔗糖、纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠和双乙酸钠的定量离子。
2.5 回收率和精密度
从市面上随机选取了饮料、休闲食品(小鱼仔)、糕点3种典型样品,在空白样品中分别加入3种质量浓度的甜味剂和防腐剂标准溶液,按上述试验条件进行加标回收试验,每个添加水平重复测定6次,计算添加平均回收率和相对标准偏差,结果见表3。从表3可以看出:6种甜味剂和5种防腐剂的平均回收率在73.4%~96.8%,相对标准偏差在1.6%~7.8%。该方法的准确度和精密度均满足多残留分析的要求。
2.6 方法的线性范围和检出限
对6种甜味剂和5种防腐剂的质量浓度在10~1 000 μg/L 的混合标准溶液进行了测定,得到了一系列质量浓度的色谱图,以各甜味剂和防腐剂的色谱峰面积y为纵坐标,以各甜味剂和防腐剂的质量浓度x(μg/L)为横坐标,作线性回归方程,以10倍信噪比(S/N≥10)对应的空白样品添加质量浓度作为方法的定量限(LOQ),得到的线性范围、回归方程,线性系数R2和定量限见表4。结果表明:线性关系良好,相关系数(R2)都在0.996 以上,经样品添加试验确定空白样品中这11种化合物的定量限为1.52~5.04 μg/kg。
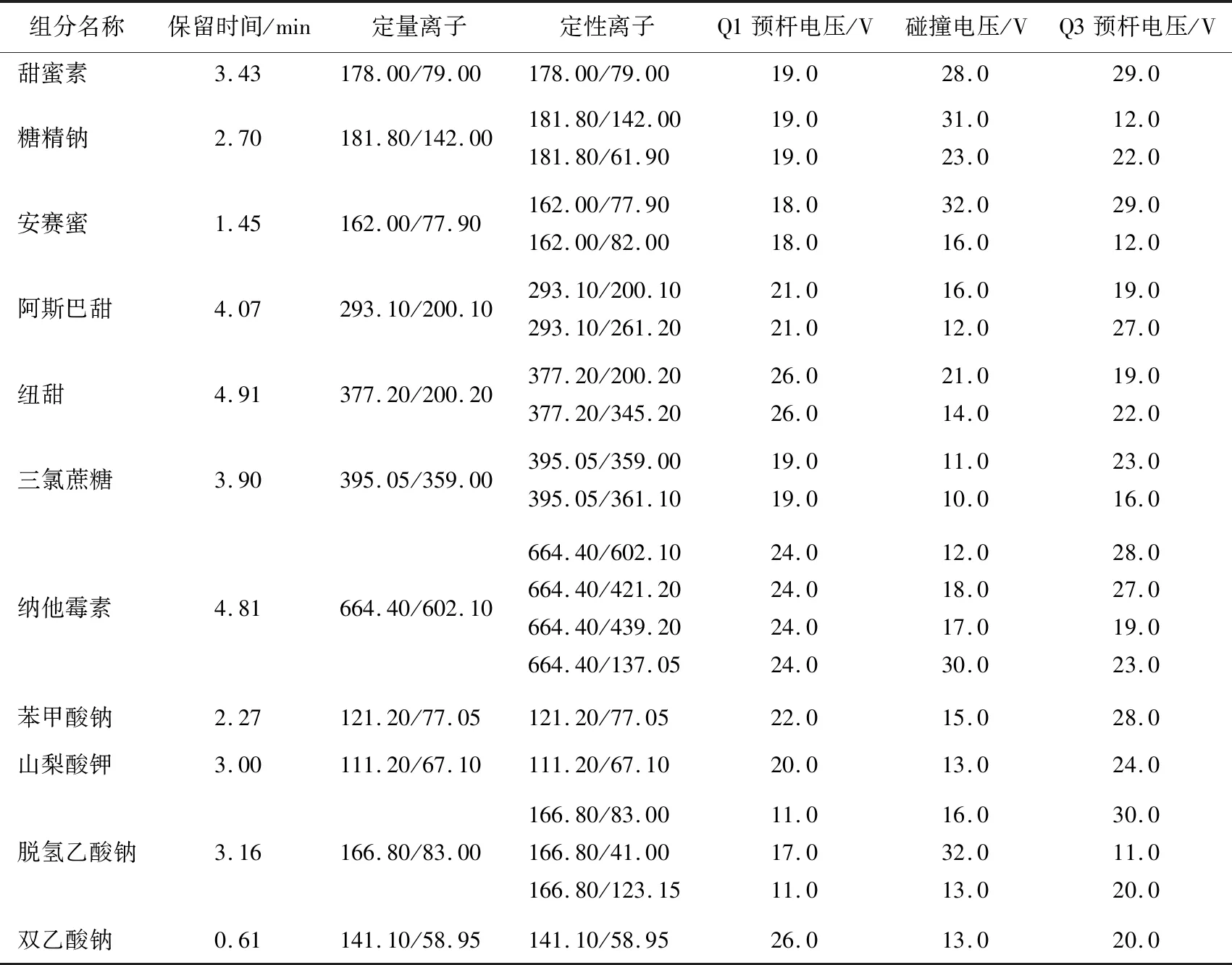
表2 6种甜味剂和5种防腐剂标准物质的保留时间和质谱参数Table 2 The retention time and MS parameters of six kinds of sweeteners and five kinds of preservatives
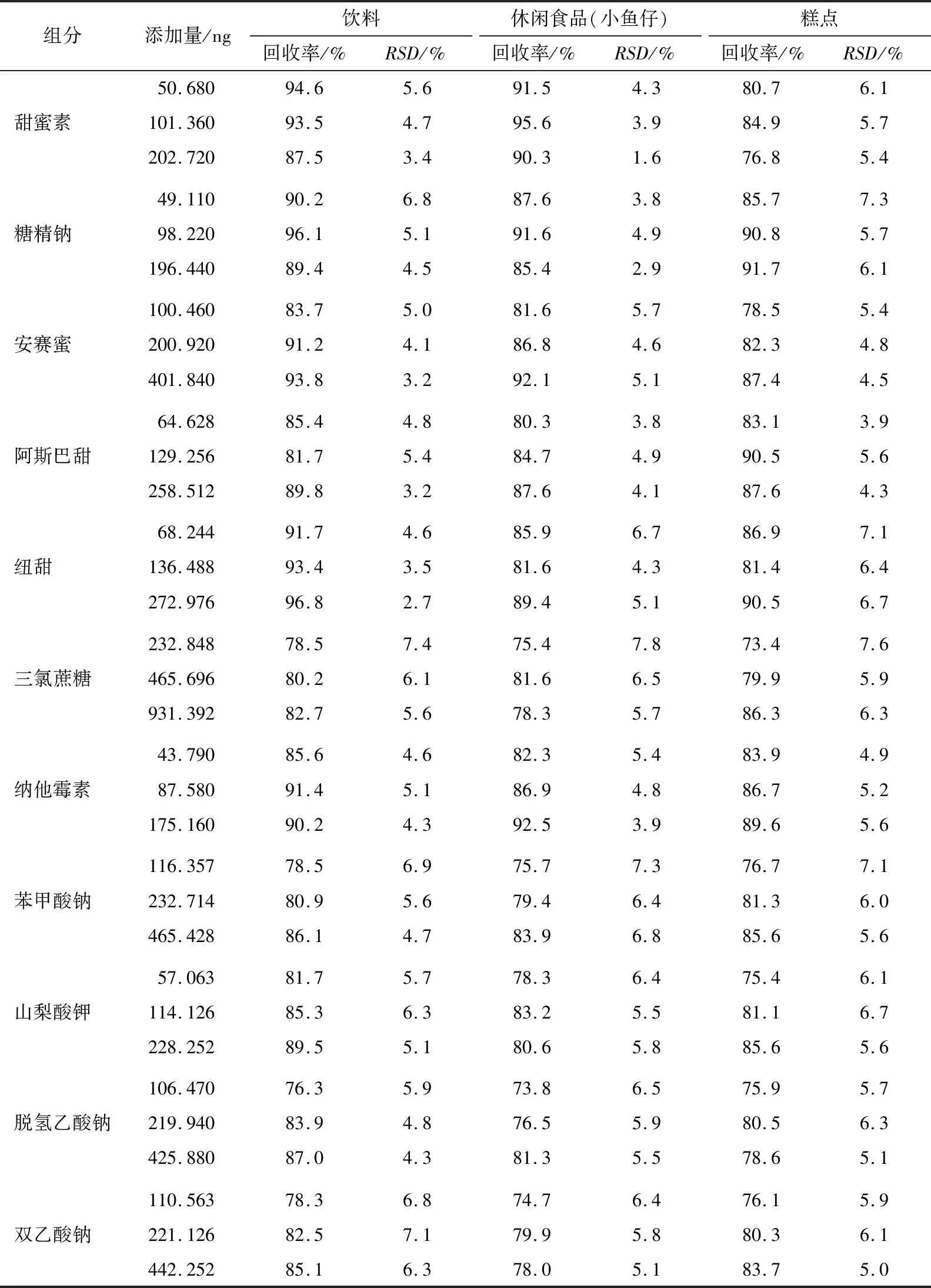
表3 不同食品中6种甜味剂和5种防腐剂的回收率和精密度试验Table 3 The results of the recoveries and RSDs of six kinds of sweeteners and five kinds of preservatives in different foods (n=3)
3 结论
试验采用HPLC-MS/MS分析技术,综合应用了高效液相色谱的高分离能力,利用质谱具有质量范围宽、定性准、高特异性和高灵敏度的特点,能在较短的分析时间内对多组分进行一次性定性和分离,建立了一种食品中多组分甜味剂和防腐剂同时快速测定的方法。研究建立了高效液相色谱—串联质谱法同时对食品中甜蜜素、糖精钠、安赛蜜、三氯蔗糖、阿斯巴甜、纽甜6种甜味剂和纳他霉素、苯甲酸钠、山梨酸钾、脱氢乙酸钠、双乙酸钠5种防腐剂进行定性、定量的确证分析方法。其主要优势在于目标分析物无需衍生且无需净化过柱就可直接测定,缩减了样品前处理时间,节约了试验成本;采用液相色谱—串联质谱分析技术,可以显著提高结果的准确性和检测的灵敏度,同时还减少了检测中出现的假阳性现象;弥补了标准只针对单个或两种甜味剂或防腐剂检测的不足之处。由于试验的6种甜味剂和5种防腐剂,除纳他霉素外,均易溶于水,但纳他霉素能很好地溶于甲醇,故试验时样品前处理先用甲醇超声提取后,再用水超声、定匀、摇匀后离心静置取上清液过滤上机即可(对于含蛋白质的样品还需加乙酸锌和亚铁氰化钾沉淀蛋白质)。试验结果表明:该方法前处理简单、分析速度快、重现性好、准确度高和灵敏度高,有较强的实用性,为各类食品中多种甜味剂和防腐剂的检测提供了一种可靠且准确的方法。

表4 6种甜味剂和5种防腐剂的标准曲线参数Table 4 The calibration curve’s parameters six kinds of sweeteners and five kinds of preservatives
利用高效液相色谱—串联质谱分析技术建立食品中多组分食品添加剂同时测定并进行确证的方法,将成为食品安全质量检测的发展方向之一,能够满足食品中多种甜味剂和防腐剂残留的痕量分析要求,与国标[10-11]方法相比,大大提高了分析效率并降低了分析成本。
