孕期非那雄胺暴露致子代雄性小鼠生殖器官发育异常*
2020-03-03范霞,李飞,黄璜
范 霞, 李 飞, 黄 璜
(贵州省人民医院儿外科, 贵州 贵阳 550001)
性发育障碍(disorders of sexual development,DSD)是常见的出生缺陷疾病之一,影响了近3%的新生儿[1]。DSD的高发病率可归因于一系列复杂的发育障碍,这些发育问题从性分化开始一直持续到性功能成熟时期[2]。隐睾、尿道下裂和阴囊不完全融合是男性常见的性发育障碍[2-3],而女性中,DSD通常表现为先天性子宫异常及阴道缺陷[4-5]。尽管DSD在男性和女性身上都具有临床表现,但缺乏等效的动物模型。
尿道下裂是常见的DSD症状之一,在新生儿出生中发病率为1∶300~1∶250[6]。尿道下裂发生的原因尚未确定,易感基因与外源性内分泌干扰物的相互作用是尿道下裂的诱发因素[7],孕期外源性内分泌干扰物暴露可导致子代尿道下裂以及生殖器官发育异常[8]。男性胎儿生殖器尿道沟闭合和阴茎的完整器官形成均需双氢睾酮(dihydrotestosterone,DHT) 的刺激,而DHT是睾酮在5α-还原酶(5α-reductase,5α-RDA)的作用下转化而来的[9]。因此,睾酮和5α-RDA异常会影响尿道沟的闭合,产生尿道下裂。非那雄胺是5α-RDA抑制剂,临床上主要治疗男性前列腺肥大以及雄性激素脱发以及替代治疗方案用于女性脱发[10]。然而目前,非那雄胺在女性尤其是孕妇接触后对子代生殖器官发育影响的研究尚不完整。
本研究中,雌鼠怀孕0~17 d给予非那雄胺处理,观察其子代雄性小鼠生殖器官发育情况。由于小鼠在幼年期可能存在生殖器官发育迟缓的问题,本研究观察了子代小鼠成年后生殖器官的发育情况并通过HE染色以及免疫荧光染色研究了孕期非那雄胺暴露对子代小鼠睾丸发育以及精子生成的影响。本研究结果提示,孕期避免非那雄胺接触将有利于胎儿的性腺和生殖器官发育。
材 料 和 方 法
1 实验试剂
HE染色试剂盒与PAS染色试剂盒购于北京索莱宝科技有限公司;抗原脱膜液购于Vector Laboratories;抗GATA-1抗体、细胞色素P450scc(cholesterol side-chain cleavage enzyme)抗体、Alexa Fluor®488偶联的荧光 II 抗与DAPI染液购于Cell Signaling Technology;抗Ki67抗体购于Thermo Fisher Scientific;抗caspase-3抗体与抗沙漠刺猬因子(desert hedgehog,Dhh)抗体购于Santa Cruz;抗MVH(mouse Vasa ho-mologue)抗体购于Abcam。
2 实验动物
8周龄SPF级雌性与雄性CD-1小鼠(各20只,♂30 g~32 g,♀26 g~28 g)购自贵州医科大学实验动物中心 [SCXK(黔)2018-0001]。小鼠饲养在SPF级动物房中,自由进食进水,温度(23±1)℃,光照明暗交替12 h。所有动物实验均通过本院伦理委员会审查,并符合动物福利3R原则。
3 方法
3.1药物处理 实验动物在饲养环境中适应1周后配种,1只雄性CD-1与3只动情期雌性CD-1同笼饲养。第2天早上检查小鼠阴栓,检查到阴栓认为交配成功。孕鼠随机分为对照组与非那雄胺组。根据预实验结果以及文献描述的方法[11]进行换算,孕期非那雄胺暴露组母鼠在交配成功后0~17 d内每天经灌胃给予非那雄胺的剂量为8.0 mg/kg,对照组母鼠给予同体积生理盐水灌胃。分娩后,对照组中随机取18只子代雄性崽鼠,孕期非那雄胺暴露组随机取22只子代雄性崽鼠,继续饲养4个月。
3.2宏观形态学观察 直接采用D750型相机(Nikon)拍摄对照组以及非那雄胺组子代雄性小鼠下腹外生殖器部图像,宏观观察包皮、阴囊和尿道口的发育情况;采用ImageJ软件测量肛门与生殖器间距离(anogenital distance,AGD)。对子代雄性小鼠麻醉后,在小鼠下腹部进行生殖器官解剖,拍照获得图像,宏观观察睾丸位置、阴茎/尿道大小与位置;采用ImageJ软件测量阴茎与睾丸的长度。
3.3组织学染色 分离的阴茎与睾丸,在4 ℃下固定在4%多聚甲醛中。脱水嵌入石蜡后,阴茎石蜡组织制作成5 μm厚纵向切片;睾丸石蜡组织制作成5 μm厚肠横向切片。随后将切片脱水、再水化,行常规HE染色,并随机拍摄6个视野图像。按照Rodriguez E等[12]所述方法,采用ImageJ软件测量雄性泌尿系统交配隆突(male urogenital mating protube-rance,MUMP)长度、MUMP尖端至尿道口距离、MUMP阴茎海绵体(MUMP corpus cavernosum,MCC)长度和阴茎骨长度。每只小鼠选择6张睾丸组织HE染色图像并对生精小管计数和量化生精小管管腔与间质间隙大小,取平均值。睾丸石蜡组织切片行常规PAS染色,计数生精小管官腔内精子。
3.4免疫荧光染色 每组随机选8~10只子代雄性小鼠的睾丸组织石蜡切片脱水后再水化,在10%甲醇中用3%的H2O2对内源性过氧化物酶进行灭活,随后将载玻片在抗原脱膜液中煮沸。分别滴加 I 抗[GATA-1(1∶200)、P450scc(1∶100)、Ki67(1∶100)、caspase-3(1∶500)、Dhh(1∶100)和MVH(1∶200)],4 ℃下孵育过夜。次日,PBS洗3次后,滴加荧光 II 抗(1∶500),室温避光孵育1 h。荧光显微镜下观察并拍摄选择5个视野。利用ImageJ软件量化生精小管的阳性GATA-1荧光强度用于评估每个生精小管的睾丸支持细胞(Sertoli细胞)数;量化间质间隙区阳性P450scc荧光强度用于评估睾丸间质细胞(Leydig细胞)数;量化阳性MVH荧光强度用于评估精原细胞数;同时量化阳性Ki67、caspase-3与Dhh的荧光强度。
4 统计学处理
采用GraphPad Prism 7.0软件进行统计分析。计量数据采用均数±标准差(mean±SD)表示,组与组之间比较采用双尾t检验,以P<0.05为差异有统计学意义。
结 果
1 孕期非那雄胺暴露对子代雄性小鼠外生殖器官畸形的影响
对照组子代雄性小鼠包皮发育正常,阴囊完全融合,AGD和尿道口发育正常,孕期非那雄胺暴露组子代雄性小鼠阴囊融合不完全、AGD显著缩短(P<0.01),见图1,且有6只小鼠发生尿道下裂现象(黑色箭头示)。进一步对阴茎分离并检测,结果显示,对照组子代雄性小鼠阴茎与龟头发育正常,孕期非那雄胺暴露组子代雄性小鼠阴茎和龟头均畸形;统计结果显示,与对照组相比,孕期非那雄胺暴露组子代雄性小鼠MUMP长度、MUMP尖端至尿道口距离、MCC长度和阴茎骨长度均显著缩短(P<0.01),见图2。
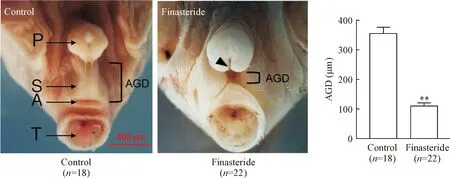
Figure 1. The effects of finasteride exposure during pregnancy on external genital malformation in offspring male mice. Black arrow indicates hypospadias; A: anus; P: prepuce; S: scrotal sac; T: tail; AGD: anogenital distance. Mean±SD.**P<0.01vscontrol group.
图1 孕期非那雄胺暴露对子代雄性小鼠外生殖器官畸形的影响
2 孕期非那雄胺暴露对子代雄性小鼠睾丸发育的影响
对照组子代雄性小鼠睾丸位于正常的阴囊位置并在阴茎水平线以下,见图3A;孕期非那雄胺暴露组子代雄性小鼠睾丸不同程度的不完全下降,见图3B,其中15只小鼠双侧睾丸下降,7只小鼠单侧睾丸下降。且相比于对照组,孕期非那雄胺暴露组子代雄性小鼠睾丸长度显著缩短(P<0.01),见图3C、D和I。HE结果显示,对照组子代雄性小鼠睾丸发育正常,见图3E;孕期非那雄胺暴露组子代雄性小鼠睾丸发育不良,见图3F;统计结果显示,与对照组相比,孕期非那雄胺暴露组子代雄性小鼠睾丸生精小管密度显著降低(P<0.01),见图3J,生精小管管腔和间质间隙均显著增大(P<0.01),见图3K、L。PAS染色显示,与对照组相比,孕期非那雄胺暴露组子代雄性小鼠睾丸的生精小管管腔成熟精子数显著降低(P<0.01),见图3G、H和M。
3 孕期非那雄胺暴露对子代雄性小鼠精子生成的影响
通过GATA-1和P450scc荧光染色结果显示,与对照组相比,孕期非那雄胺暴露组子代雄性小鼠Sertoli细胞和Leydig细胞密度均显著降低(P<0.01),并且对照组成熟精子所在的生精小管管腔有较强的DAPI信号(P450scc对照组染色图片白色虚线内)。Caspase-3、Ki67与Dhh荧光染色结果显示,与对照组相比,孕期非那雄胺暴露组子代雄性小鼠睾丸中生精小管细胞caspase-3荧光强度显著增加(P<0.01),Ki67与Dhh荧光强度均显著降低(P<0.01)。MVH荧光染色结果显示,与对照组相比,孕期非那雄胺暴露组子代雄性小鼠睾丸中精原细胞数显著降低(P<0.01),且生精小管管腔中基本没有成熟精子生成(MVH非那雄安组染色图片白色虚线内)。见图4。
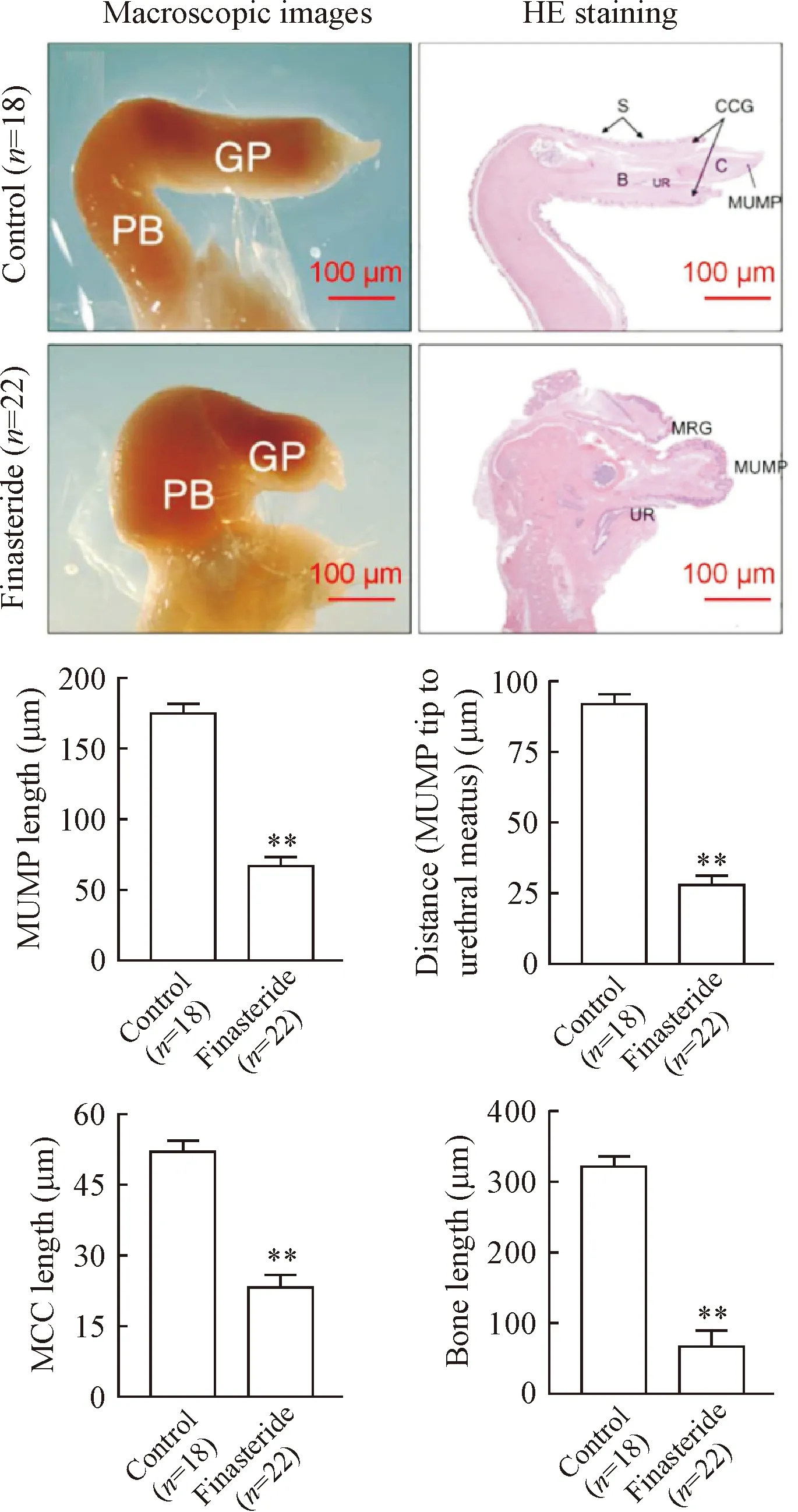
Figure 2. The effects of finasteride exposure during pregnancy on penile structure and morphology of offspring male mice. MUMP: male urogenital mating protuberance; CCG: corpus cavernosum glandis; MCC: MUMP corpus cavernosum; MRG: MUMP ridge groove; GP: glans penis; GR: glanular ridge; UR: urethra; UM: urethral meatus; PB: penile body; P: penis; S: scrotum; B: bone; C: cartilage. Mean±SD.**P<0.01vscontrol group.
图2 孕期非那雄胺暴露对子代雄性小鼠阴茎结构及形态的影响
讨 论
DSD是成因复杂、临床表型多样的一类疾病。在DSD中,不同病因可能有相同或相似的临床表现,且同一病因也会导致不同的临床表型。隐睾、尿道下裂和不完全阴囊融合与男性新生儿先天性生殖异常有关[2-3],而这其中具体的作用机理并不清楚。本研究主要研究孕期非那雄胺暴露与子代DSD的关系。有研究报道, 10 mg/kg非那雄胺连续喂养新西兰大白兔7 d,尿道下裂发生率达90%[13],这些结果提示,非那雄胺具有对动物性腺发育不良的影响,然而孕期接触非那雄胺对子代的生殖器官发育影响的报道尚少。
现在普遍认为,孕期宫内雌激素暴露或雄激素缺乏均可导致子代尿道下裂。临床分析结果也提示,女性妊娠前服用避孕药与子代尿道下裂发生相关[14]。而非那雄胺是睾酮代谢成为更强的DHT过程中5α-RDA的特异性抑制剂,可作替代方案用于治疗女性脱发[10]。本研究发现在孕期非那雄胺暴露组的子代雄性小鼠中出现尿道下裂和生殖器官发育异常现象。
阴茎结构畸形导致其无法正常与雌性交配,而这些子代的精子生成能力却并不明确。本研究结果显示,非那雄胺暴露组雄性子代的睾丸显示出较少的生精小管数与增加的间质间隙和生精小管管腔空间,并且其管腔中成熟精子数极低,提示,非那雄胺暴露组雄性子代的精子发育产生缺陷。随后本研究对孕期非那雄胺暴露影响子代雄性小鼠生育能力的细胞发育机制进行了研究。Sertoli细胞是为发育中的精子提供保护和营养的细胞,精子发育的各个阶段都是发生在Sertoli细胞表面[15-16]。Leydig细胞是分泌雄性激素的内分泌细胞,主要调节雄性性器官的发育和成熟,维持雄性第二性特征,并在精子发生中起到重要作用[17-18]。本研究结果显示,非那雄胺暴露组子代雄性小鼠中Sertoli细胞和Leydig细胞都普遍减少。Dhh在雄性性腺分化中起作用[19],研究表明,Dhh缺陷与部分性腺发育不全有关[20]。在睾丸中,Dhh作为精母细胞活化因子起作用,对于睾丸发育至关重要[21]。本研究还发现,非那雄胺暴露组子代雄性小鼠睾丸中生精小管细胞caspase-3阳性信号增加,生精小管细胞Dhh阳性信号与增殖标志物Ki67阳性信号降低,精母细胞减少。这些研究结果提示,非那雄胺暴露组子代雄性小鼠睾丸中维持精子发生与发育相关的生精小管细胞受损,其凋亡水平增加,而生长水平降低,进一步说明孕期非那雄胺暴露可抑制子代雄性小鼠的精子生成。而有研究报道,在不育症人群中,接受非那雄胺治疗者在停药后精子计数较治疗前显著升高[22],与之相关的有关非那雄胺对成熟性腺中精子生成产生影响的机制尚不明了。本研究结果提示孕期非那雄胺暴露可能通过导致子代雄性的性器官发育异常,进而影响精子发生与发育,而孕期非那雄胺暴露是否对雄性胎鼠在性腺发育过程中产生影响,还需要进一步研究。
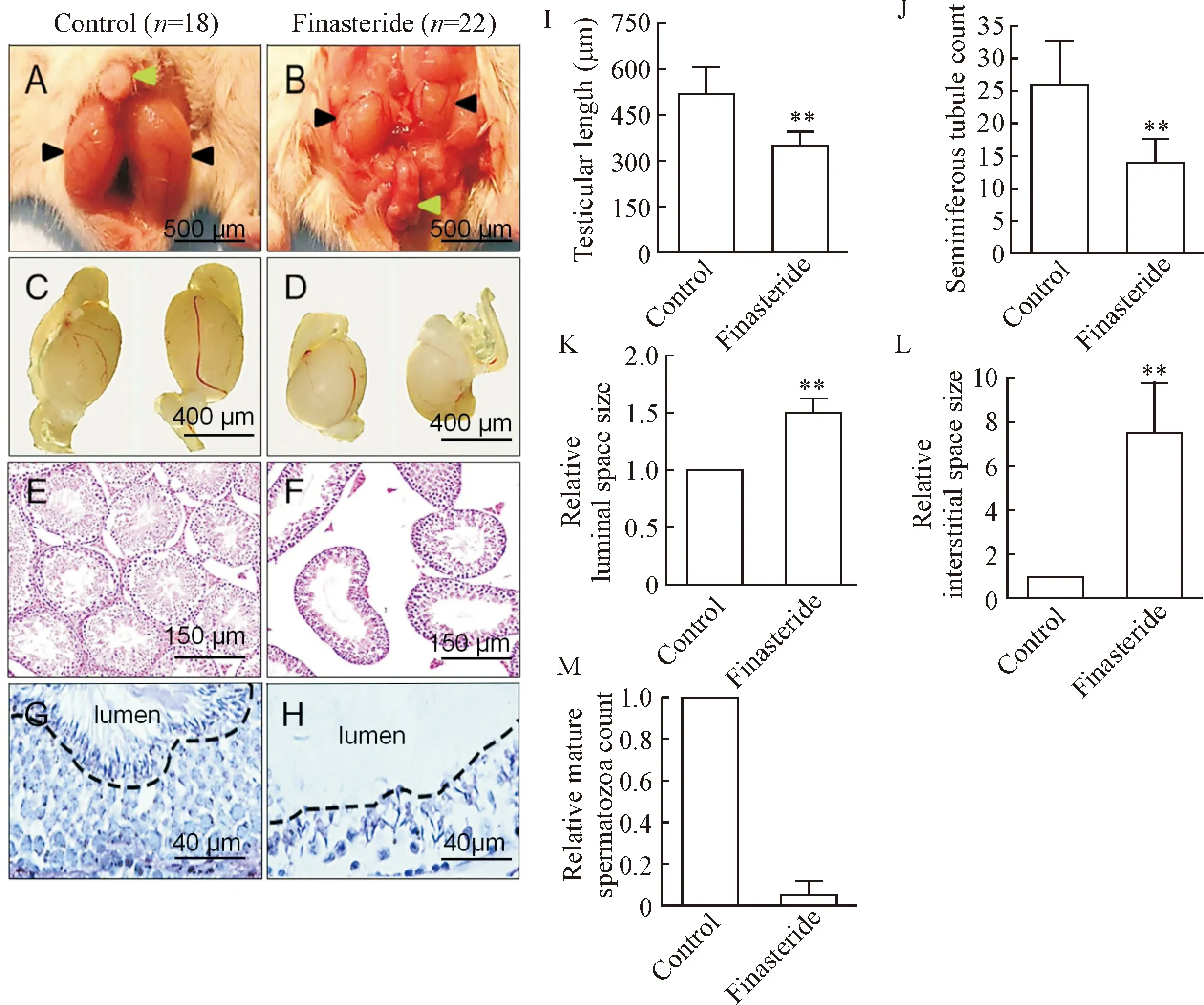
Figure 3. The effects of finasteride exposure during pregnancy on testicular development in offspring male mice. A, B: gross dissection of the lower abdomen and genital region of offspring male mice; C, D: representative macroscopic images of isolated testes of offspring male mice; E, F: representative HE staining images of testicular tissues of offspring male mice; G, H: representative PAS staining images of seminiferous tubules of offspring male mice. The black dashed line separating luminal space of seminiferous tubule; I~M: statistical results of testicular development including testicular length (I), seminiferous tubule count (J), relative luminal space size of seminiferous tubules (K), relative interstitial space size of testises (L), relative mature spermatozoa count of seminiferous tubules (M). Black arrow indicates testis; green arrow indicates penis. Mean±SD.**P<0.01vscontrol group.
图3 孕期非那雄胺暴露对子代雄性小鼠睾丸发育的影响
综上所述,本研究目前结果显示,孕期非那雄胺暴露可导致子代成年雄性小鼠性器官发育异常与精子发生,这一研究结果为DSD的病因提供了新的研究方向,并且提示,孕期应尽量避免非那雄胺接触。
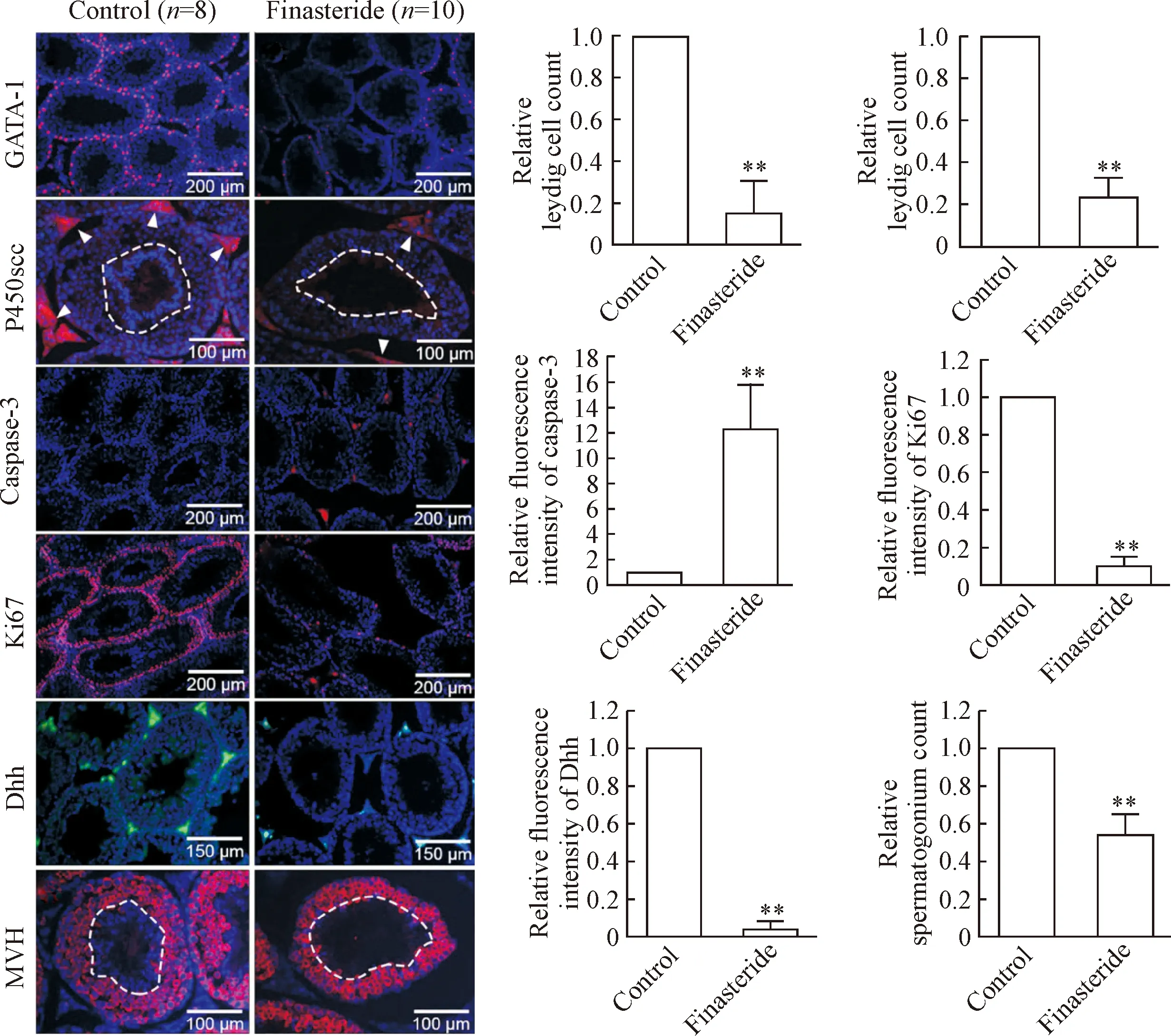
Figure 4. The effects of finasteride exposure during pregnancy on spermatogenesis in offspring male mice. Mean±SD.**P<0.01vscontrol group.
图4 孕期非那雄胺暴露对子代雄性小鼠精子生成的影响
[9] Drobnis EZ, Nangia AK. 5α-Reductase inhibitors (5ARIs) and male reproduction[J]. Adv Exp Med Biol, 2017, 1034:59-61.
[10] Hu AC, Chapman LW, Mesinkovska NA. The efficacy and use of finasteride in women: a systematic review[J]. Int J Dermatol, 2019, 58(7):759-776.
[11] Bowman CJ, Barlow NJ, Turner KJ, et al. Effects of in utero exposure to finasteride on androgen-dependent reproductive development in the male rat[J]. Toxicol Sci, 2003, 74(2):393-406.
[12] Rodriguez E Jr, Weiss DA, Yang JH, et al. New insights on the morphology of adult mouse penis [J]. Biol Reprod, 2011, 85(6):1216-1221.
[13] Kurzrock EA, Jegatheesan P, Cunha GR, et al. Urethral development in the fetal rabbit and induction of hypospadias: a model for human development [J]. J Urol, 2000, 164(5):1786-1792.
[14] 张干林, 张金明. 尿道下裂病因学研究进展[J]. 中华小儿外科杂志, 2014, 35(3):230-232.
[15] 陈秀芳, 金丽琴, 董敏, 等. 葛根素对糖尿病大鼠睾丸的保护作用[J]. 中国病理生理杂志, 2009, 25(10):2033-2039.
[16] Ghaffari R, Di Bona KR, Riley CL, et al. Copper transporter 1 (CTR1) expression by mouse testicular germ cells, but not Sertoli cells, is essential for functional spermatogenesis[J]. PLoS One, 2019,14(4):e215522.
[17] 林中民, 王芳, 张泉波, 等. 姜黄素衍生物B06对2型糖尿病大鼠睾酮合成的影响[J]. 中国病理生理杂志, 2016, 32(2):352-358.
[18] 刘素嬛, 王忠山, 许宗革, 等.青春期糖尿病大鼠生殖腺内5α-还原酶(2型)的基因表达[J]. 中国病理生理杂志, 2004, 20(9):1580-1582.
[19] Martin LJ. Cell interactions and genetic regulation that contribute to testicular Leydig celldevelopment and differentiation[J]. Mol Reprod Dev, 2016, 83(6): 470-487.
[20] Paris F, Flatters D, Caburet S, et al. A novel variant of DHH in a familial case of 46, XY disorder of sex development: insights from molecular dynamics simulations[J]. Clin Endocrinol (Oxf), 2017, 87(5):539-544.
[21] O′Hara WA, Azar WJ, Behringer RR, et al. Desert hedgehog is a mammal-specific gene expressed during testicular and ovarian development in a marsupial[J]. BMC Dev Biol, 2011, 11:72.
[22] Samplaski MK, Lo K, Grober E, et al. Finasteride use in the male infertility population: effects on semen and hormone parameters[J]. Fertil Steril, 2013, 100(6):1542-1546.
