HIE幼龄大鼠神经元自噬诱导线粒体功能障碍的研究
2020-03-03李晓华
李 鹏, 李晓华, 苏 秦 , 白 静, 郝 雷△
(1内蒙古医科大学附属医院儿科, 内蒙古 呼和浩特 010050; 2内蒙古医科大学病理生理学教研室, 内蒙古 呼和浩特 010059)
缺氧缺血性脑病(hypoxic ischemic encephalopathy,HIE)是引起新生儿脑功能障碍的重要因素,40%左右的HIE可以引起永久的脑损伤,甚至残疾,例如惊厥、癫痫、脑瘫及智力缺陷等。尽管目前人们对HIE有较全面的研究,但HIE仍然是引起新生儿高死亡率的重要原因。因此,进一步探讨HIE的发病机制,探寻减少缺氧缺血引起的新生儿脑部损伤的可能方法具有重要的研究意义。
新生儿HIE的特点是细胞死亡、炎症和氧化应激[1-2]。在氧化应激刺激下,常常出现线粒体的功能受损,并诱发神经元凋亡的出现[3-4]。自噬是组织细胞的另一种死亡方式,大多数情况下具有一定的保护意义。那么在HIE时,是否会出现神经元自噬现象以及其与神经元线粒体功能变化的关系如何?基于以上,本研究探讨了自噬对新生大鼠HIE模型中神经元线粒体功能障碍诱导的影响,以期更深入地探讨HIE的发生机制,从而为临床上HIE的治疗提供新的研究方向。
材 料 和 方 法
1 动物
10日龄SPF级SD大鼠共30只,体重15~20 g,雌雄各半,购自内蒙古医科大学实验动物中心[SCXK(蒙)2015-0001],屏障环境标准条件饲养,分为假手术组(sham组,15只)及模型组(HIE组,15只)。
2 主要试剂
兔抗鼠caspase-3抗体、谷氨酰胺和成纤维细胞生长因子购自Sigma-Aldrich;兔抗鼠LC3B抗体和山羊抗兔 II 抗购自Abcam;SABC免疫组化试剂盒购自武汉博士徳生物公司;DMEM培养基和Neuroba-sal-A培养基购自Gibco;脂质体 2000、MitoSOXTMRed及5-(6)-氯甲基-2,7′-二氯二氢荧光素二乙酸酯购自Invitrogen;其它生化试剂均为进口分装或国产分析纯。
3 主要方法
3.1HIE模型复制 在30%O2/70% N2混合空气中加入2%异氟烷作为麻醉剂,吸入麻醉。切开颈部皮肤,HIE组大鼠使用6-0手术丝线结扎左侧颈总动脉,缝合切口, 将幼鼠置于37 ℃恒温箱中45 min后,进入低氧室(8% O2/92% N2)内2 h(氧流量2 L/min),之后送回母鼠笼饲养24 h,之后处死取材。sham组幼鼠仅麻醉后暴露一侧颈动脉,但不结扎,除未进入低氧室外,其余饲养条件及操作同HIE组。
3.2HE染色及免疫组织化学检测活化型caspase-3及LC3B-II 实验终点时,各组幼鼠麻醉下用4%甲醛溶液心脏灌注,开颅取出脑组织、沿矢状线切开,取一部分脑组织(其余部分待用),4%多聚甲醛固定后进行常规HE染色。根据以下程序进行免疫组织化学染色: 在85 ℃ PBS(pH 6.0)的中洗涤10 min修复幼鼠脑组织中的抗原,滴加活化型caspase-3的兔抗鼠I抗(1 ∶300)及LC3B-II兔抗鼠 I 抗(1 ∶200),37 ℃孵育1 h。然后加入辣根过氧化物酶标记的山羊抗兔II抗,4 ℃、孵育1 h,DAB显色,苏木素复染。每次孵育前均用加入Tween-20的PBS(PBST)缓冲液洗涤3次。
3.3神经元的体外培养 用眼科剪将另一部分脑皮质组织剪成薄片,置于DMEM培养基中,并加入0.125%胰蛋白酶和10 mg/L DNA酶,37 ℃孵育15 min制备单细胞悬液。将细胞重悬并用加入2% B-27的DMEM洗涤,800×g离心5 min。然后将细胞培养在含有2% B-27的DMEM、0.5 mmol/L谷氨酰胺、1.0×105U/L青霉素和100 mg/L链霉素的Neurobasal-A培养基中,浓度为3×108/L,并由聚L-赖氨酸覆盖。培养基在第24小时更新,然后在传代中更新4次,并在培养基中加入成纤维细胞生长因子(5 μg/L),原代神经元传代6~7代后备用。将传代后取得的神经元置于含有5% CO2和2% O2的缺氧培养箱中孵育,连续监测和调节。
3.4GFP-LC3定量分析 将携带GFP-LC3 reporter质粒的脂质体2000转染至上述经处理的神经细胞,24 h后观察细胞的GFP阳性的囊泡,在荧光显微镜下计数自噬囊泡,每个样品至少计数100个细胞,并以每个细胞中5个GFP-LC3点状聚集物作为阳性对照,使用Fluoview 5.0软件分析。
3.5Western blot检测蛋白水平 将上述处理的神经元细胞中加入200 μmol/L H2O2混合6 h,再滴入冰冻细胞裂解剂,然后补充蛋白酶抑制剂。BCA测定每个样品的蛋白浓度,8%~12% SDS-PAGE凝胶分离,然后将分离的蛋白转移至PVDF膜,分别加入兔抗鼠LC3B-I、LC3B-II和GAPDH多克隆抗体(I 抗),以及辣根过氧化物酶标记的山羊抗兔IgG(II 抗)孵育。ECL显影成像系统检测每种靶蛋白与其抗体的特异性结合,计算各条带积分吸光度与GAPDH的百分比。
3.6细胞内活性氧簇(reactive oxygen species,ROS)和线粒体超氧化物的测定 用ROS敏感荧光基团5-(6)-氯甲基-2,7′-二氯二氢荧光素二乙酸酯的氧化来定量检测细胞内活性氧簇。在6孔板中的融合神经元细胞(每孔5×105)上加入5 μmol/L探针,再加入5-(6)-氯甲基-2,7′-二氯二氢荧光素二乙酸酯,37 ℃、5% CO2在Hanks平衡盐溶液(Hanks′ balanced salt solution, HBSS)中孵育30 min。去除探针后用HBSS冲洗细胞,使用具有488 nm的激发源和530 nm发射波长的光谱仪测定2,7′-二氯荧光素(2,7′-dichlorofluorescein, DCF)荧光。线粒体超氧化物水平应用MitoSOXTMRed检测。将各种处理后的细胞与5 μmol/L MitoSOXTMRed在37 ℃下孵育20 min,洗涤细胞,检测MitoSOXTMRed荧光。
3.7线粒体膜电位(mitochondrial membrane potential,MMP)的测定 使用TMRE-线粒体膜电位测定试剂盒。TMRE是一种红橙色带正电荷的细胞渗透性染料,容易积聚在带负电荷的活性线粒体膜内。去极化或无活性的线粒体膜电位降低,不能螯合TMRE。上述处理后的1×105个神经元细胞在37 ℃、5%CO2下用MMP敏感性荧光染料TMRE温育20 min(在TMRE之前10 min向阳性对照细胞加入1 μmol/L FCCP)。孵育后,加入胰蛋白酶,离心,在0.4 mL含0.2%BSA的DPBS中进行细胞微粒重悬,通过流式细胞术分析TMRE荧光,其中TMRE的激发/发射荧光波长为为549 nm/575 nm。
4 统计学处理
用SPSS 17.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,计量资料组间比较采用Student’st检验,计数资料采用卡方检验。以P<0.05 为有统计学意义。
结 果
1 病理变化及及免疫组织化学检测自噬/凋亡相关生物标志物
HE染色结果表明,与假手术组大鼠相比,经历缺氧缺血的大鼠脑组织病理表现为脑组织萎缩、脑室扩大,见图1。
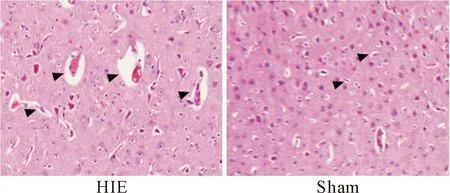
Figure 1. Pathological changes of rat brain tissues in sham and model group (HE staining,×200).
图1 HIE组和sham组大鼠脑组织的病理变化
免疫组织化学检测显示,在HIE组大鼠脑组织中活化型caspase-3染色阳性比sham组明显增多;此外,在自噬体形成中起重要作用的LC3B-II,HIE组大鼠脑组织中染色比sham组也明显加深,见图2。HIE组的活化型caspase-3和LC3B-II的表达率均显著高于sham组(P<0.01),见表1。
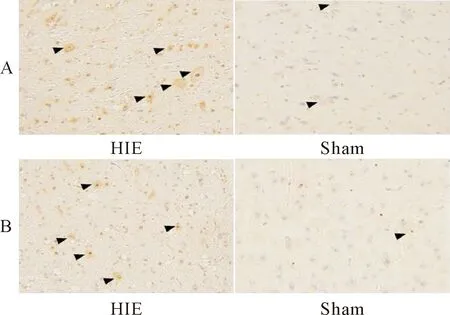
Figure 2. Immunohistochemical staining for cleaved caspase-3 (A) and LC3B-II (B) in sham and model groups.
图2 HIE组和sham组大鼠活化型caspase-3和LC3B-II免疫组织化学染色结果
表1 HIE组和sham组大鼠活化型caspase-3和LC3B-II免疫组织化学染色结果及GFP阳性酸性囊泡细胞器计数的比较
Table 1. Immunohistochemical staining for cleaved caspase-3 and LC3B-II and counting of the GFP-positive acidic vesicular organelles (AVOs) in sham and model groups (%. Mean±SD.n=15)
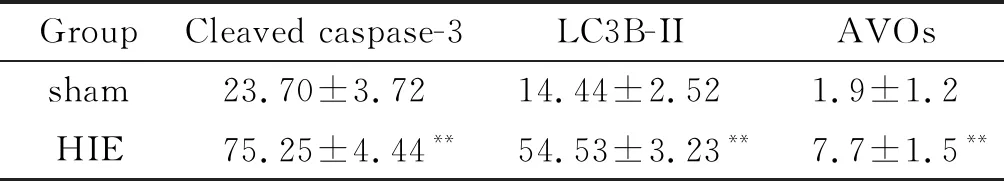
GroupCleaved caspase-3LC3B-IIAVOssham23.70±3.7214.44±2.521.9±1.2HIE75.25±4.44** 54.53±3.23**7.7±1.5**
**P<0.01vssham group.
2 定量GFP-LC3分析
体外实验中,在荧光显微镜下通过GFP-LC3观察细胞自噬特异性酸性囊泡细胞器(acidic vesicular organelles,AVOs)的变化,结果显示,与在常氧条件下的神经元相比,缺氧时神经元中存在GFP阳性AVOs明显增多(P<0.01),见图3和表1。
3 Western blot分析结果
Western blot结果显示,缺氧时神经元中LC3B-I向LC3B-II的转化率更高,见图4。
4 线粒体功能的测定
荧光显微镜下,sham组可观察到少量DCF阳性(绿色荧光)神经元,然而,HIE组出现较多的DCF阳性神经元,相对DCF荧光强度两组相比差异具有统计学意义(P<0.01),见图5和表2。对活细胞渗透剂及线粒体定位因子MitoSOXTMRed的检测结果显示,与sham组相比,HIE组大鼠神经元中线粒体超氧化物水平明显上调(P<0.01);MMP检测结果显示,HIE组神经元的MMP显著降低(P<0.01),见表2。
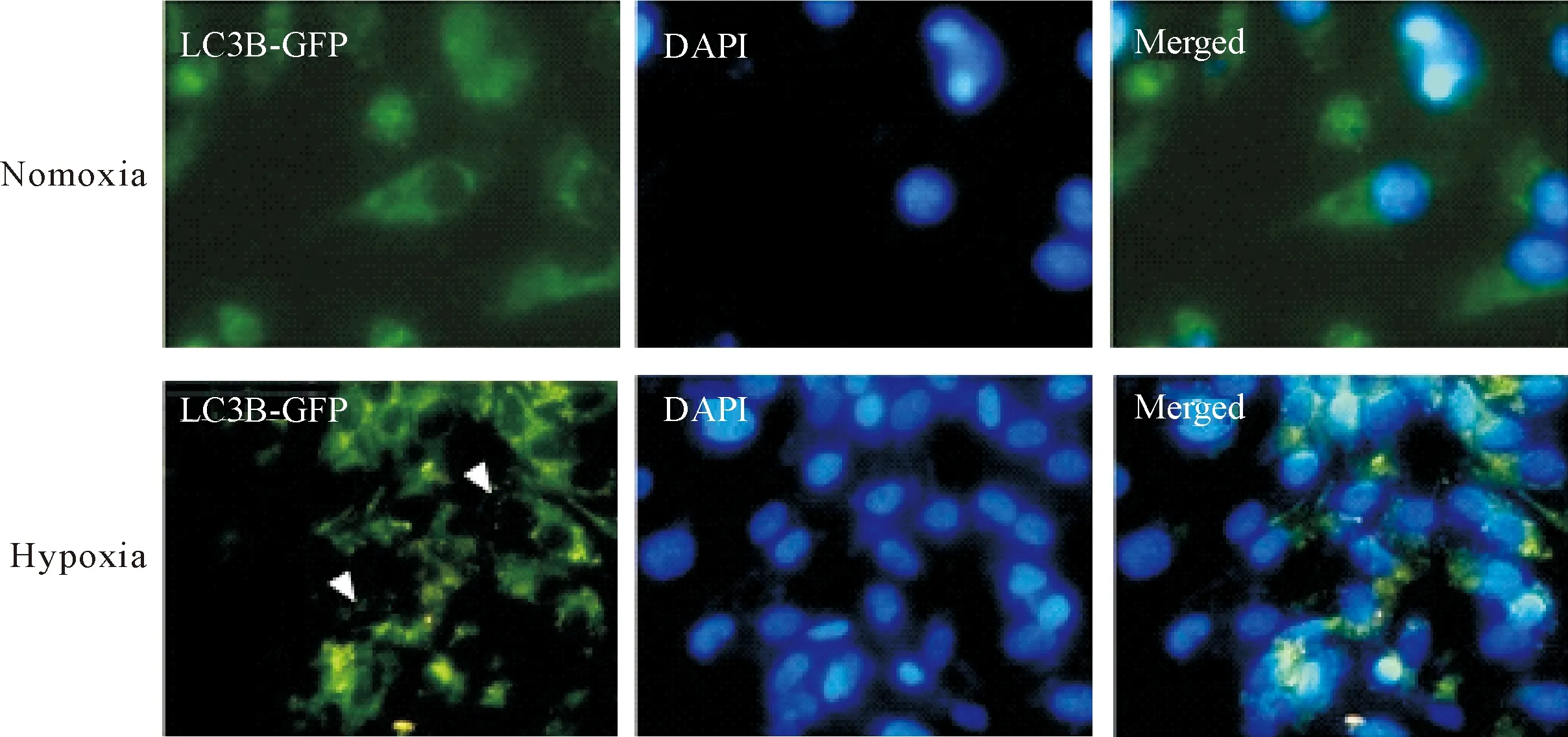
Figure 3. Autopahgy induction in the rat neurons under normoxia and hypoxia (×400).
图3 常氧和缺氧下大鼠神经元自噬的观察

Figure 4. The relative expression of LC3B-II/LC3B-I in the rat neurons of normoxia and hypoxia groups. Mean±SD.n=3.**P<0.01vsnomoxia group.
图4 Western blot检测常氧和缺氧下LC3-A 向LC3B-II 的转化
讨 论
新生儿缺血缺氧性脑病是导致新生儿大脑损伤的重要因素,其主要机制是大量氧化因子增加导致的神经功能损伤。因此如何抑制氧化因子的作用成为保护缺血缺氧性脑病的关键。HIE可干扰未成熟大脑发育过程中的多种信号传导途径。新生儿大脑对各种有害因素更敏感,更容易激活细胞凋亡级联反应[5],因此,细胞凋亡在中枢神经系统发展中是常见的。在氧化应激刺激下,功能受损的线粒体引起细胞色素C的释放,易导致发育中的脑内前凋亡蛋白含量升高,如caspase-9及caspase-3[6]。

Figure 5. DCF staining for mitochondrial reactive oxygen species (ROS) in the neurons of normoxia and hypoxia groups (×400).
图5 通过DCFH-DA检测常氧和缺氧下线粒体内ROS的生成
表2 HIE组和正常大鼠神经元中线粒体相对DCF荧光强度、超氧化物水平及MMP测定
Table 2. Quantification of DCF-positive neurons, mitochondrial superoxide and mitochondrial membrane potential (MMP) in the rat neurons of each group (Mean±SD.n=15)

GroupRelative DCF Superoxide (%)MMP (%)Sham1.00100.00100.00HIE1.98±0.21** 200.60±5.56**69.47±3.62 **
**P<0.01vssham group
自噬是一种针对出现不利条件时(如生长因子减少、营养缺乏、缺氧和其他损伤性刺激)细胞的自我保护方式[7-8]。在脑创伤,退行性脑病如阿尔茨海默病中以及在脑组织缺氧/缺血或在氧化应激损伤时自噬常常被激活[9-10]。新生儿大脑通常比成人大脑更脆弱。与成年大脑相比,新生儿脑中有不同形式的细胞死亡[6]。在本研究中,我们探讨了缺氧缺血导致的大鼠脑细胞凋亡以及自噬现象。新生大鼠脑中观察到大量活化型caspase-3和在自噬体形成中起重要作用的LC3B-II蛋白表达,这意味着缺氧缺血可诱导大鼠脑细胞凋亡和自噬。体外实验结果证实上述结论。
线粒体功能障碍是神经退行性疾病中主要的由缺氧诱导的异常变化[11-12]。本实验中,缺氧缺血引起了大鼠神经元中线粒体功能障碍,相比于假手术组,缺氧组大鼠神经元内ROS增多,线粒体超氧化物上调以及线粒体膜电位水平下降。
脑缺氧缺血过程经常发生氧化应激反应,触发氧和氮激活,神经元中产生大量自由基和其他细胞毒性因子的释放。线粒体是细胞的能量发源地,产生ATP、调节细胞内Ca2+水平和ROS产生。线粒体氧化应激下出现ROS爆发,导致线粒体功能障碍,并最终诱导神经元凋亡。 ROS还可启动各种类型的细胞的自噬过程,包括在神经元中[13]。我们的研究表明缺氧诱导的大鼠神经元线粒体功能障碍和凋亡与自噬现象同时出现,因此,推测大鼠神经元的自噬及凋亡参与了诱导HIE过程中线粒体功能的障碍。
