IL-1、IL-10及TNF-β单核苷酸多态性与福建泉州地区汉族人群类风湿性关节炎的相关性研究*
2020-03-03张淑花杨会勇郑晨娜蔡志谋沈晓丽
张淑花, 杨会勇, 郑晨娜, 蔡志谋, 沈晓丽
(1福建省泉州市鲤城区江南街道社区卫生服务中心检验科, 2华侨大学生物医学学院, 3福建医科大学附属第二医院神经外科,福建 泉州 362000; 4福建医科大学省立临床医学院,福建省心血管病重点实验室, 福建 福州 350001)
风湿性关节炎(rheumatoid arthritis, RA)是一种自身免疫性疾病,其在我国的发病率约为0.4%[1]。RA免疫发病机制主要涉及多种免疫细胞及免疫分子之间的相互影响和相互作用[2],从本质上来说,RA的发生是由于体内免疫机制平衡被打破,从而导致一些炎症细胞因子如白细胞介素1(interlenkin-1, IL-1)、IL-10和肿瘤坏死因子β(tumor necrosis factor β, TNF-β)等的比例失衡。如果能够从分子生物学和遗传学角度进一步了解RA的发病机制,那将为RA等非可控炎症精准治疗方案的制定和特效药物的研制提供支持。
目前研究认为,单核苷酸多态性(single nudeotide polymorphism,SNP)多与复杂性疾病发病有很大相关性[3-4],其中遗传与环境因素是RA发生的主要原因,在不同地区的人群之间具有遗传差异性[5]。本研究以福建泉州地区汉族人群为研究对象,探讨IL-1β、IL-10及TNF-β等炎症相关因子5个SNP位点的分布特征,研究其与RA易感性的关系。由于当前研究多数关注单个SNP位点对RA发病的影响及相关分子机制[6],鉴于炎症相关因子多SNP位点可能存在着相互影响,本研究对RA炎症相关因子的多SNP位点进行连锁不平衡与单倍型联合分析,为RA的分子生物学发病机制及福建泉州地区汉族人群RA的基因遗传背景提供依据。
材 料 和 方 法
1 研究对象
RA组:自2014年6月~2016年6月期间,在福建泉州地区汉族人群中,于泉州正骨医院和江南医院门诊或住院部抽取155 例(女性107例,男性48例)、平均年龄(50.3±10.8)岁的RA患者(籍贯为泉州),所选样本个体均符合美国风湿病学会(ACR)和欧洲抗风湿联盟(RULAR)2009年最新RA诊断标准[7]。
健康对照(control)组:与RA组同时段、同地点抽取门诊健康体检者(籍贯为泉州)170 例(女性122例,男性48例),平均年龄(41.5±20.4)岁,血常规、血脂及其它生化指标均在参考范围内,心电图检查正常,排除肝脏、肾脏、内分泌和心脑血管疾病,无肿瘤病史和临床特征,无遗传疾病,无自身免疫性疾病和传染性疾病。该研究通过福建省泉州市正骨医院伦理委员会批准,且所有参与者均遵循“知情同意”原则。
2 方法
2.1外周血DNA提取 所有采集到的受试者EDTA、肝素或枸橼酸钠抗凝外周血5 mL,均预分装200 μL于1.5 mL离心管用于全血DNA的提取。利用全血DNA提取试剂盒(北京三博远志生物技术有限责任公司),按照产品说明书提取基因组DNA,并调整最终DNA浓度为50 mg/L,置4 ℃中保存。
2.2SNP位点选取 通过对炎症信号通路因子基因文献的查阅[8-9],选择了与RA相关的3个炎症细胞因子(IL-1β、TNF-β和IL-10)的5个SNP位点(IL-10rs1800893、IL-1β rs16944、IL-1β rs1143623、TNF-β rs2009658和TNF-β rs1041981),进行与RA易感性的相关性分析。
2.3基因型分析 用软件Primer 5.0分别设计本研究所需要的3条引物(具体序列见表1),其中特异性引物的3′-末端核苷酸分别与SNP野生型和突变型等位基因特异互补,用来鉴别SNP 2种等位基因;在此基础上设计1条可与此目标SNP所有等位基因特异性引物配对的公共引物,进行等位基因特异性PCR扩增检测。为提高扩增特异性,在引物3’端倒数第3个碱基引入1个错配碱基。以外周血基因组DNA为模板进行3引物扩增。琼脂糖凝胶电泳检测,对条带位置和数目进行基因型分析。
F: forward; R: reverse.
3 统计学处理
等位基因及基因型频率用基因计数法统计。基因型的Hardy-Weinberg平衡符合程度用2检验。组间基因型和等位基因频率用2检验或Fisher精确概率法检验。符合正态分布的计量资料用均数±标准差(mean±SD)表示,计数资料以例数及百分数(%)表示。两组计量资料比较采用独立样本t检验,计数资料的比较采用2检验。两个位点间的连锁不平衡分析,计算D′及r2,非条件Logistic回归模型分析类风湿性关节炎发病关联强度,计算比值比(odds ratio,OR)及其95%可信区间(95%CI)。SHEsis软件[10]进行单体型分析。以P<0.05为差异有统计学意义;以OR>1为与RA正相关。应用SPSS 19.0统计软件进行数据统计分析及两组样本间年龄、性别的校正。
结 果
1 三引物等位基因特异性扩增(TRIP-ASPCR)基因分型与测序
随机选取样本通过TRIP-ASPCR确定基因分型,同时利用1对外引物进行常规PCR扩增,PCR产物直接进行测序。测序结果与TRIP-ASPCR进行比对,结果显示TRIP-ASPCR的分型结果和测序分型结果完全一致,见图1。
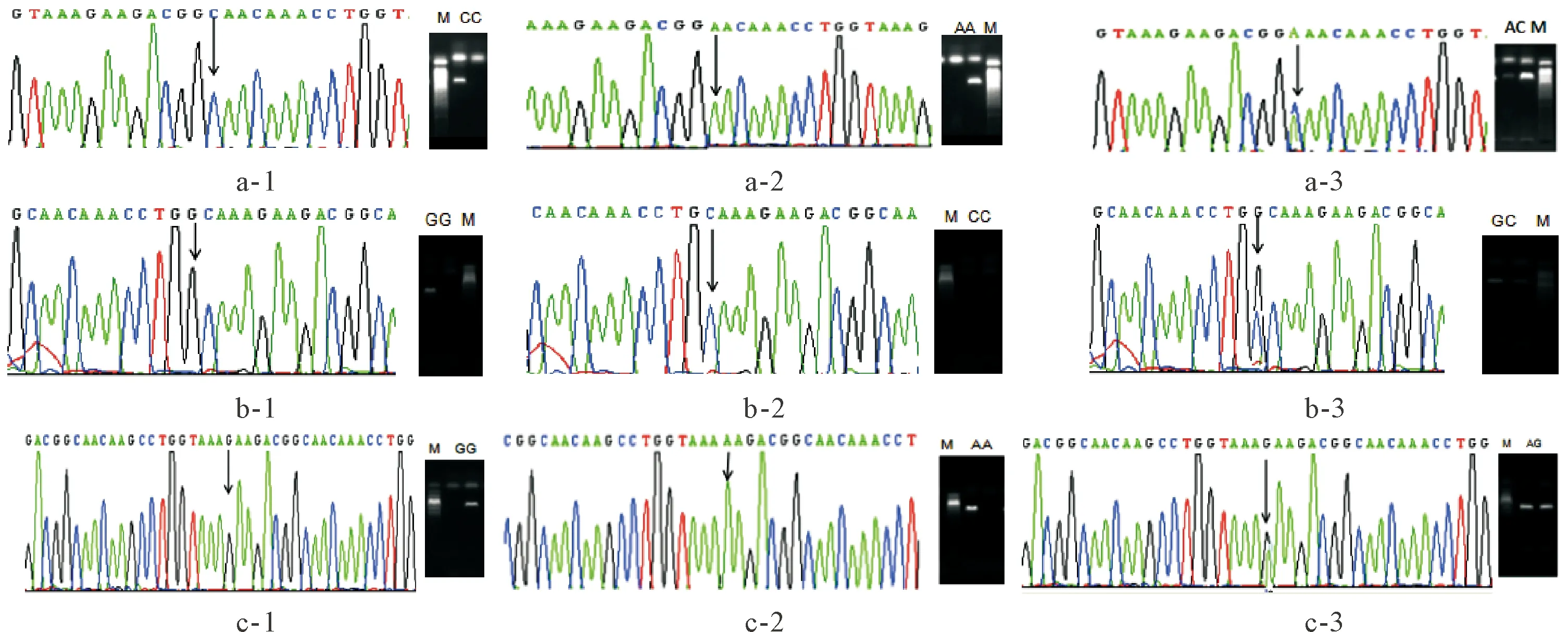
Figure 1. Genetypes of TNF-β, IL-10 and IL-1β loci. a-1: genotype CC of TNF-β (rs1041981); a-2: genotype AA of TNF-β (rs1041981); a-3: genotype AC of TNF-β (rs1041981); b-1: genotype GG of IL-10 (rs1800893); b-2: genotype CC of IL-10 (rs1800893); b-3: genotype GC of IL-10 (rs1800893); c-1: genotype GG of IL-1β (rs1143623); c-2: genotype AA of IL-1β (rs1143623); c-3: genotype AG of IL-1β (rs1143623).
图1 TNF-β、IL-10和IL-1β基因位点基因型
2 SNP位点基因型分布的Hardy-weinberg平衡检验
通过Hardy-Weinberg平衡检验探讨所选样本基因分型在福建泉州地区汉族人群的分布特征,本研究对5个SNPs位点的基因分型结果进行了Hardy-Weinberg平衡检验。分析结果显示,正常对照组TNF-β rs1041981的SNP位点符合Hardy-Weinberg平衡(P>0.05),RA组IL-10 rs1800893的SNP位点RA组符合Hardy-Weinberg平衡(P>0.05),抽取人群符合随机性原则,可认为具有群体代表性。
3 SNP位点基因型和等位基因频率分布及其发病关联强度分析
在Hardy-Weinberg平衡检测的基础上,开展5个SNP位点进行基因型和等位基因频率分布及其发病关联强度分析,计算其OR,OR>1说明疾病的危险度因暴露而增加,与疾病之间为“正”关联,OR<1说明疾病的危险度因暴露而减少,暴露与疾病之间为“负”关联,OR=1说明疾病与暴露无关联,见表2~3。
正常对照组与RA组rs1800893、rs16944、rs2009658和rs1041981位点的基因型分布频率和等位基因分布频率均存在显著差异(P<0.05)。(1)rs1800893基因位点的 AA、GA和GG 3种基因型在正常对照组的分布频率与RA组存在显著差异 (P<0.05);等位基因A和G在正常对照组的分布频率与RA组存在显著差异(P<0.05),携带G等位基因型的个体发生RA的相对风险是为携带A等位基因型的1.678倍(P=0.005,OR=1.678,95%CI为1.167~2.412)。(2)rs16944基因位点的GG、GT和TT 3种基因型在正常对照组的分布频率与RA组存在显著差异 (P<0.05);等位基因G和T在正常对照组的分布频率与RA组亦存在显著差异 (P<0.05),携带G等位基因型的个体发生RA的相对风险是为携带T等位基因型的1.418倍(P=0.030, OR=1.418, 95%CI为1.030~1.953)。(3)rs2009658基因位点的CC、CG和GG 3种基因型在正常对照组的分布频率与RA组具有显著统计学差异(P<0.05);等位基因C和G在正常对照组的分布频率与RA组亦具有显著统计学差异(P<0.05),携带C等位基因型的个体发生RA的相对风险是为携带G等位基因型的10.67倍(P=0.000, OR=10.670, 95%CI为4.198~27.164)。(4)rs1041981基因位点的CC、CA和AA 3种基因型在正常对照组的分布频率与RA组具有统计学差异(P<0.05);等位基因C和A在正常对照组的分布频率分与RA组亦具有统计学差异(P<0.05),携带C等位基因型的个体发生RA的相对风险是为携带A等位基因型的1.533倍(P=0.015, OR=1.533, 95%CI为1.084-2.168)。
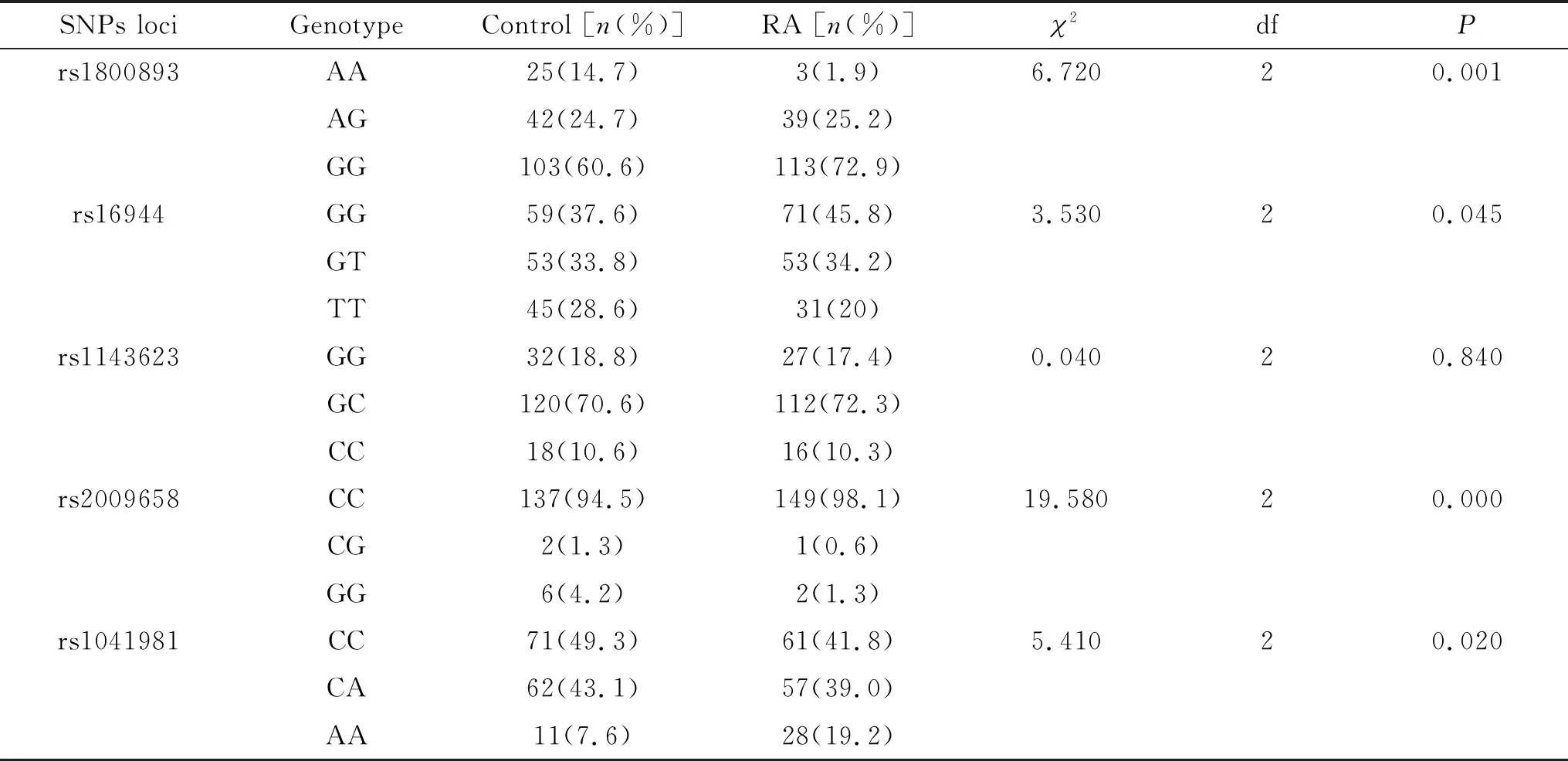
表2 两组各SNPs多态性位点的基因型频率分布
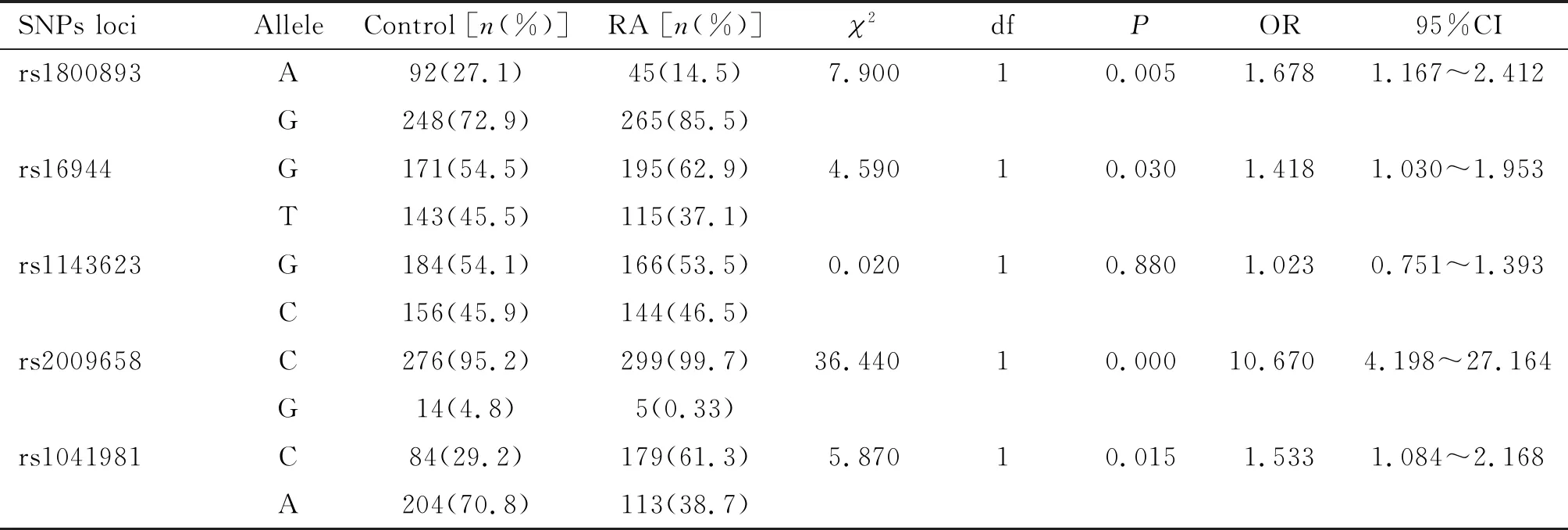
表3 两组各SNPs多态性位点的等位基因频率分布
4 SNP位点的连锁不平衡检验
IL-1β rs16944和IL-1β rs1143623位点间不存在连锁不平衡(D′=0.121,r2=0.009);TNF-β rs2009658和TNF-β rs1041981位点间不存在连锁不平衡(D′=0.465,r2=0.003)。
5 SNP位点的单倍型分析
IL-1β rs16944和IL-1β rs1143623 位点组成的单倍型G-G、G-C、A-G、A-C在对照组和RA组的分布均不存在显著差异(P>0.05),见表4。
TNF-β rs2009658和TNF-β rs1041981 2个SNP位点组成的单倍型为C-C、C-G、A-C、A-G,其中A-C单倍型在对照组和RA组的分布存在差异(P<0.05),其余单倍型均不存在差异,A-C与RA呈正相关,且相关性明显,携带A-C单倍型的个体罹患RA的风险显著增加(OR=1.443),见表4。
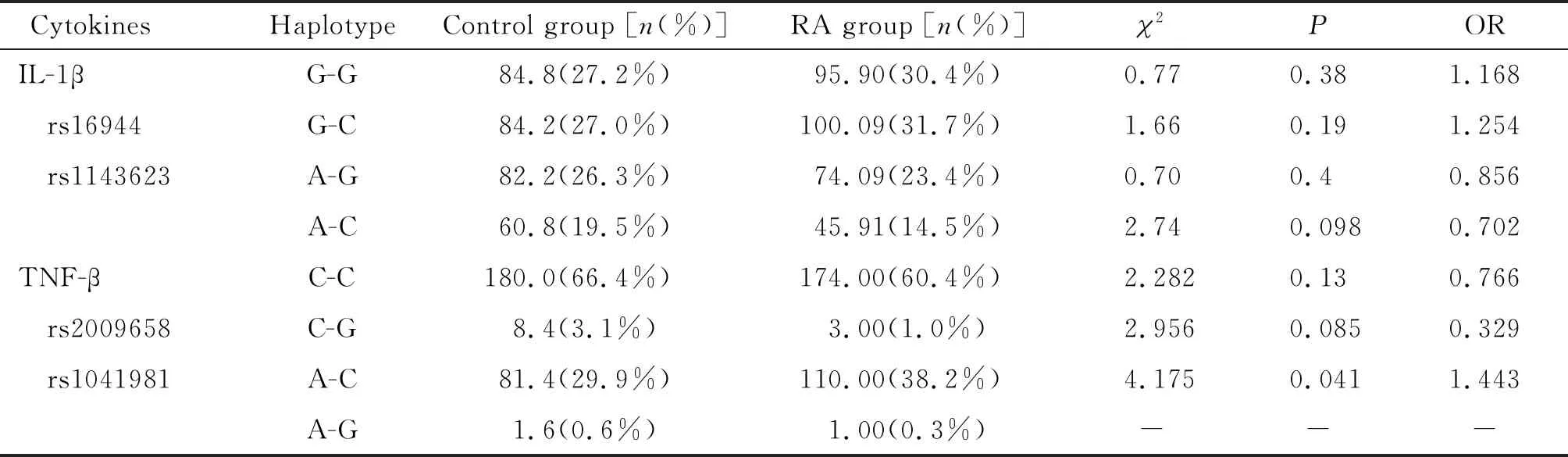
表4 多位点单倍型分析
讨 论
RA是一种自身免疫性疾病,患者关节等部位受到炎症持续侵蚀,现有治疗手段仍无法彻底治愈。炎症相关因子上的单核苷酸多态性可能与非可控炎症的发生、发展有着密切的关系。
IL-1是体内最主要的炎症介质之一,能够介导多种炎症反应。越来越多的研究已经证实IL-1在RA发病的过程中具有非常重要的作用[11-12]。在RA病人的血液和关节滑膜液中均可以检测到IL-1的表达升高,这就提示了IL-1与RA的关联[13]。近年来研究发现IL-1存在多态现象,已有资料显示IL-1基因多态性在决定RA的预后上起重要作用[14]。宋新强等[15]研究发现IL-1β+3954位点与豫南汉族人群的RA发病风险关系密切,但关于IL-1β等SNP位点在福建泉州地区汉族人群与RA的相关性研究仍未见报道。而在2012年Lee等[16]进行的荟萃分析中表明IL-10-1082G/A,IL-10-892C/T,IL-10-592C/A基因多态性与RA的易感性存在关联,可见IL-10的SNP多态性与RA的遗传易感性有关联。
TNF-β是一种促炎因子,尽管目前对于TNF基因是否和RA易感性相关联仍然存在争议,但其表型在RA的发病机理和预后中扮演重要角色已得到肯定[17]。RA病人血液和滑膜液中TNF-β水平升高[18],而关于TNF促进炎症反应进程的广泛研究为TNF阻滞剂治疗RA奠定了基础,然而并不是所有的RA患者均能获得良好的疗效[19-21]。Kang等[22]研究表明,拥有TNF-857C/T SNP位点T基因型等位基因的患者对于依那西普的反应要比C基因型等位基因的纯合子患者要好,如果这些结论能够得到进一步证明,TNF-857C/T SNP将成为预测疗效的一个有效遗传标记。本研究通过探讨TNF-β rs2009658和TNF-β rs1041981与福建泉州地区汉族人群RA的相关性,以获得福建泉州地区汉族人群的遗传学数据,为研究RA的基因遗传背景提供理论依据和分子生物学基础资料。
本研究发现,IL-10 rs1800893、IL-1β rs16944、TNF-β rs2009658和TNF-β rs1041981等4个SNP位点的等位基因频率在对照组和RA组间的分布差异存在统计学意义,与RA相关性明显,且呈正相关;其各位点分别对应的等位基因G、G、C和C可能作为福建泉州地区汉族人群RA的一个潜在遗传标志。
