靶向PD-1 的多肽阻断剂的设计及评价
2020-03-03全丽娜刁妍妍李文杰朱丽丽李洪林
全丽娜, 刁妍妍, 李 巧, 李文杰, 朱丽丽, 李洪林
(华东理工大学药学院,上海市新药设计重点实验室,上海 200237)
癌症是威胁人类身体健康的重要疾病之一,目前由于癌症的治愈率极低,因此癌症被人们称之为“绝症”。根据癌症的类型、生长位置以及发病程度,癌症的治疗方法分为很多种,包括手术切除、放射疗法、化学疗法和靶向治疗[1],但这些治疗方法均具有一定的局限性。免疫疗法于1997 年第一次用于治疗癌症,现已成为科学家们重要的研究方向[2]。在各种免疫治疗的方法中,免疫检查点疗法近几年来取得了显著疗效。
程序性死亡受体1(Programmed Death 1,PD-1)是目前研究相对成熟的免疫检查点之一[3]。PD-1,又名CD279,是CD28 家族中的一个负性协同刺激分子受体,是由288 个氨基酸组成的免疫球蛋白超家族I 型跨膜糖蛋白[4]。它有两个内源性配体,分别为PD-L1 和PD-L2。PD-1 与PD-L1 或PD-L2 结合,可以激活其在T 细胞内的抑制信号通路,传递负性共抑制信号给T 细胞,影响T 细胞相关基因表达,干扰细胞增殖、活化,甚至诱导T 细胞凋亡,最终造成肿瘤细胞的免疫逃逸[5]。PD-1/PD-L1 通路形成的抑制信号具有可逆性,利用药物阻断PD-1/PD-L1 通路可以重新激活衰竭的T 细胞,通过肿瘤浸润T 淋巴细胞杀伤肿瘤细胞,逆转肿瘤诱导免疫抑制效应,因此针对该通路的免疫治疗具有理论可行性[6]。目前,已有多种阻断PD-1/PD-L1 相互作用的单克隆抗体应用于肿瘤治疗和临床试验,并且呈现出显著的疗效,如靶向于PD-1 的抗体Pembrolizumab 和Nivolumab,靶向于PD-L1 的抗体Atezolizumab、Durvalumab 和Avelumab 均逐渐被获批应用于各种实体瘤的临床治疗[7]。但是单克隆抗体药物具有生产成本较高、稳定性低、存在一定的免疫原性等缺点,这使得抗体药物的应用受到了极大的限制。
斯坦福大学医学院Ring 课题组于2015 年发表的一篇文章表明低分子量的非抗体类药物可用于PD-1/PD-L1 介导的免疫治疗和诊断[8]。郑州大学高艳锋课题组利用噬菌体展示的方法筛选得到了一种靶向PD-L1 的不易水解的D 型多肽阻断剂,并验证了该多肽阻断剂可以阻断PD-1/PD-L1 相互作用[9]。中科院纳米技术与纳米仿生研究所朱毅敏研究团队首次利用细菌表面展示方法筛选得到了靶向于PDL1 的多肽阻断剂TPP-1,验证其具有阻断PD-1/PDL1 信号通路和抑制肿瘤细胞生长的作用[10]。多肽阻断剂具有开发生产成本低、稳定性好、较高的组织和肿瘤渗透性等优点,但目前鲜见靶向于PD-1 的多肽阻断剂进入临床。因此,研究靶向于PD-1 的多肽类阻断剂具有很好的前景。
基于上述理论支持及实践经验,我们课题组也致力于开发靶向PD-1/PD-L1 免疫检查点的多肽阻断剂。前期我们利用从头设计多肽的方法设计了一系列靶向于PD-1 的多肽阻断剂[11],其中多肽Ar5Y_4与PD-1 的结合亲和力(KD)值为1.38 μmol/L。本文在多肽Ar5Y_4 的基础上截去其C 末端5 个氨基酸,得到结合亲和力更高的多肽阻断剂P5-1,并分析其阻断PD-1/PD-L1 结合能力,评价其对T 细胞分泌IL-2水平的影响。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株与细胞 PD-1 基因购于北京义翘神州科技有限公司(货号:HG10377-M),载体pET28a、感受态菌株E.coli DH5α 与菌株E.coli BL21(DE3)均由实验室保存。质粒pET28a-PD-1(34-150)由本实验室构建[11]。Jurkat 细胞和BxPC-3 细胞来源于美国菌种保藏中心(ATCC)。
1.1.2 试剂 DNA marker 购买于北京全式金生物技术有限公司;氨基偶联试剂盒、醋酸钠(pH 4.5)缓冲液和CM5 芯片购买于GE Healthcare 公司;植物血凝素(PHA)、丙二醇甲醚醋酸酯(PMA)购买于Sigma公司;阻断型抗PD-1 单克隆抗体(货号:16-9989)与人IL-2 ELISA 检测试剂盒(货号:BMS221/2)购买于eBioscience 公司;PD-L1 蛋白(货号:10084-H08H)购买于北京义翘神州科技有限公司。
1.2 实验方法
1.2.1 靶向于PD-1 多肽阻断剂的设计及优化 前期我们利用计算机从头设计多肽的方法设计了一系列靶向于PD-1 的多肽阻断剂[11],利用Rosetta 的Interface Analyzer 模块进行打分得到多肽Ar5Y_4,其氨基酸序列为GNWDYNSQRAQLYNQ。Ar5Y_4 与PD-1的结合模式如图1 所示,从图中可知,Ar5Y_4 上的氨基酸残基与PD-1 蛋白形成一定的相互作用,分别为:盐桥(D4-K78、R9-E136),氢键作用(W3-K78、W3-E84、Y5-E136、R9-Y68、R9-E136)和疏水相互作用( Y5-Y68、 Y5-I126、 Y5-I134、 Y5-E136、 Y13-A132、Y13-I134)。从该结合模式的分析结果可得,Ar5Y_4 与PD-1 之间的结合亲和力大部分由W3、D4、Y5 和R9 4 个关键锚点(anchor)残基提供。另外,Ar5Y_4上C 末端的5 个氨基酸形成α 螺旋并且处于结合位点外面,可能该部分序列不利于Ar5Y_4和PD-1 的结合。本文将Ar5Y_4 C 末端的5 个氨基酸截去以获得多肽P5-1,其序列为GNWDYNSQRA,希望多肽P5-1 既能保留与PD-1 的结合能力,又可避免与PD-1 结合时产生的位阻效应。

图 1 多肽Ar5Y_4 与PD-1 的预测结合模式[11]Fig. 1 Predicted binding mode of peptide Ar5Y_4 with PD-1
1.2.2 PD-1 重组质粒的构建、表达与纯化 文献[12]报道,将PD-1 的34~150 位氨基酸克隆于pET-28a载体中,并将第73 位半胱氨酸突变成丝氨酸,目的是增加PD-1 蛋白的表达量。选取克隆构建成功的重组质粒,将其转化到表达宿主菌E.coli BL21(DE3)感受态细胞中进行PD-1 蛋白表达。在菌体吸光度值(OD 值)达到0.6 时,向TB(Terrific Broth)培养基中加入0.5 mmol/L 异丙基-β-D-硫代半乳糖苷(IPTG)诱导剂,并在37 ℃下诱导培养5~7 h。诱导后的大肠杆菌菌体收集后经高压破碎,离心后取沉淀,此时PD-1 重组蛋白以包涵体形式存在于沉淀中。先用含有低浓度尿素的缓冲液(20 mmol/L Tris-HCl,2 mol/L尿素,φ 为2.5%Triton X-100,pH 8.0)洗去沉淀中大部分的杂蛋白,再用含有高浓度尿素的缓冲液(20 mmol/L Tris-HCl,8 mol/L 尿素,pH 8.0)在室温下溶解沉淀中的PD-1 蛋白。将PD-1 蛋白浓缩后加入复性缓冲液(50 mmol/L Tris-HCl,50 mmol/L L-Arg(L-Arginine),24 mmol/L NaCl,1 mmol/L KCl,1 mmol/L EDTA,pH 8.0)中,用稀释法于4 ℃下复性24 h。将复性后的PD-1 蛋白浓缩,并且在透析缓冲液(50 mmol/L Tris-HCl,50 mmol/L NaCl,1 mmol/L 二硫苏糖醇(DTT),pH7.7)中透析过夜。然后将复性后的PD-1 蛋白进行柱层析纯化,分别使用阳离子交换层析(HiTrapTMSP FF)及凝胶过滤层析(Superdex 75 10/300)对PD-1 蛋白进行纯化。最后通过十二烷基磺酸钠-聚丙酰胺凝胶电泳(SDS-PAGE 电泳)检测纯化后PD-1 蛋白的纯度。
1.2.3 多肽P5-1 与PD-1 蛋白结合亲和力的测定 本文运用表面等离子体共振(Surface Plasmon Resonance,SPR)技术测定多肽P5-1 与PD-1 蛋白之间的结合亲和力,实验在BIAcore T200 仪器(GE Healthcare)上进行。首先将纯化后的PD-1 蛋白用pH 4.5 的醋酸钠溶液稀释至50 μg/mL,再用偶联试剂1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)将PD-1 蛋白偶联在CM5 芯片上,流速为10 μL/min,结合时间为600 s,最后用乙醇胺封闭,最终PD-1 的偶联量约为4 000 RU。偶联完成后,利用运行缓冲液(10 mmol/L 磷酸盐缓冲液, 2.7 mmol/L KCl, 137 mmol/L NaCl 和φ 为0.005%表面活性剂P20, pH 7.4)冲洗芯片表面直至基线平稳,之后将多肽P5-1 用运行缓冲液溶解,并将其稀释成一系列浓度梯度(0、0.05、0.1、0.2、0.4、0.8、1.6、3.2 μmol/L),将配制好的多肽以30 μL/min 的流速结合芯片上的蛋白90 s,解离120 s。实验结果利用BIAcore T200 Evaluation 1.0 软件进行稳态拟合。
1.2.4 多肽P5-1 的竞争性结合实验 利用表面离子体共振(SPR)设计竞争性实验,用于证明多肽P5-1 在结合PD-1 的同时可以阻断PD-1 与PD-L1 的相互作用。首先将购买的PD-L1 蛋白冻干粉用超纯水溶解并稀释至1 mg/mL,然后用pH 4.5 的醋酸钠溶液将PD-L1 蛋白稀释至50 μg/mL,利用氨基偶联的方法偶联至CM5 芯片上,最终PD-L1 的偶联量约为4 000 RU。用运行缓冲液冲洗芯片至基线平衡。将不同浓度的多肽P5-1(3.125, 0.780, 0.195, 0.045,0 μmol/L)与1 μmol/L PD-1 蛋 白 在 冰 上 混 合 孵 育30 min。多肽P5-1 与蛋白混合物随运行缓冲液(10 mmol/L 磷酸盐缓冲液, 2.7 mmol/L KCl, 137 mmol/L NaCl 和φ 为0.05%表面活性剂P20, pH 7.4)流经芯片表面,流速为30 μL/min,结合时间90 s,解离时间120 s。运用BIAcore T200 Evaluation 1.0 软件分析实验结果。
1.2.5 ELISA 法检测T 细胞中IL-2 的分泌水平 首先用500 U/mL 干扰素γ(IFN-γ)刺激BxPC-3 细胞48 h,目的是为了提高PD-L1 的表达[13]。然后在传代的Jurkat T 细胞中加入2 μg/mL PHA 和20 ng/mL PMA共同刺激细胞4 h,用以激活Jurkat T 细胞[14]。换液除去Jurkat 培养液中的PHA 和PMA,以免影响细胞生长。将刺激过后的BxPC-3 细胞与激活的Jurkat 细胞以3∶1 的个数比在96 孔板中进行共培养,Jurkat细胞单独培养作为对照。以阻断型抗PD-1 单克隆抗体作为阳性对照,以D-hank’s 溶液作为阴性对照,实验组加入50 μmol/L 多肽阻断剂,在二氧化碳细胞培养箱中孵育48 h。收集上清培养基,离心后取上清,用ELISA 试剂盒检测Jurkat 分泌于培养基中IL-2 的量。用不同浓度的IL-2 标准品绘制标准曲线,再由标准曲线得出样品中IL-2 的总量。该实验设置3 次平行实验。
2 结果与讨论
2.1 高纯度的PD-1 重组蛋白的获得
利用大肠杆菌系统表达PD-1 蛋白,通过包涵体变复性后获得可溶性的蛋白,然后利用阳离子交换层析及凝胶过滤层析进行纯化。纯化后收集的PD-1 蛋白用SDS-PAGE 分析纯度,如图2 所示。由图可见,PD-1 蛋白条带位于10~15 ku,与PD-1 蛋白的理论分子量(约13 ku)相符,并且从电泳图上可以看出,组分1 杂蛋白较多,组分2 和组分3 蛋白纯度较高。收集组分2 和组分3 的样品用于后续实验。
2.2 多肽P5-1 靶向结合PD-1 蛋白
本课题组在多肽Ar5Y_4 的基础上进行优化得到多肽P5-1,其氨基酸序列为GNWDYNSQRA。运用SPR 测定多肽P5-1 与PD-1 的KD值均为0.21 μmol/L(图3),比PD-1/PD-L1 的KD值(1.15 μmol/L)高[15],因此P5-1 有望阻断PD-1 与PD-L1 的相互作用。
2.3 多肽P5-1 竞争性阻断PD-1 与PD-L1 的结合
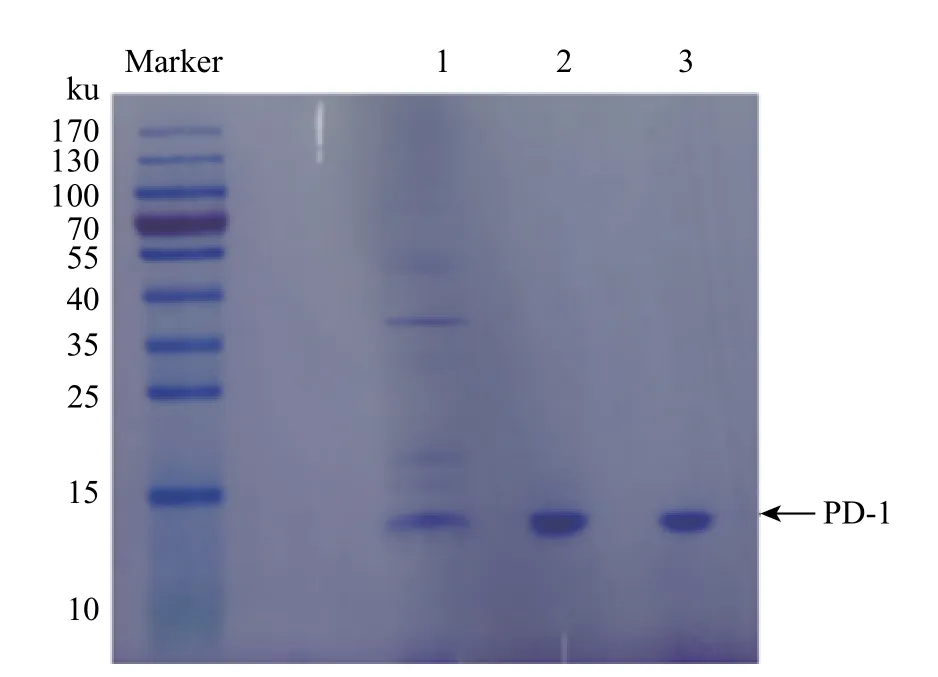
图 2 经凝胶过滤层析纯化后的PD-1 的SDS-PAGE 凝胶电泳图Fig. 2 SDS-PAGE analysis of purified PD-1 after size exclusion chromatography

图 3 多肽P5-1 与PD-1 结合的SPR 图Fig. 3 Binding analysis of peptide P5-1 with PD-1 by SPR
由上述SPR 实验测得的多肽P5-1 与PD-1 之间的结合亲和力可知,多肽P5-1 不仅可以结合PD-1,并且具有亚摩尔级别的结合亲和力。为了探究多肽P5-1 与PD-1 结合的同时是否可以阻断PD-1 与PD-L1的相互作用,我们又设计了基于SPR 的竞争性实验,结果如图4 所示,随着多肽P5-1 浓度的增加,PD-1 与P5-1 的结合增加,游离的PD-1 浓度降低,从而使结合在PD-L1 上的PD-1 蛋白减少,最终导致响应值降低。因此,从该实验结果可以表明,多肽P5-1 在分子水平上不仅可以结合PD-1,同时还可以阻断PD-1与PD-L1 的结合。
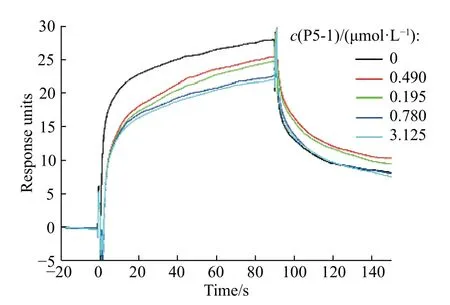
图 4 多肽P5-1 与PD-L1 竞争性结合PD-1 的SPR 实验结果Fig. 4 SPR for peptide P5-1 and PD-1 with competitive binding assay
2.4 多肽P5-1 可恢复衰竭的Jurkat T 细胞分泌IL-2 的水平
当T 细胞上表达的PD-1 与肿瘤细胞上表达的PD-L1 通路形成后,会产生一种共抑制信号负性调控T 细胞的功能。细胞因子的产生是评价T 细胞功能的一个显著的标志,而IL-2 与T 细胞的增殖和活化相关,因此我们在肿瘤细胞与T 细胞共培养体系中检测T 细胞分泌细胞因子IL-2 的水平来评价T 细胞的功能,结果如图5 所示。当激活后的Jurkat T 细胞与肿瘤细胞BxPC-3 共培养后,Jurkat 产生IL-2 的量明显下降,约比原始值(第1 列)下降40%。因此,该结果表明,在共培养体系中,Jurkat 表面的PD-1 可以与BxPC-3 表面的PD-L1 相互作用,并且抑制T 细胞的活化,表现为Jurkat 分泌IL-2 的能力下降。而当加入多肽P5-1 后,Jurkat 分泌的IL-2 明显增加,增加的量约为Jurkat T 细胞与BxPC-3 细胞共培养时分泌量(第2 列)的30%。本实验将阻断型抗PD-1 单克隆抗体(mAb)作为阳性对照(第4 列),加入阳性抗体后可以部分恢复Jurkat 分泌IL-2 的能力。该实验结果说明多肽P5-1 可恢复衰竭的Jurkat T 细胞分泌IL-2 的水平。
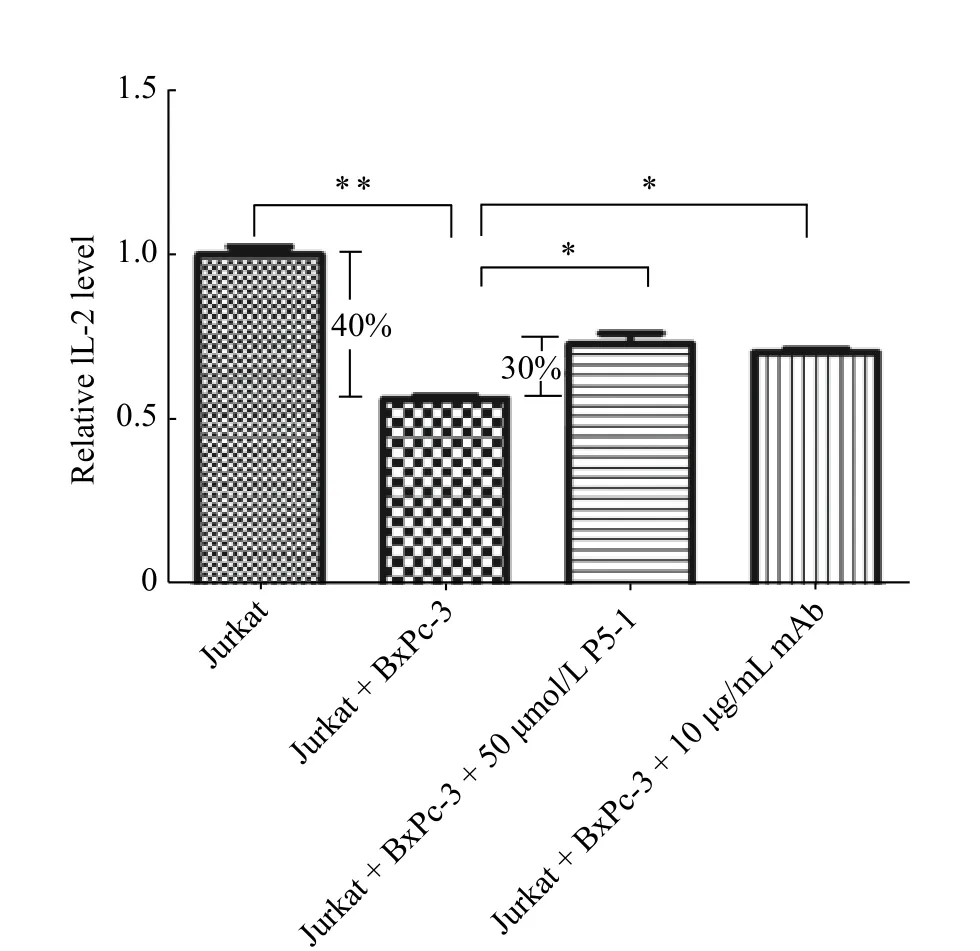
图 5 ELISA 法测定Jurkat 分泌IL-2 的水平Fig. 5 Measurements of IL-2 secretion in Jurkat cells by ELISA
3 结 论
本文利用大肠杆菌表达系统,重组表达了PD-1胞外区蛋白,并且纯化得到纯度较高的PD-1 蛋白。我们通过从头设计多肽的方法设计靶向于PD-1的多肽阻断剂,在前期多肽Ar5Y_4 的基础上,截去C 末端5 个氨基酸得到多肽P5-1,并测得其与PD-1 的结合亲和力为0.21 μmol/L,之后通过SPR 竞争性实验证明多肽P5-1 可以阻断PD-1 与PD-L1 的结合。在肿瘤细胞BxPC-3 与T 细胞Jurkat 共培养体系中,我们发现多肽P5-1 可以恢复Jurkat 分泌IL-2 的能力。多肽P5-1 是在多肽Ar5Y_4 的基础上截去C 末端5 个氨基酸得到的,其结合亲和力比多肽Ar5Y_4 高(多肽Ar5Y_4 与PD-1 的结合亲和力为1.38 μmol/L)。分析原因如下:截去Ar5Y_4 的C 末端的5 个氨基酸而保留大部分的功能氨基酸,既可保证多肽与PD-1 形成相互作用,又可减少多肽与PD-1结合时产生的位阻效应,从而提高了多肽与PD-1 的结合亲和力。本文为后续开发靶向于PD-1 的多肽阻断剂奠定了基础,并为靶向于PD-1 的抗肿瘤研究提供多肽候选药物。
