气体信号分子硫化氢在肿瘤发生发展与治疗中的作用研究进展
2020-03-02叶洋叶芬李雪周建伟许文荣陆荣柱
叶洋,叶芬,李雪,周建伟,许文荣,陆荣柱
(1.江苏大学医学院,江苏 镇江 212013;2.南京医科大学公共卫生学院,江苏 南京 210029)
近年来,我国恶性肿瘤的发病率不断上升,防治形势严峻[1]。硫化氢(Hydrogen sulfide,H2S)通常被认为是一种有臭鸡蛋气味的环境污染物,然而随着近年来研究的不断深入, H2S被发现作为一种内源性气体分子,对机体具有广泛的生理药理学效应,但其与肿瘤的关系一直缺乏明确的结论。最近的研究表明,结肠癌、卵巢癌、乳腺癌等恶性肿瘤中H2S生成酶胱硫醚-β-合酶(cystathionine-β-synthase,CBS)、胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)的表达增加,在这些癌症中应用CBS或CSE药理学抑制剂或基因沉默可在体外抑制癌细胞生物能量代谢,抑制体内肿瘤生长和转移,增强一线化疗药物的抗肿瘤作用,同时也有研究发现内源性H2S水平较低时主要表现为促癌作用,而暴露于H2S水平较高(多由外源添加产生)或较长时间则更可能表现为抑癌效应[2],为此“钟形模型”或低、高浓度的“双相作用”模型可进一步阐明H2S在肿瘤发展中的作用[3]。本文就H2S在肿瘤发生发展与治疗中的研究状况进行相应分析,为以靶向调控H2S的药物应用于临床肿瘤治疗,开展基于H2S的肿瘤防治策略提供重要依据。
1 H2S的代谢及其调控
H2S具有极强的脂溶性,可自由穿过细胞膜。H2S广泛存在于人体各个部位,具有多种生成转化方式[4]。其中在细胞质内主要通过CBS和CSE以L-半胱氨酸为底物催化产生;在线粒体中,主要通过巯基丙酮酸转硫酶(3-mercaptopyruvate sulfuransferase,3-MPST)以巯基丙酮酸为底物催化产生H2S[5](图1)。其中CBS 和CSE是依赖于5’-磷酸吡哆醛(PLP)的,同时也是催化产生H2S的主要途径,因而调节CBS和CSE这两种酶活性可直接影响H2S的生成量。前者主要分布在中枢神经系统中,后者则主要分布于外周器官如心血管系统[6],同时在肝、肾、胰和胃肠道等组织中这三种酶的含量也很丰富,在这些组织的肿瘤组织中,这三种酶的表达都有相对应的升高趋势[7]。机体中的H2S主要以硫氢根离子(HS-)、二价硫离子(S2-)的形式存在,只有1/3 H2S以分子形式存在。此外H2S 与硫氢化钠(NaHS)在体内维持着动态平衡,在体内NaHS可解离为钠离子和HS-离子,后者与体内氢离子结合后生成H2S。
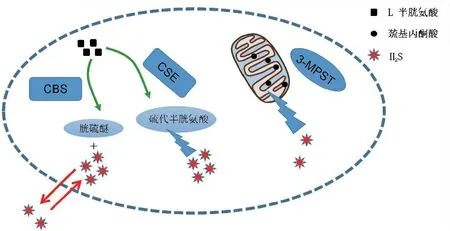
图1 H2S产生的3条经典途径
H2S在体内含量很低,但可对机体的心血管、消化、神经、呼吸等多系统产生广泛影响,同时也调控各大系统恶性肿瘤的发生发展[8]。随着H2S与肿瘤的研究日益深入,越来越多的H2S供体被投入到肿瘤研究中,如NaHS、S-炔丙基半胱氨酸(SPRC)、N-乙酰半胱氨酸(NAC)、透明质酸与5-(4-羟基苯基)-3H-1,2-二硫醇-3-硫酮产生的共轭物(HA-ADT)、GYY4137等[9]。
2 H2S在肿瘤中的作用及其机制
2.1 H2S与乳腺癌
相对于正常乳腺细胞MCF-10A,乳腺癌细胞MCF-7和MDA-MB-231的CSE有较高水平的表达。CSE启动子可与STAT3直接结合,从而使CSE转录被激活,促进乳腺癌内源性H2S生成[10]。药理学抑制(DL-炔丙基甘氨酸PAG)和基因学干预(CSE siRNA)下调CSE的表达在抑制乳腺癌细胞内源性H2S生成的同时,也可显著抑制乳腺癌细胞系的增殖和迁移能力、促进其凋亡。同时CBS在乳腺癌细胞中高表达,也是肿瘤细胞来源H2S的主要供体生成途径之一,可促进乳腺癌的发展,此外,H2S的释放能明显抑制乳腺癌细胞的凋亡[11]。
不同浓度的H2S在乳腺癌细胞中显现了相反的效应,即在低浓度H2S(供给NaHS<200 μmol/L)作用下,主要表现为促进乳腺癌生长、迁移;而在较高浓度H2S(供给NaHS>1 000 μmol/L)影响下,则表现出明显的抑癌作用。为了明确不同浓度H2S对乳腺癌发生发展的影响,有研究应用了NaHS(20~2000 μmol/L)作为H2S供体,通过对细胞周期调节蛋白等的检测,显示高剂量和持续暴露H2S(72 h)对三阴性乳腺癌细胞增殖具有明显的抑制作用,同时,较高水平的NaHS(>200 μmol/L)可以抑制细胞内黏附分子ICAM-1从而抑制三阴性乳腺癌的侵袭能力。此外,在一定程度上激活CSE/H2S途径可降低p-p38的表达,抑制乳腺癌细胞的侵袭和上皮间充质转化[12]。另外,相同作用条件下(200 μmol/L,48 h),透明质酸共轭物HA-ADT作为新研发的H2S供体,在MCF-10A, MCF-7和MDA-MB-231细胞中能释放比NaHS和 GYY4137高1.5~3倍的H2S,HA-ADT主要通过抑制PI3K/mTOR和Ras/ERK信号通路从而抑制人乳腺癌细胞的生长[13]。
在裸鼠实验中,H2S在乳腺癌细胞中的作用与细胞模型一致,在人乳腺癌细胞MDA-MB-231异种移植瘤的动物实验中,较低剂量的NaHS供给H2S可促进瘤体生长,而高剂量NaHS则抑制了瘤体的大小及重量[14]。此外,透明质酸共轭物HA-ADT能稳定释放大量H2S气体,在成瘤小鼠体内每天皮下注射200 μmol/L HA-ADT 14 d后可通过抑制PI3K/ERK通路在乳腺癌移植瘤裸鼠模型中明显抑制肿瘤生长和血管生成[13]。
2.2 H2S与甲状腺癌
研究发现NaHS在25~50 μmol/L浓度区间处理24~48 h可促进人甲状腺癌细胞的增殖、存活、迁移及侵袭。在甲状腺癌中H2S主要通过ROS/PI3K/mTOR和RAS/ERK等信号通路影响肿瘤细胞的发生发展[15]。相对于正常非肿瘤组织,CBS蛋白在几种不同的人类恶性肿瘤中都有较高表达,其中在人甲状腺癌细胞中过表达的主要是CBS,且与肿瘤分期、转移和化疗耐药等参数相关的蛋白表达增加[16]。H2S作为血管松弛剂可以舒张血管,可增大肿瘤细胞附近血流量,促进增殖和迁移,采用药理学抑制[氨基氧乙酸(AOAA)]或基因学抑制(CBS siRNA)下调CBS,可以减少内源性H2S的产生,从而抑制肿瘤细胞的增殖、迁移,并促进肿瘤细胞凋亡。同时沉默CBS基因可以减少细胞线粒体的呼吸作用,抑制ATP的合成,热量限制导致能量供应不足从而使机体新陈代谢等降低,进而抑制肿瘤的形成。
相反的,在200 μmol/L 的高浓度NaHS作用后,ROS水平反而明显升高,p-PI3K、p-AKT、p-mTOR、p-ERK1/2等蛋白水平明显下调,进而使甲状腺癌细胞的增殖、迁移及侵袭被明显抑制[16]。说明在人甲状腺癌细胞中,呈现低浓度H2S能明显促进人甲状腺癌细胞增殖、迁移,外源性H2S供体提供高浓度H2S后则反向抑制人甲状腺癌细胞增殖、侵袭等。
同时,在人甲状腺癌移植瘤的裸鼠实验中,用不同浓度的NaHS瘤周皮下给药4周,发现较低剂量组NaHS[1.4~2.8 mg·(kg·d)-1]对肿瘤生长和血管形成有促进作用。此外,在人甲状腺癌TPC-1、TT和ARO细胞异种移植瘤的动物实验中,以瘤体的Ki67和CD31等为指标,发现高剂量组NaHS[11.2 mg·(kg·d)-1]可明显抑制肿瘤生长和血管生成[15]。
2.3 H2S与结直肠癌
结直肠癌是消化道恶性肿瘤之一,H2S在结直肠癌中的作用机制较复杂,因H2S可由肠道细胞和肠道细菌生物同时合成,故可在大肠中达到较高水平[17]。将患者结肠癌标本与相匹配的正常黏膜组织进行比较后发现CBS选择性升高,其产物H2S在结直肠癌细胞中也明显上调,它们在肿瘤的生长和进展中起重要作用[18-19]。随后,在结肠癌细胞株(HCT-116, HT-29, LoVo)中也发现CBS 呈选择性上调。NCM 356细胞中CBS的上调可诱导转录组的广泛变化,代谢组学分析提示高表达CBS激活了磷酸戊糖和糖酵解途径,通过NF-κB、KRAS、p53和Wnt等信号的调控,促进细胞增殖、迁移、侵袭,显示CBS/H2S轴的激活促进了结肠癌的发生发展,并且这种作用能被CBS的特异性抑制剂AOAA所抑制[20]。
相反的,也有研究表明在大肠癌细胞株CaCO2中,使用H2S供体100 μmol/L GYY4137处理细胞24~48 h后H2S浓度升高(产H2S的峰值比100 μmol/L的NaHS高将近3倍),可通过调节增殖、凋亡等途径明显抑制细胞活力。目前的研究已经初步明确了H2S在低浓度范围内促进结直肠癌以及在高浓度区间(多由外源性供体提供)抑制肿瘤进展的双向作用。因此H2S释放剂、H2S合成酶的抑制剂等得到了广泛研究[21]。研究证明SW480结直肠癌细胞中用H2S供体NAC处理后,可促进线粒体酶3-MPST及内源性H2S产生增加,通过线粒体代谢重新编程来促进结直肠细胞抵抗氧化应激的能力[22]。此外,丁酸盐和NaHS都可以使结肠癌中的CBS和CSE呈高表达状态,使体内H2S产生过多,并且均呈剂量依赖性地降低细胞活力,同时用CBS抑制剂或CBS siRNA减少CBS的表达可逆转丁酸对结直肠癌细胞活力的抑制[23]。此外,较高浓度的H2S还可通过激活ERK、p38 MAPK的磷酸化抑制结肠癌细胞的增殖。
在裸鼠体内移植HCT 116细胞或SW480细胞后,沉默CBS表达或用AOAA药物抑制CBS表达使内源性H2S生成较少,明显降低移植瘤的生长速度,同时肿瘤血管生成减少,在肿瘤实质内直接注射AOAA可减少瘤周血流量[3],除抑制原发性肿瘤生长外,CBS抑制AOAA还可减少HCT 116细胞转移灶的数目[24]。因而提示下调内源性H2S能有效抑制结肠癌的发展,也从侧面反映出内源性H2S的促癌能力。相反的,研究表明一种新型H2S供体萘普生(HS-NAP)能释放H2S,HS-NAP作用于异种移植HT-29人结肠癌细胞的小鼠模型后,可通过减少体内NF-κB水平,明显下调移植瘤的体积和质量,同时抑制细胞增殖,诱导细胞凋亡[25]。
2.4 H2S与胃癌
与正常胃黏膜上皮细胞相比,胃癌细胞中CBS和CSE的表达相对较高,同时降低CBS和CSE的表达水平后,可以显著抑制胃癌细胞的增殖。此外,H2S可通过调控 MMP2 和 MMP9 基因促进血管生成,影响胃癌细胞增殖和迁移过程。胃癌细胞AGS中高表达CSE,用CSE抑制剂PPG和BCA下调内源性H2S产生量后,AGS细胞增殖水平明显被抑制,进一步证明了内源性H2S可促进胃癌细胞增殖[26]。此外,用红参提取物(KRGE)处理胃癌细胞株后,CBS和CSE的表达水平明显降低,进而可通过下调内源性H2S从而发挥抑癌效应[27],同时,H2S本身却又可通过AMPK通路的激活在一定程度上保护正常非肿瘤胃组织[28]。
相反的,高浓度NaHS作用后可明显诱导胃癌细胞凋亡,同时抑制癌细胞迁移和侵袭,发挥H2S的抗癌效应[29]。同时H2S也可在胃癌细胞中特异性抑制甘露糖α-1,6-糖蛋白β-1,6-N-乙酰葡糖氨基转移酶(MGAT5)的表达,有效降低胃癌中异常糖蛋白的表达,进而抑制胃癌细胞的发生发展[30]。此外,S-炔丙基半胱氨酸(SPRC)作为H2S供体,能明显增加CSE及内源性H2S水平,具有抑制SGC-7901胃癌细胞增殖和迁移,促进胃癌细胞凋亡的功能。
鼠源性胃癌细胞中的CBS和CSE表达水平也明显增高,用特异性抑制剂(AOAA、PAG)作用于荷瘤小鼠后明显抑制了瘤体大小及重量,并且减少了血管生成,因而提示H2S在一定浓度范围内能发挥促癌作用,用相应的抑制剂抑制H2S生成酶后能有效缓解其促癌效应。体内研究显示,腹腔注射50 mg/kg和100 mg/kg的H2S外源性供体SPRC可显著降低裸鼠移植瘤的重量和体积,肿瘤生长抑制率为40%~75%,且该抑制效应可被CSE活性抑制剂PAG阻断[31]。表明在胃癌体内外模型中,H2S都能发挥其钟形效应。
2.5 H2S与肝癌
HepG2细胞中CBS高表达,姜黄素和海带提取物对其联合作用后CBS表达下降,内源性H2S呈剂量依赖性下降,进而抑制细胞增殖和转移相关蛋白的表达,表现出对增殖和转移的抑制作用。CBS在人肝癌HepG2和SMMC-7721细胞中呈高表达,用喹诺酮-吲哚酮偶联物QIC2抑制内源性CBS/H2S水平,可显著降低细胞的活力和生长速率,触发细胞凋亡等[32]。此外,抑制CBS/H2S通路可导致肝癌细胞HepG2和PLC/PRF/5内产生ROS,引起线粒体的崩解,进而诱导DNA损伤和细胞凋亡[33]。这些研究结果从侧面证明了一定浓度范围内的内源性H2S能在肿瘤中发挥促癌作用,而在此基础上下调H2S生成酶如CBS,能反向发挥抑癌作用。
相对较低水平的H2S主要发挥促进肝癌细胞生长的作用,而高浓度的H2S则可能表现出对肝癌细胞生长的抑制作用,在肝癌细胞中主要通过EGFR/ERK/MMp-2和PTEN/AKT信号通路实现[34]。此外,在人肝癌细胞HepG2 和 Bel7402中,H2S供体GYY4137 400 μmol/L处理24 h可通过抑制p-STAT3的激活达到抑制肝癌细胞增殖的作用,同时促进肝癌细胞的凋亡,抑制肝癌的迁移能力。
在肝癌的体内实验中也存在H2S的双向作用,研究表明,用较低剂量组NaHS作用于人肝癌移植瘤的裸鼠,主要表现其促癌效应,使瘤体增大,血管生成增多;而较高剂量组NaHS则主要发挥其抑癌作用。此外,目前已有研究发现H2S供体NaHS 和 GYY4137可通过阻断STAT 3和NF-κB下调肝癌细胞吲哚2,3-双加氧酶1(IDO1)的表达,抑制肝癌荷瘤小鼠肿瘤的发生发展[35]。
2.6 H2S与神经胶质瘤
在神经胶质瘤中,低浓度H2S在脑部可拮抗ROS引起的氧化应激作用,保护神经胶质瘤细胞,进而促进肿瘤的发生[36]。此外,通过H2S供体或提高相关酶类活性及表达的药物可增加内源性H2S浓度,H2S生成水平升高后激活p38MAPK和Cox-2等通路,进而促进C6胶质瘤细胞的生长,抑制其凋亡[37]。相关实验已证明生理浓度的内源性H2S可通过抑制JNK、p38和ERK1/2磷酸化,促进Nrf2活化,发挥减轻氧化应激反应和抗凋亡等作用, 在一定程度上可促进神经胶质瘤细胞生长[38]。
另一方面,研究表明H2S可通过聚硫反应产生多硫化物,多硫化物可显著抑制小鼠神经胶质瘤细胞N2A的生长并能促进神经元细胞突起的生长,促进其分化,但NaHS对N2A胞突生长的影响不显著[39]。此外,NaHS作为H2S的常见供体,可选择性杀伤胶质母细胞瘤细胞(T98G和U87),同时保留正常人微血管内皮细胞(hCMEC/D3),对胶质母细胞瘤细胞的杀伤可能是由于ROS的产生增加了损伤诱导的结果,NaHS还能通过调节氧化应激、DNA损伤、线粒体功能障碍之间的相互关系,增强GBM细胞对放射治疗的敏感性,间接抑制胶质母细胞瘤细胞生长[40]。
在体内实验中,Takano等[41]建立了沉默CBS的U87-MG胶质瘤细胞株,并将其种植于SCID小鼠,CBS沉默的亚克隆具有较短的肿瘤潜伏期和更快的肿瘤生长速度。除肿瘤体积增大外,CBS沉默的肿瘤通过增强VEGF、ANGPTL4、HIF2α表达水平,增加了胶质瘤的侵入深度、血管密度、细胞增殖等。可以发现下调CBS的体内实验结果与结肠癌、胃癌等体内实验结果相反,这些差异的存在可能与H2S在不同组织来源肿瘤中的基础表达量以及肿瘤微环境差异有关。
2.7 H2S与其他肿瘤
除结肠癌和乳腺癌等常见恶性肿瘤以外,H2S在口腔癌、食管癌、卵巢癌、尿道上皮癌等其他多种肿瘤中也起到一定的作用。
已有临床实验报道在口腔鳞状细胞癌中较邻近的良性口腔黏膜中H2S释放量增多[42],且口腔黏液表皮样癌中CBS、CSE以及3-MPST升高,而游离H2S呈升高或轻微升高,进一步说明在恶性肿瘤的维持和生长过程中,对H2S进行了快速的代谢,并且提高内源性H2S浓度可明显促进口腔癌细胞的生长。
在食管癌EC109中,NaHS(400 μmol/L)持续24 h的供给使内源性H2S浓度升高,但仍处于H2S生理剂量范围(0.2~1.0 mmol/L)内,并通过HSP90通路促进细胞增殖。此外,NaHS处理使食管癌细胞Bcl-2表达增加,cleaved caspase-3和Bax表达减少,降低了细胞凋亡。重要的是,NaHS处理则同时增加了食管癌细胞MMP-2、VEGF的表达,增强肿瘤迁移能力[43]。
研究表明钠/钙交换剂可通过降低细胞内pH值直接参与H2S诱导的卵巢癌等肿瘤细胞凋亡[44]。在卵巢癌细胞系A2780中,细胞内钙转运系统可通过内质网应激下调H2S,诱导肿瘤细胞凋亡,发挥抑癌作用[18]。此外,CBS和CSE在卵巢癌中表达较高,通过下调CBS的表达,可显著抑制卵巢癌细胞系OV202和 A2780的细胞增殖能力,同时可以减少线粒体的呼吸作用,从而抑制ATP的合成,进一步抑制肿瘤的形成。CBS沉默或CBS抑制的另一个重要结果是细胞ROS水平增加,增加了p53表达,而NF-κB表达减少,从而抑制细胞增殖,促进肿瘤凋亡[3]。在移植有A2780/CP-20异种移植瘤的裸鼠中的后续研究结果表明,CBS的沉默导致肿瘤重量和肿瘤结节数量减少,同时减少了癌细胞增殖能力,抑制血管生成[45]。
膀胱尿路上皮细胞癌中H2S及其合成酶活性或蛋白含量升高[46],NaHS(<200 μmol/L)处理EJ细胞24 h后,促进细胞增殖及迁移,同时抑制细胞凋亡,表现出明显的促癌效应。但下调CBS、CSE后,可使内源性H2S下降,同时发挥其抑癌效应。此外,H2S及其合成酶的表达高低与膀胱尿路上皮细胞癌的分期、分级有关,选取94例不同分期/分级的尿路上皮癌患者的尿路上皮细胞和标本进行免疫染色,并采用图像半定量法、蛋白免疫印迹法和硫敏电极法检测细胞和标本中CBS、CSE和3-MPST的表达水平和活性,结果表明CBS、CSE、3-MPST的蛋白水平和催化活性与人膀胱组织和人尿路上皮癌细胞系恶性程度呈正相关[47]。
3 H2S与肿瘤耐药
耐药是恶性肿瘤化疗面临的难点[48]。目前已有多项研究证明H2S在一定程度上参与了肿瘤耐药性的过程[49],如H2S供体NAC可通过线粒体代谢促进耐药的发生和发展,同时还发现H2S在结肠癌对常用化疗药物5-氟尿嘧啶(5-FU)产生耐药性过程中发生了稳定的变化[50],半胱氨酸在肿瘤中的主要作用是促进H2S的生成,使卵巢癌适应缺氧情况,进而摆脱卡铂对肿瘤细胞的细胞毒性而引起耐药[51]。因而下调H2S增强了多种肿瘤对化疗药物的敏感性,用AOAA或CBS的si-RNA敲减CBS时,与顺铂联用后显著降低线粒体DNA的修复效率,增强化疗药物对肿瘤的杀伤作用,能明显增强乳腺癌、肺癌、尿道上皮癌等对顺铂的敏感性[52]。同时运用PAG或CSE siRNA敲减CSE后,还可增强多柔比星对胰腺癌、结直肠癌、肝癌等的杀伤作用[53]。此外,在裸鼠原位异种移植HCT 116模型中,AOAA与奥沙利铂的抗肿瘤转移作用有协同作用[24]。
4 总结及展望
H2S调控肿瘤的发生发展主要通过对增殖和细胞周期的调控,协调凋亡和抗凋亡水平,调控血管生成来影响迁移、侵袭,从而表现促进肿瘤生长和发挥抑癌效应的双向效应,其作用机制主要为通过激活NF-κB通路和 EGFR/ ERK1/2以及COX-2通路发挥促癌作用,又可通过激活某些信号通路如p38 MAPK/PTEN/AKT等发挥抗癌能力[43]。H2S的毒性和治疗价值主要取决于浓度,低浓度的H2S起生理作用,高浓度的H2S则可因细胞毒性导致死亡[54]。因为较低浓度的内源性H2S可促进癌细胞生长,因此,用一种选择性靶向癌细胞H2S的小分子来降低内源性H2S水平是一种有吸引力的治疗癌症的策略[55]。针对较高浓度的内源性H2S能抑制肿瘤的发展,目前有较多学者开始关注缓慢释放H2S的供体作为新型抗肿瘤药物的转化研究。一些通过生成H2S或激活H2S产生酶而发挥药理学功能的药物(如: ATB-429、ATB-346、GYY4137 及SPRC 等)相继诞生,并逐步尝试运用到肿瘤治疗中。H2S参与了多种恶性肿瘤的调节,为开发新的抗癌药物提供了新的契机,此外,仍有诸多因素制约着基于H2S的药物开发研究,如供体代表性不足:供体NaHS虽是H2S的最常见研究供体,但当NaHS溶解时,H2S瞬间一次性释放,实验结果能否反映H2S的持续作用效应仍有待考量,因此,亟待开发持续稳定的新型供体;此外,作用靶点机制不清:目前H2S在不同肿瘤中的作用机制各有不同,是否存在共有的信号调控途径尚待明确,以更好地发挥其抗肿瘤作用。随着H2S在肿瘤中的作用机制逐渐清晰,H2S介导的肿瘤防治有着广阔的应用前景。
