Hsa_circ_0001947对胃癌细胞增殖和凋亡的影响
2020-03-02陈正威章安伟张垚张烜烽袁海涛步雪峰
陈正威,章安伟,张垚,张烜烽,袁海涛,步雪峰
(1.江苏大学医学院,江苏 镇江 212013;2.江苏大学附属昆山医院普外科,江苏 昆山 215300;3.江苏大学附属人民医院普外科,江苏 镇江 212002)
环状RNA是一种特殊非编码RNA,广泛存在于生物体内[1-2]。其不仅与多种疾病密切相关,且具有潜在的癌症诊断与生物治疗价值[3]。研究显示,目前已在胃癌患者的胃癌组织、细胞,甚至血浆中发现多种表达失调的环状RNA[4-6]。Hsa_circ_0001947是一种内源性环状RNA,定位于X染色体: 147743428-147744289,广泛表达于人体各组织器官,但其目前在胃癌发生发展过程中的作用尚不清楚。本研究拟观察hsa_circ_0001947在胃癌细胞、组织中的表达,并分析其对胃癌细胞增殖和凋亡的影响。
1 材料与方法
1.1 研究对象
选择2017年7月至2018年8就诊于江苏大学附属人民医院普外科的75例胃癌患者,行全胃或胃大部切除术后,收集胃腺癌及癌旁组织(距离癌组织>5.0 cm)标本,手术标本切除后30 min内迅速放入液氮中冷冻,然后于-80 ℃长期保存。标本采集均得到患者同意,并经江苏大学附属人民医院伦理委员会批准。
1.2 细胞株和主要试剂
高通量测序(上海欧易生物医学技术有限公司);人胃癌MGC-803、BGC-823、SGC-7901、HGC-27细胞(中国科学院上海生科院细胞资源中心);正常胃黏膜上皮GES-1细胞株(南京凯基生物科技发展有限公司);胎牛血清、RPMI 1640、DMEM(以色列BI公司);Trizol试剂(美国Ambion公司);小干扰RNA(si-RNA,广州锐博生物技术有限公司);PCR引物(上海生工生物工程股份有限公司);TaqMan反转录试剂盒(美国Ambion公司);SYBR Green PCR预混试剂、荧光定量PCR试剂盒(日本TaKaRa公司);Lipofectamine 2000转染试剂、CCK-8试剂盒(南京厚载生物科技有限公司);AnnexinⅤ-FITC/PI试剂盒(北京四正柏生物科技有限公司);羊抗兔Cleaved-caspase-3抗体(美国CST公司);羊抗兔Bax抗体、羊抗鼠Bcl-2抗体(武汉博士德生物工程有限公司)。
1.3 方法
1.3.1 细胞培养与细胞转染 用含10%胎牛血清的RPMI 1640、DMEM于37℃,5% CO2饱和湿度的培养箱中分别培养胃癌BGC-823、SGC-7901、HGC-27以及MGC-803细胞。每24 h更换1次培养基,当细胞在培养瓶中覆盖率达80%时进行传代培养。细胞接种于6孔板中,当细胞达到50%~70%融合点时,将其分为si-circ_0001947组和si-NC组,分别加入si-circ_0001947,si-NC以及脂质体2000,培养12 h,以备后续实验用。
1.2.2 实时荧光定量PCR(qRT-PCR)检测胃组织、细胞中circ_0001947的表达水平 采用Trizol法提取75例胃腺癌、癌旁组织,4种胃癌细胞及胃上皮细胞中总RNA,并按TaqMan RNA反转录试剂盒说明书操作,将4 ng总RNA反转录合成cDNA。在CFX96实时定量PCR仪中,以GAPDH为内参,量化circ_0001947的表达水平,使用SYBR Green PCR预混试剂行qRT-PCR,以2-ΔΔCt法反映circ_0001947相对表达水平。circ_0001947上游引物:5′-GTGAAACAAACAAAGGTGATGC-3′,下游引物:5′-ATTCCCACTAGGTGATTCTGA-3′,内参GAPDH上游引物:5′-CCCACTTCTCTCTAAGGAGAAT-3′,下游引物:5′-TACACGAAAGCAATGCTATCAC-3′。
1.2.3 CCK-8实验检测细胞活力 取si-circ_0001947组和si-NC组2组BGC-823、SGC-7901细胞,分别接种于96孔板中,5 000个/孔,每组设置3个复孔,于细胞培养箱中培养。根据细胞分裂周期分别于0、12、24、48、72 h进行CCK-8检测[7],每孔加入10 mL CCK-8试剂,置于细胞培养箱中孵育2 h,用酶标仪检测450 nm处光密度值[D(450 nm)]。
1.2.4 克隆形成实验检测细胞增殖 将si-circ_0001947组和si-NC组2组BGC-823、SGC-7901细胞分别接种于6孔板中(500个/孔),每组设置3个复孔,37 ℃培养箱中培养10~12 d;每2~3 d换液一次,克隆细胞长至合适大小时终止培养;PBS清洗3次;加入甲醇于4℃固定细胞15 min;PBS清洗3次;每孔加入结晶紫1 mL染色20 min;加入双蒸水清洗至洗净背景;计数细胞克隆数,克隆形成率(%)=(克隆数/接种细胞总数)×100%。
1.2.5 流式细胞仪检测细胞凋亡率 将BGC-823,SGC-7901细胞分别加入si-circ_000194与si-NC培养12 h;收集并消化细胞,用预冷PBS清洗3次;按照细胞凋亡试剂盒说明书操作,先用1×结合缓冲液重新悬浮细胞,调节其密度为1×106/mL;取100 mL悬液,加入5 mL Annexin V-FITC于室温避光孵育5 min;加入10 mL一碘化丙锭,再加入400 mL PBS,上机进行检测。
1.2.6 蛋白印迹法检测凋亡相关蛋白的表达
将胃癌BGC-823、SGC-7901细胞分别接种于6孔板中,分别加入si-circ_0001947,si-NC孵育12 h后提蛋白。依次行SDS-PAGE,350 mA 90 min湿转至PVDF膜;BSA封闭1h;分别加羊抗兔Cleaved-caspase-3抗体(1 ∶300),羊抗鼠Bcl-2抗体(1 ∶400),羊抗兔Bax抗体(1 ∶400),羊抗鼠β-微管蛋白(1 ∶1 000),4℃孵育过夜;TBST洗膜3次;加羊抗鼠或羊抗兔HRP-IgG(1 ∶3 000)室温孵育2 h;TBST洗膜3次;增强型化学发光试剂显影。Image J对蛋白条带吸光度进行定量分析。
1.2.7 统计学处理

2 结果
2.1 胃腺癌组织中差异环状RNA的表达谱
通过高通量测序筛选出5例临床胃腺癌、癌旁组织中差异表达的5种环状RNA,分别为hsa_circ_0000033,hsa_circ_0000038,hsa_circ_0004916,hsa_circ_0058092,hsa_circ_0001947。与癌旁组织相比,胃腺癌组织中hsa_circ_0000033,hsa_circ_0000038及hsa_circ_0004916表达明显下调(t=3.332,2.791,8.901,P均<0.05),hsa_circ_0058092和hsa_circ_0001947表达明显上调(t=10.631,15.360,P均<0.01),见图1。挑选上调最明显的hsa_circ_0001947进行后续实验。
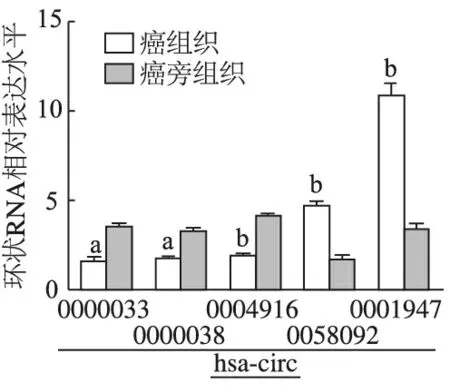
a : P<0.05,b: P<0.01,与癌旁组织相比
2.2 circ_0001947在胃癌组织及胃癌细胞中的表达
由图2可见,胃癌组织中circ_0001947相对表达量显著高于癌旁组织(t=8.019,P<0.01)。4株胃癌细胞中circ_0001947相对表达量均明显高于人胃上皮GES-1细胞(P<0.05或P<0.01)。circ_0001947在胃癌细胞BGC-823中相对表达量最高,在SGC-7901中最低,故挑选这两种细胞株继续进行后续实验。
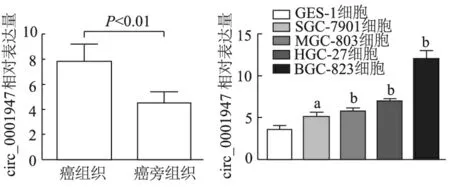
a : P<0.05,b : P<0.01, 与GSE-1细胞相比
2.3 si-RNA显著下调胃癌BGC-823,SGC-7901细胞中circ_0001947表达量
胃癌BGC-823,SGC-7901细胞转染si-RNA 12 h后,si-circ_0001947组中circ_0001947相对表达量明显低于si-NC组(t分别为10.011,4.933,P均<0.01),由此表明si-RNA对胃癌细胞中circ_0001947存在敲减作用。见图3。
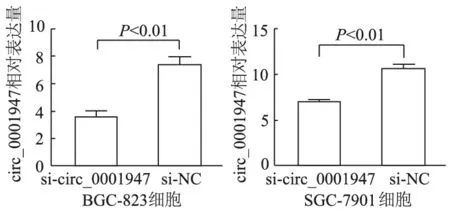
图3 si-RNA干预后胃癌细胞内circ_0001947表达水平
2.4 下调circ_0001947表达明显抑制胃癌细胞增殖
CCK-8结果显示,si-circ_0001947组BGC-823,SGC-7901细胞各个时间点D(450 nm)值均明显低于si-NC组(P均<0.05);circ_0001947组克隆形成率较si-NC组明显降低(t=9.409,11.381,P均<0.01)。见图4。
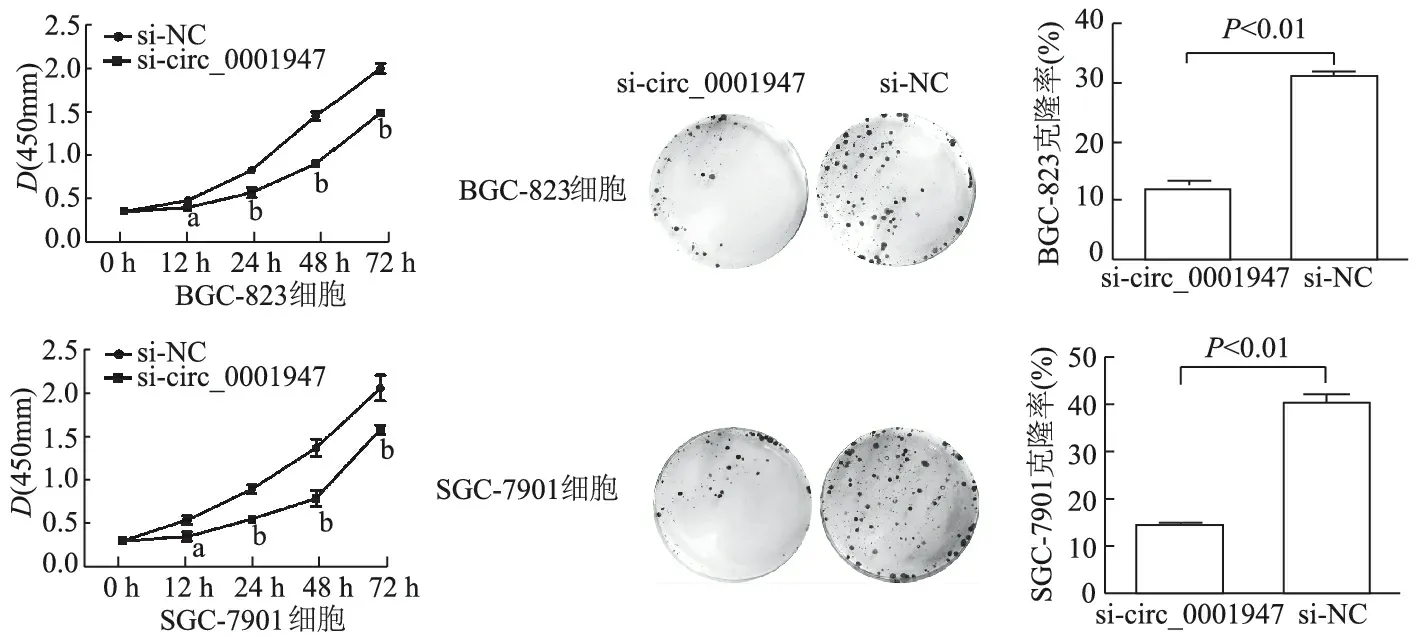
a: P<0.05, b:P<0.01, 与si-NC组比较
2.5 下调circ_0001947表达促进BGC-823、SGC-7901细胞凋亡
流式细胞仪检测结果表明,si-circ_0001947组BGC-823,SGC-7901细胞凋亡明显高于si-NC组率(t=5.620,3.711,P均<0.01)。见图5。与si-NC组相比,si-circ_0001947组BGC-823,SGC-7901细胞中Cleaved-caspase-3(t=7.991,12.309,P均<0.01)与Bax(t=8.619,3.574,P<0.01或<0.05)相对表达量明显升高;Bcl-2相对表达量明显降低(t=14.527,2.588,P<0.01或<0.05)。见图6。
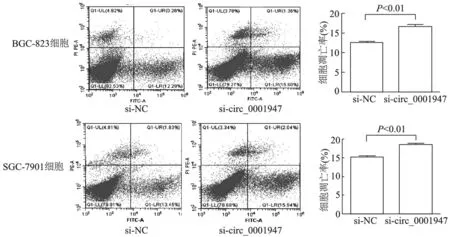
图5 流式细胞术分析各组细胞凋亡情况
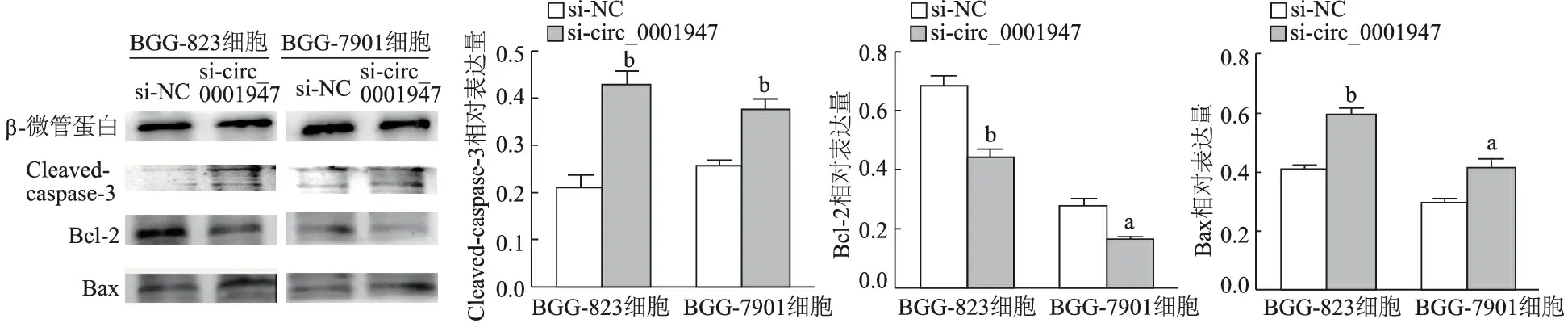
a: P<0.05,b: P<0.01,与si-NC组比较
3 讨论
以往研究显示,环状RNA在多种恶性肿瘤中表达上调,通过促进肿瘤细胞增殖,抑制其凋亡影响肿瘤发生发展[8-10]。本实验通过高通量测序挑选出一种新型环状RNA hsa_circ_0001947进行研究,实验结果显示,circ_0001947在胃腺癌组织和胃癌细胞中表达水平明显升高,说明circ_0001947在胃癌发生发展过程中可能发挥原癌基因功能。
张帅等[11]研究表明,环状RNA hsa_ circ_0007766通过上调细胞周期相关蛋白Cyclin D1/CyclinE1/CDK4表达,从而促进肺腺癌细胞增殖,沉默hsa_circ_0007766表达后,细胞周期阻滞于G0/G1期,明显抑制肺腺癌细胞生长。杨睿等[12]也证实,hsa_circ_0058514通过影响细胞周期蛋白CCNE1和CKD2表达,从而影响乳腺癌细胞周期。本研究通过CCK-8和克隆形成实验发现,circ_0001947 促进胃癌细胞增殖,下调circ_0001947表达后,胃癌细胞增殖明显受抑制,推测可能与circ_0001947影响胃癌细胞分裂周期有关。此外,本实验发现,与正常胃上皮细胞相比,胃癌细胞早期凋亡率与晚期凋亡率均明显上升。Bcl-2和Bax属于Bcl家族,是调控细胞凋亡的重要蛋白,其异常表达会导致细胞凋亡过程失常,增加肿瘤发生的风险[13-16]。凋亡是影响肿瘤发生发展的重要因素[17]。本实验结果显示,敲减circ_0001947后,Cleaved-caspase-3、Bax的表达明显上调,而Bcl-2表达显著下调,由此推测circ_0001947在胃癌细胞中可能通过影响凋亡相关蛋白表达,从而抑制胃癌细胞凋亡。但circ_0001947调控胃癌细胞周期蛋白与凋亡相关蛋白表达的具体机制尚有待进一步研究。
综上所述,hsa_circ_0001947在胃腺癌组织和细胞中呈高表达,其可能通过影响细胞周期促进胃癌细胞增殖,影响凋亡相关蛋白表达抑制胃癌细胞凋亡。
