RNAi沉默Sox2表达对结直肠癌细胞5-氟尿嘧啶的增敏作用
2020-03-02员亚晶徐利晓孙斌冯星
员亚晶,徐利晓,孙斌,冯星
(苏州大学附属儿童医院 1.新生儿科,2.儿科研究所,江苏 苏州 215000)
Sox是由一类共同含有一个高度保守的高迁移率族框(high-mobility group box,HMG box)DNA结合域相关基因构成的控制发育的基因。作为Sox基因家族中的一员, Sox2参与早期胚胎发生、神经系统发育、基底细胞增殖分化等,是胚胎干细胞的表面分子标志之一,在细胞的重编程中起着至关重要的作用[1-2]。研究表明,Sox2在多种肿瘤中有着不同程度的表达,如乳腺癌[3]、胃癌[4]、鳞状细胞癌[5]、前列腺癌[6]、神经胶质瘤[7-8]、食道癌[9]和结直肠癌[10]等,参与肿瘤的发生发展过程。RNA干扰技术能特异性地抑制基因在细胞中的表达。本研究通过沉默Sox2的表达来探索结直肠癌细胞SW620对其化疗药物5-氟尿嘧啶(5-FU)敏感性之间的关系,为逆转结直肠癌多细胞耐药、增加其对化疗药物的敏感性提供新的思路。
1 材料与方法
1.1 细胞株、质粒及菌株
结直肠癌细胞株SW620购自中国科学院细胞库,由苏州大学附属儿童医院儿科医学研究所保存。Sox2 shRNA干扰质检和对应的空载对照购自Sigma公司。大肠埃希菌(DH5α),包装细胞293T,包装质粒pCM-VSV-G由中山大学生命科学学院肿瘤与干细胞研究室惠赠。
1.2 主要试剂
DMEM/F12培养基、氨苄西林、嘌呤霉素、聚凝胺(美国Sigma公司),胎牛血清(美国Gibco公司),细胞培养用胰酶(日本DAKO公司),质粒提取试剂盒(美国Qiagen公司)、脂质体Lipofectamine2000转染试剂、Trizol(美国Invitrogen公司),反转录试剂盒(日本Toyobo公司),CCK8试剂盒(日本同仁化学公司),Sox2抗体(美国CST公司),β-肌动蛋白抗体(美国Santacruz公司),羊抗兔二抗、羊抗鼠二抗(美国GE公司)。实验所用试剂均为进口或国产分析纯试剂。
1.3 转染SW620细胞
转染293T细胞获得包装病毒:1×105个细胞接种于6孔板中,正常条件培养;待细胞密度至60%时,无血清培养液饥饿处理2 h;Sox2基因干扰质粒和辅助质粒pCM-VSV-G共同经Lipofectamine2000脂质体转染,导入到包装细胞293T中;转染后48 h开始收集病毒液,0.45 μm滤膜过滤后直接使用或-80℃保存备用。Sox2 shRNA慢病毒颗粒感染SW620细胞:1×105个细胞接种于6孔板中,正常条件下培养;第2天加入经过0.45 μm滤膜过滤的包含Lentivirus病毒颗粒培养液,加入8 μg/mL的聚凝胺增强病毒的感染力;12 h后去除病毒溶液,更换新鲜的培养液(如有必要,可再次感染);感染48 h后,加入1 μg/mL的嘌呤霉素筛选沉默Sox2成功的细胞株;扩增耐药的转导成功的细胞株,保存和用于其他功能研究。
1.4 实时荧光定量PCR检测Sox2及ABC耐药家族基因表达水平的变化
Sox2、ABC耐药家族基因及β-肌动蛋白引物由Invitrogen公司合成。引物序列见表1。

表1 引物序列
分别收集1×106个稳定筛选的细胞,Trizol用于提取总RNA,NanoDrop2000分光光度仪测定RNA浓度,利用反转录试剂盒得到cDNA模版,在荧光定量PCR仪上进行PCR扩增,反应条件为:95℃ 10 min;95℃ 15 s;60℃ 15 s;72℃ 30 s;72℃收集荧光,共45个循环。循环结束后做相应的溶解曲线,运用 LightCyler 480自带的软件进行实时数据收集和定量分析。
1.4 蛋白质印迹法检测Sox2沉默效率
1×104个细胞接种于6孔板中,细胞密度至80%后,RIPA细胞裂解液用于总蛋白的提取,GE蛋白定量试剂盒测定蛋白浓度。总蛋白100 μg,煮样后进行SDS-PAGE凝胶电泳,转膜,5%脱脂牛奶封闭,一抗Sox2和β-肌动蛋白4℃孵育过夜,二抗孵育,TBST洗膜后ECL化学发光自显影检测。
1.5 免疫荧光检测Sox2基因的沉默效率
1×104个Sox2沉默后细胞和对照组细胞接种于铺了盖玻片的6孔板中,待细胞密度至70%左右;冷的PBS冲洗后,4%低聚甲醛室温固定30 min;PBS洗涤3次,每次10 min,5% BSA-PBS封闭液室温封闭1 h;弃去封闭液,加入1 ∶100稀释的一抗,置于湿盒中4℃过夜;弃去一抗,PBS洗涤3次,每次10 min;加入带有FITC标记的1 ∶250稀释的二抗,室温避光孵育1 h;弃去二抗,PBS洗涤3次,每次10 min;DAPI避光染色5 min,PBS洗涤3次,每次10 min;防淬灭甘油封片剂封片,荧光显微镜下观察拍照。
1.6 CCK8法检测干扰前后细胞对5-FU敏感性的变化
按5×103/孔将细胞接种于96孔板。每组分别加入终浓度为0、0.5、1、1.5、2、2.5、3、3.5、4、4.5和5 μg/mL的5-FU,以未加药物的细胞为阴性对照,仅有培养液的孔作为校正,相同处理设置3个复孔,培养48 h后,每孔加入10 μL的CCK8,37℃、5% CO2孵箱中继续培养4 h。在酶标仪450 nm处检测各孔的光密度值。独立实验重复3次。计算各孔细胞的生长活力,绘制细胞生长活力曲线,以回归方程求得5-FU对各细胞的半数抑制浓度(IC50)值。
1.7 干扰前后5-FU诱导肿瘤细胞凋亡的变化
按5×105/孔将细胞接种于6孔板中,每孔2.5 mL的培养基,24 h后,用含有终浓度10 μg/mL的5-FU培养液更换原有培养液,37℃、5% CO2孵箱中培养;24、48和72 h时收集样品,加入终浓度为1 μg/mL的Hochest33342染色,荧光显微镜观察拍照。同时收集样品,用FACS Calibur流式细胞仪检测细胞凋亡情况。
1.8 统计学处理

2 结果
2.1 筛选稳定转染的细胞单克隆
嘌呤霉素梯度测试的结果显示,一周后1 μg/mL嘌呤霉素处理的细胞全部死亡,因此确定嘌呤霉素1 μg/mL作为合适的shRNA稳定表达细胞的药物筛选浓度。经1 μg/mL嘌呤霉素筛选得到单克隆,扩增培养。
2.2 干扰前后Sox2 mRNA的表达
转染Sox2 shRNA两组细胞中Sox2基因的表达较转染对照载体组明显降低,表明转染抑制目的基因Sox2的表达(图1),转染Sox2 shRNA clone1和Sox2 shRNA clone2的细胞组mRNA表达的抑制率约为40%和57%。

shRNA control:转染空载的阴性对照组;shRNA clone1:转染sox2干扰序列1的实验组;shRNA clone1:转染sox2干扰序列2的实验组
图1 实时荧光定量PCR检测Sox2基因沉默的效率
2.3 干扰前后Sox2蛋白的表达
与对照细胞相比,转染了Sox2 shRNA clone1和Sox2 shRNA clone2的细胞中Sox2蛋白的表达水平显著下降,见图2。
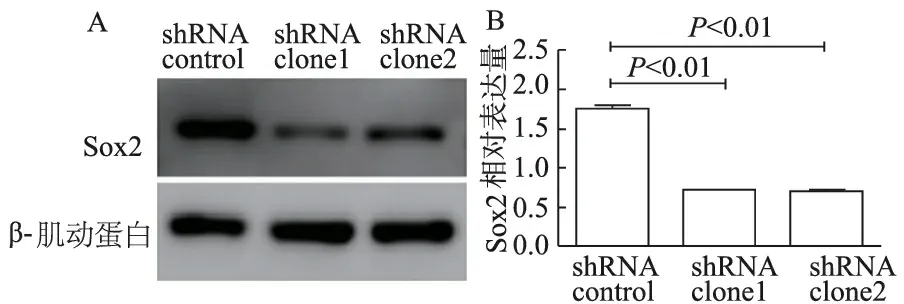
A: 检测转染后Sox2蛋白表达水平;B: 对Sox2蛋白表达情况灰度分析;shRNA control:转染空载的阴性对照组;shRNA clone1:转染sox2干扰序列1的实验组;shRNA clone1:转染sox2干扰序列2的实验组
图2 蛋白质印迹法检测Sox2基因沉默的效率
2.4 免疫荧光检测干扰前后Sox2的表达
转染Sox2 shRNA 48 h后,用免疫荧光检测两组细胞Sox2基因的沉默效率,结果见图3。转染了Sox2 shRNA clone1和Sox2 shRNA clone2的细胞与对照组细胞相比,荧光强度减弱,Sox2蛋白表达明显降低。见图3。

图3 免疫荧光检测Sox2基因沉默的效率
2.5 干扰前后细胞对5-FU敏感性的变化
10个不同浓度的5-FU处理各组细胞48 h后,检测D(450 nm)值,分别计算各组细胞的生长活力和5-FU对细胞的IC50。结果表明,沉默Sox2后,SW620细胞对5-FU更加敏感,在5 μg/mL的5-FU处理48 h后细胞的存活率分别为39.15%和37.11%, IC50约为4.5 μg/mL。在对照组中,同样的5 μg/mL的5-FU处理48 h后细胞的存活率为64.1%,远远高于沉默Sox2的实验组,差异均有统计学意义(P=0.0095和P=0.019)。见图4。
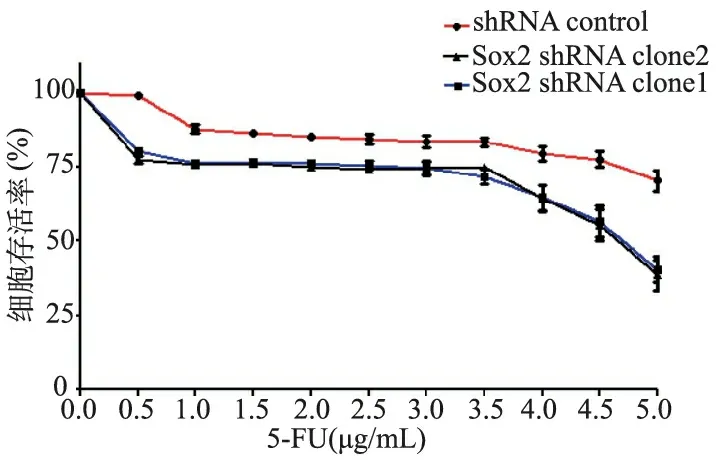
图4 Sox2沉默后SW620细胞对5-FU敏感性的变化
2.6 干扰前后5-FU诱导肿瘤细胞凋亡的变化
用5-FU分别处理各组细胞24、48、72 h,Hoches33342染色观察结果发现:与对照组细胞相比,Sox2沉默后的细胞具有明显的凋亡小体出现,并随作用时间的延长凋亡小体增加。流式细胞仪检测凋亡发现,Sox2 shRNA clone1和Sox2 shRNA clone2细胞在诱导不同时间点下的凋亡峰明显高于对照组。流式细胞仪检测结果显示,在10 μg/mL的5-FU处理48 h后,对照组细胞的凋亡率为7.25%,而Sox2沉默组的凋亡率分别为23.97%和24.58%。见图5。

A: Hochest33342染色观察5-FU分别诱导24、48和72 h后干扰组和对照组细胞的凋亡情况(红色箭头所指为凋亡小体,白色箭头所指为细胞核);B: 流式细胞仪检测5-FU分别诱导24、48和72 h后干扰组和对照组细胞的凋亡率;C:细胞凋亡率柱状分析图;#:P<0.05,*:P<0.01
图5 Sox2沉默后5-FU诱导SW620细胞凋亡的变化
2.7 干扰前后ABC耐药家族基因的表达
实时荧光定量PCR分析发现,ABC耐药基因在Sox2敲除后表达量明显下调,见图6。

ABCA1、ABCB1、ACC1、ABCG1、ABCG2均为耐药家族基因;#:P<0.05,*:P<0.01
图6 Sox2沉默后SW620细胞耐药基因的表达
3 讨论
结直肠癌是消化道常见的恶性肿瘤之一,其发病率与死亡率逐年增高,发病率仅次于胃癌和食管癌。目前大多采用以手术为主的综合治疗,手术后的5年生存率也仅为40%,放化疗是临床上治疗结直肠癌和改善预后的重要手段之一,然而治疗效果不尽人意。目前肿瘤化疗的最大障碍来自于计量限制性毒性和肿瘤细胞产生的药物耐受性,肿瘤细胞产生的耐受性,使得原本有效的治疗方案变为无效。近年来人们对于结直肠癌等实体瘤的耐药机制进行了大量的研究,结直肠癌耐药机制涉及多方面,目前认为,抵抗或者逃避化疗药物诱导的细胞凋亡是肿瘤化疗耐药的重要机制之一。
耐药是肿瘤细胞逃避化疗药物攻击的最重要的防御机制,提高肿瘤细胞对化疗药物的敏感性是提高治疗成功率的关键,也是当前研究的热点。Sox2是重要的转录因子,本课题组前期的研究结果显示Sox2在结直肠癌中高表达而在正常的肠道组织中呈弱阳性表达或者不表达。Sox2的表达与结直肠癌细胞的肿瘤分级、分化程度、转移和复发密切相关,并且影响结直肠癌细胞的增殖、迁移、浸润侵袭和致瘤等多项生物学功能[10]。已有研究报道,在前列腺癌细胞DU145中过表达Sox2能增强DU145细胞对顺铂及毒胡萝卜素的耐药性,提示Sox2在前列腺癌细胞的耐药复发中起到重要作用[6]。在神经胶质瘤细胞中,Sox2能够通过上调多耐药家族基因ABCC3和ABCC6的表达来提高肿瘤细胞对化疗药物的耐受性。除此之外,在对内源性高表达Sox2的细胞株LIN29进行Sox2的基因沉默后,显著提高了细胞对BCNU, etoposide和staurosporine等抗肿瘤药物诱导细胞凋亡的敏感性[11]。Shi等[12]研究指出,在对结直肠癌细胞进行诱导多功能干细胞(iPS)时发现,与正常的结直肠癌细胞相比,IPS球囊和亲本细胞经过化疗药物5-FU处理后,干细胞相关基因Nanog,Oct4,Sox2和Klf4的表达都明显下调,说明5-FU处理能够抑制干细胞相关基因的表达。以上研究提示Sox2的表达与肿瘤细胞的耐药有关,但对其耐药机制尚缺乏进一步的研究。
本研究证实,在对结直肠癌细胞SW620进行Sox2沉默表达之后,经过嘌呤霉素的筛选,采用实时荧光定量PCR、蛋白质印迹法及免疫荧光检测结果均表明Sox2的表达受到抑制,通过MTT法检测发现干扰Sox2后SW620细胞对5-FU的敏感性大大提高,细胞凋亡数量明显增加。
肿瘤细胞的耐药机制之一是通过细胞膜上面ABC转运蛋白家族等药物泵将药物从细胞内泵出到胞外,从而使药物不能与肿瘤细胞接触,逃脱多种化疗药物的毒性和杀伤作用。ABC转运蛋白是多耐药家族的重要成员,在体内广泛分布,主要包括有 ABCBl编码的 P-糖蛋白、ABCCl编码的多药耐药相关蛋白、ABCG2编码的乳腺癌耐药蛋白[13]。在CD133+的结直肠癌干细胞中ABCG2等ABC家族蛋白介导细胞膜上的膜泵耐药分子将细胞质中的药物清除,对化疗药物具有很强的抵抗能力[14]。我们进一步对干扰前后SW620细胞中多耐药家族基因的表达水平进行实时荧光定量PCR分析,结果显示,ABC转运蛋白家族基因ABCG1,ABCG2, ABCB1, ABCC1, ABCA1等耐药基因在 Sox2沉默细胞中表达量下调,推测Sox2可能通过调节耐药基因的表达参与结直肠癌的耐药过程,提示Sox2可能成为结直肠癌治疗的一个潜在靶点。
综上所述,本研究首次报告Sox2与结直肠癌细胞的耐药性相关,沉默Sox2后能够逆转结直肠癌细胞SW620对化疗药物 5-FU的耐受性,为进一步阐明结直肠癌耐药性的分子机制提供了实验依据,为临床上研制肿瘤药物和制定治疗方案提供了新的靶点,具有重要的理论意义和潜在的应用价值。
