重组小鼠IL-36α成熟肽制备及其在IBD中作用的初步研究①
2020-02-29富文达朱俊丰
富文达 朱俊丰 乔 丽 孙 逊
(中国医科大学免疫学教研室,沈阳 110122)
炎症性肠病(inflammatory bowel disease,IBD)是一种反复发作的慢性肠道炎症性疾病,根据临床表现可以分为溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)[1]。IL-1家族在IBD发病中发挥重要的免疫调控作用[2]。IL-36亚家族包括IL-36α(IL-1F6)、IL-36β(IL-1F8)、IL-36γ(IL-1F9)和IL-36Ra(IL-1F5),是新近发现的IL-1家族成员[3]。IL-36α广泛表达于角质细胞、上皮细胞、树突状细胞以及巨噬细胞中,提示IL-36α在相关组织的稳态和炎症中发挥重要作用[4,5]。小鼠IL-36α基因共编码160个氨基酸(Met-1-His-160),分子量约为17 kD。已有研究证明,在N端去除短结构域形成的IL-36α成熟肽(Arg-8-His-160)可以将IL-36α全蛋白的活性提高多达1 000倍[6]。目前关于IL-36α在IBD中的作用研究还处于起步阶段,在临床IBD患者肠组织和小鼠IBD模型肠黏膜中,IL-36α的表达水平显著升高[7,8],提示IL-36α可能在IBD发病中发挥作用。目前,还未有关于重组小鼠IL-36α成熟肽制备及应用的相关报道,本研究利用原核表达的方法制备小鼠IL-36α成熟肽,并对其在IBD发病中的作用进行初步研究,为进一步研究IL-36的肠道黏膜免疫应答调节机制奠定了基础。
1 材料与方法
1.1材料 质粒pET28a(+)、大肠埃希菌(Escheri-chia coli)BL21(DE3)由中国医科大学免疫教研室保存。小鼠IL-36α成熟肽基因委托武汉金开瑞生物工程有限公司优化合成。C57BL/6雄性小鼠(6~8周,SPF级)购于北京维通利华有限公司。DNA Maker、2×Pfu master Mix、T4DNA连接酶、琼脂糖电泳回收试剂盒、IPTG、卡那霉素、Ni-Aganose His标签蛋白纯化试剂盒购自北京康为世纪生物科技有限公司、ToxinEraserTM内毒素去除试剂盒、ToxinSensorTM显色法LAL内毒素检测试剂盒购自南京金斯瑞生物科技有限公司、小鼠抗His-Tag单克隆抗体购自武汉爱博泰克生物科技有限公司、DSS购自美国MP Biomedicals公司。
1.2方法
1.2.1pET28a-IL-36α质粒构建 对小鼠IL-36α基因密码子进行优化,合成优化后的小鼠IL-36α成熟肽基因。将IL-36α与pET28a(+)质粒载体分别用NcoⅠ和XhoⅠ进行双酶切,酶切后连接,构建pET28a-IL-36α质粒,转化大肠杆菌BL21(DE3),菌落PCR鉴定并测序,上述工作委托武汉金开瑞生物工程有限公司完成。
1.2.2小鼠IL-36α成熟肽的诱导表达 将重组小鼠IL-36α成熟肽工程菌接种于含卡那霉素的LB培养基中,37℃、200 r/min培养过夜;次日,按2%比例进行扩大培养,37℃、210 r/min培养2 h,至OD600值达到0.6时,加入终浓度为0.7 mmol/L的IPTG进行诱导表达,诱导条件为:温度16℃或20℃,转速100 r/min,时间20 h,将诱导表达后的菌液离心,除去上清,收集菌体。
1.2.3小鼠IL-36α成熟肽的纯化 诱导表达后收集的菌体用PBS重悬,将获得的菌体采用超声破碎法裂解,离心收集上清液,使用Ni-Agarose His标签蛋白纯化试剂盒纯化蛋白,Binding Buffer(20 mmol/L Tris-HCl,10 mmol/L咪唑,0.5 mol/L NaCl,pH7.9)清洗柱子,目的是去除杂蛋白。再用含有不同浓度咪唑的洗脱缓冲液(咪唑浓度:50 mmol/L,100 mmol/L,150 mmol/L,200 mmol/L,300 mmol/L) 洗脱,收集蛋白,将收集的蛋白使用ToxinEraserTM内毒素去除试剂盒去除内毒素,经ToxinSensorTM显色法LAL内毒素检测试剂盒检测rIL-36α溶液的内毒素浓度小于0.5 Eu/ml,并进行SDS-PAGE电泳检测。
1.2.4蛋白免疫印迹(Western blot)分析 分别将目的蛋白及对照组蛋白经处理后进行15%SDS-PAGE电泳,利用转移电泳仪将电泳分离的蛋白胶转到PVDF膜上,5%的脱脂奶粉封闭过夜,PBST洗膜3次,加2 000倍稀释的小鼠抗His-Tag单克隆抗体在杂交袋中杂交1 h后,PBST洗膜5次,每次10 min,加入5 000倍稀释的辣根过氧化物酶标记的山羊抗小鼠IgG,室温杂交1 h,PBST洗膜5次,每次10 min,然后在PVDF膜上加入Western发光检测液A、B各50 μl,放入暗室里进行显影反应。
1.2.5DSS肠炎模型建立 实验小鼠给予2.5%的DSS饮用水直至小鼠体重降至80%以下。每日观测小鼠肠炎发病进展,检测小鼠体重、血便、下痢和生存率。
1.2.6重组IL-36α成熟肽干预DSS肠炎模型 实验组:在饮用DSS溶液的同时,腹腔注射重组IL-36α成熟肽[1 μg/(只·d),溶于100 μl PBS中];对照组:在饮用DSS溶液的同时,腹腔注射PBS溶液[100 μl/(只·d)]。按照之前建立的方法[9],DSS诱导肠炎的每天进行模型小鼠的疾病活动指数 (disease activity index,DAI)评分;于DSS肠炎诱导第5日,取结肠组织1 cm,4%多聚甲醛固定,进行组织病理学检测。
1.3统计学处理 利用GraphPad Prism 7.0软件完成统计分析,每组均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1IL-36α成熟肽基因工程菌构建 选择菌落PCR为阳性菌落提取质粒进行序列测定。经测序鉴定正确,即为重组小鼠IL-36α成熟肽基因工程菌。测序结果如图1所示。
图1 pET28a-muture IL-36α质粒测序结果Fig.1 Recombinant pET28a-muture IL-36α plasmid seq-uencing results
2.2重组小鼠IL-36α成熟肽的诱导表达 诱导表达后收集的菌体用PBS重悬,将获得的菌体采用超声破碎法裂解,离心收集上清液和沉淀分别制样做SDS-PAGE分析,结果如图2所示,IPTG诱导后,经鉴定的重组小鼠IL-36α基因工程菌可表达IL-36α成熟肽,且其主要存在于上清中。通过Image Lab软件分析可知,诱导温度为20℃,蛋白表达量约为16℃蛋白表达量的1.3倍。因此,优选20℃作为后续实验的蛋白诱导表达温度。
2.3重组小鼠IL-36α成熟肽的纯化 重组小鼠IL-36α成熟肽基因工程菌在20℃诱导表达后,离心收集菌体,PBS重悬,超声破碎法裂解菌体,离心收集上清液,使用Ni-Agarose His标签蛋白纯化试剂盒进行蛋白纯化,收集洗脱下来的样品做SDS-PAGE分析,结果如图3所示,经Ni-NAT纯化,可获得纯度95%以上的IL-36α成熟肽。

图2 重组小鼠IL-36α成熟肽的表达结果Fig.2 SDS-PAGE results of expression of recombinant mouse IL-36α mature peptideNote:M.Protein maker;1.Total bacterial protein without induction;2.Total bacterial protein induced by IPTG at 16℃;3.Protein in supernatant after bacterial disruption at 16℃;4.Protein precipitated after bacterial disruption at 16℃;5.Protein precipitated after bacterial disruption at 20℃;6.Protein in supernatant after bacterial disruption at 20℃;7.Total bacterial protein induced by IPTG at 20℃.

图3 小鼠IL-36α成熟肽的纯化结果Fig.3 SDS-PAGE results of mouse IL-36α mature peptide purificationNote:M.Protein maker;1.Protein in supernatant after bacterial disruption at 20℃;2.The protein eluted by 50 mmol/L imidazole;3.The protein eluted by 100 mmol/L imidazole;4.The protein eluted by 150 mmol/L imidazole;5.The protein eluted by 200 mmol/L imidazole;6.The protein eluted by 300 mmol/L imidazole.
2.4Western blot鉴定重组小鼠IL-36α成熟肽 由于我们构建的表达载体中IL-36α成熟肽与His-Tag融合表达,所以我们以小鼠抗His-Tag单克隆抗体为一抗,辣根过氧化物酶标记的山羊抗小鼠IgG为二抗进行Western blot分析来鉴定小鼠IL-36α成熟肽。结果表明制备的重组小鼠蛋白与抗体发生特异性反应,如图4所示显影后在底片上约17 kD处有一明显条带,证明了该表达产物为重组小鼠IL-36α成熟肽。

图4 Western blot鉴定重组小鼠IL-36α成熟肽Fig.4 Western blot analysis on recombinant mouse IL-36α mature peptideNote:M.Protein maker;1.Negative controls without expression of His-tagged protein;2.Positive protein controls expressing His-tagged protein;3.Recombinant mouse IL-36α mature peptide.
2.5IL-36α成熟肽减轻DSS诱导急性肠炎小鼠肠道炎症 如图5所示,与PBS处理组相比,IL-36α成熟肽处理组体重下降减慢,DAI评分明显降低,肠管缩短减少,组织损伤评分明显降低。这些指标变化说明给予重组IL-36α成熟肽治疗减轻了DSS肠炎模型小鼠的肠道炎症。
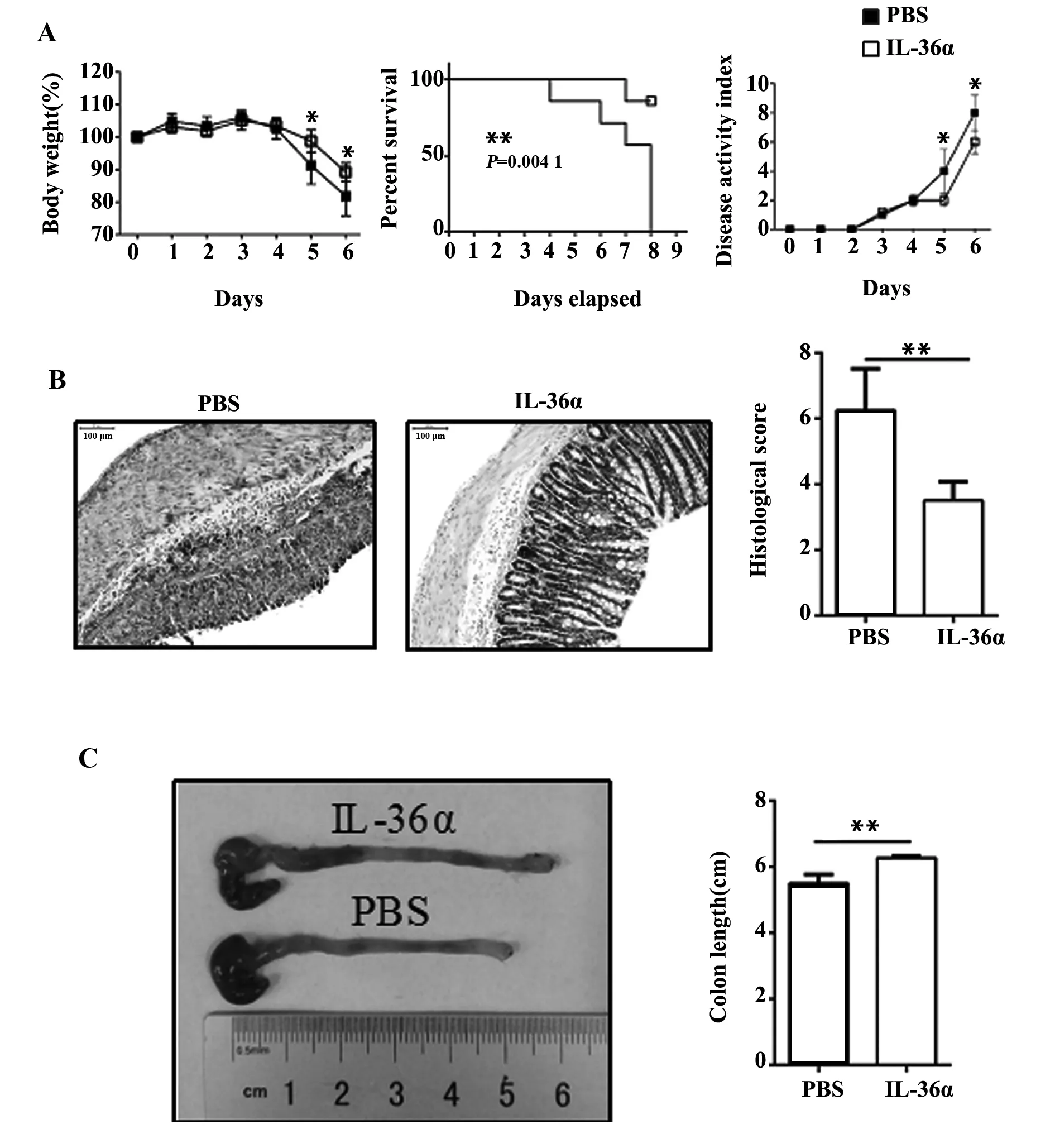
图5 给予IL-36α成熟肽减轻DSS诱导急性肠炎小鼠肠道炎症Fig.5 IL-36α mature peptide reduced intestinal inflamm-ation in mice with acute colitis induced by DSSNote:A.Weight loss,survival rate and disease activity index;B.Histological score (original magnification,×100);C.Macroscopic changes and colon length;Data indicate of 8 mice of each group obtained from a representative of three independent experiments (n=8 per group).*.P<0.05,**.P<0.01.
3 讨论
IL-36是新近发现的IL-1家族成员,IL-36 受体(IL-36 receptor,IL-36R)主要表达于CD4+T细胞和树突状细胞 (dendritic cells,DC)[10,11]。在TCR(T-cell receptor)介导的信号刺激下,IL-36/IL-36R信号能促进脾来源的CD4+T细胞的IL-4、IFN-γ和IL-17A的分泌[12]。IL-36/IL-36R信号可促进初始T细胞增殖和产生IL-2;IL-36β能够促使小鼠初始CD4+T细胞向Th1细胞分化[10]。IL-36与IL-36R结合后会招募共受体IL-1受体辅助蛋白(IL-1 receptor accessory protein,IL-1RAcP),进而引起细胞内MAPK和NF-κB活化等信号级联反应,促进T细胞活化、增殖与分化及相关细胞因子的分泌[13,14]。综上,IL-36/IL-36R信号主要调控T细胞应答。
IL-36α在多种炎症性疾病中发挥作用,包括:银屑病、类风湿性关节炎、系统性红斑狼疮及IBD[15]。最初IL-36α在银屑病中的作用研究较多。尽管受影响的主要组织存在明显差异,但银屑病和IBD之间可能存在一定程度的关联。牛皮癣患者IBD发病率增加,而IBD患者银屑病风险也增加了[16]。所以,IL-36α在IBD中的作用研究也逐渐兴起。Fonseca-Camarillog等[17]发现IL-36α在IBD患者肠组织中表达水平明显升高。此外,在小鼠肠炎模型的结肠黏膜中,研究人员同样发现了IL-36表达水平升高[18]。Russell 等[19]研究发现IL-36α的表达水平在UC患者和小鼠炎症性结肠黏膜中特异性升高。与野生型相比,IL-36R-/-小鼠在DSS诱导的急性结肠炎模型中表现出疾病严重程度降低,且固有免疫细胞在结肠固有层浸润减少。该结果说明IL-36R信号在IBD中发挥促炎作用。与该研究不同,Scheibe等[7]发现IL-36R-/-小鼠对DSS的急性结肠炎具有高度的易感性且伤口愈合能力下降。该结果说明IL-36R信号可能具有激活黏膜修复的功能。本研究发现给予重组小鼠IL-36α成熟肽能够减轻小鼠DSS肠炎的症状。综上所述,IL-36/IL-36R信号很有可能在IBD中发挥双重作用,但具体机制仍需进一步研究。
在本研究中,我们成功制备了具有生物学活性的重组小鼠IL-36α成熟肽,并初步验证了其在IBD中的作用,为进一步研究 IL-36α调节肠黏膜免疫的作用机制奠定了基础。
