肺炎克雷伯菌夹膜多糖激活AP-1诱导人支气管上皮细胞表达β-防御素-3①
2020-02-29曹二龙
肖 非 胡 智 阳 君 曹二龙 伍 仙
(邵阳学院医学检验学院病原生物学教研室,邵阳 422000)
肺炎克雷伯菌是社区获得性和医院感染最常见的革兰阴性细菌,也是慢性阻塞性肺疾病最常见的感染性细菌。肺炎克雷伯菌的主要毒力因子包括细菌表面成分荚膜多糖(capsular polysaccharide,CPS)和脂多糖(lipopolysaccharide,LPS)[1,2]。肺炎克雷伯菌CPS能经TLR4识别并诱导细胞因子分泌[1]。气道和肺部的上皮细胞是肺炎克雷伯菌面临的第一道防线。呼吸道上皮细胞不仅是一种被动的物理屏障,而且是呼吸道固有免疫反应的重要活性效应细胞。因此了解肺炎克雷伯菌CPS与人呼吸道上皮细胞之间的复杂分子相互作用,有利于明确宿主的抗感染免疫机制。抗菌肽是先天免疫系统的重要效应分子。它们是消除或抑制各种细菌、病毒、真菌和寄生虫的第一道防线[3]。除了其抗菌活性外,它们还具有多种免疫调节功能,在先天免疫系统和适应性免疫系统的相互作用中发挥网络调控作用[4,5]。在各类抗菌肽中,人β-防御素-3(hBD-3)在上皮免疫防御中起着特别重要的作用[6]。它对广谱的病原体有很强的抗菌作用。目前尚不清楚hBD-3在气道上皮细胞中的表达调控。尤其是hBD-3对肺炎克雷伯菌夹膜多糖的重要性尚不清楚。因此本研究旨在探讨肺炎克雷伯菌夹膜多糖对hBD-3表达的影响,并研究其调控机制。
1 材料与方法
1.1材料 人支气管上皮细胞株 BEAS-2B 购自 ATCC。小鼠抗人hBD-3多克隆抗体购自Abcam。小鼠抗人p38、ERK1/2、JNK1/2及c-Jun单克隆抗体购自Cell Signaling公司。SB203580、PD98059和SP600125以及PDTC 购自Sigma-Adrich。DMEM培养基Invitrogen公司,细胞蛋白提取试剂盒、蛋白浓度测定试剂盒购自Thermo 公司。
1.2方法
1.2.1肺炎克雷伯菌的培养与夹膜多糖提取 肺炎克雷伯菌用含有100 μg/ml氨苄青霉素或50 μg/ml卡那霉素的LB培养基中培养。按照参考文献[1]提供的方法提取CPS。即100℃加热培养肺炎克雷伯菌以释放其荚膜成分。随后加入丙酮沉淀CPS。经RNase B(30 μg/ml)和DnaseⅠ(70 μg/ml)及链霉蛋白酶溶液(含10 mmol/L Tris HCl,pH7.4,1 mmol/L CaCl2)消化后用50 kD的透析膜对样品进行透析、冻干。CPS粗提物随后在TSK HW-65F柱上进一步纯化并采用苯酚-浓硫酸法测定CPS的浓度。刺激细胞前采用2-酮基-3-脱氧辛酸(KOD)-硫代巴比妥酸法测定CPS中LPS的含量以排除LPS污染。
1.2.2细胞培养与处理 BEAS-2B细胞用有10%胎牛血清和青霉素-链霉素的DMEM培养基于37℃,5% CO2培养。当细胞生长至80%~90%密度时,加入0.1~10.0 μg/ml CPS孵育24 h。
1.2.3实时定量PCR检测 mRNA表达 通过逆转录测定上皮细胞中hBD-3 mRNA的水平,然后进行实时定量PCR。 使用TRIzol试剂提取总RNA。在 50 μl 反应体系中使用1 μg总RNA和随机六聚体进行逆转录反应。 使用Primer Express软件设计用于人hBD-3基因的引物和探针。 人hBD-3:正向引物,5′-GCCTCTTCCAGGTGTTTTTG-3′;反向引物:5′-GAGACCACAGGTGCCAATTT-3′。在ABI Prism 7700序列检测系统上进行PCR。 25 μl PCR反应含有30 ng cDNA,100 nmol/L荧光探针和200 nmol/L引物。采用比较阈值循环(CT)方法,通过计算其与管家基因GAPDH的比值来确定相对基因表达水平。
1.2.4ELISA检测hBD-3蛋白表达 细胞处理结束后,采用Millipore公司提供的Amicon Ultra-15 Centrifugal Filter Unit试剂盒将上清液浓缩10倍,随后采用Phoenix公司提供的hBD-3试剂盒测定hBD-3的浓度,其原理基于双抗体夹心法,方法按照试剂盒提供的步骤进行。
1.2.5Western blot检测蛋白表达 经处理后的细胞样品用含有Triton X-100的缓冲液溶解,随后用SDS-PAGE分离,并转印至Hybond ECL膜(Amersham Biosciences)。经过封闭后,先后用特异性抗体和相应的HRP标记的二抗进行检测,最后化学发光、显影。
1.2.6RNA干扰 使用非特异性siRNA(siRNA control,NWG Biotech)和特异性TLR4靶向siRNA(Ambion)进行RNA干扰实验。按照参考文献[7]提供的方法,采用Amaxa公司提供的Nucleofector试剂盒,将2 μg(约25 nmol/L)siRNA转染至106个细胞内。
1.2.7染色质共沉淀实验 按照参考文献[8]提供的方法进行染色质共沉淀。即,细胞裂解并经超声处理后,加入蛋白A/G琼脂糖收集免疫复合物,用RIPA缓冲液和高盐缓冲液彻底清洗后,随后用洗脱缓冲液提取免疫复合物并用RNA酶消化。加入蛋白酶K在37℃消化6 h后,再置于65℃消化6 h。采用Qiagen公司提供的PCR纯化试剂盒提取DNA,最后用Taq DNA聚合酶(Sigma)对hBD-3启动子DNA进行了扩增,所用引物序列为5′-TCCCAGACACCCTT-3′(正向)和5′-TTCCAGCCAGCCATT-3′(反向)。

2 结果
2.1肺炎克雷伯菌CPS诱导BEAS-2B细胞表达hBD-3 mRNA和蛋白 BEAS-2B细胞给予0.1 μg/ml、1.0 μg/ml和10 μg/ml CPS孵育24 h后,实时定量PCR结果显示,与阴性对照组相比,hBD-3 mRNA表达水平随之增高,呈一定的浓度依赖性(图1A)。此外,培养上清中hBD-3蛋白水平也具有类似的趋势(图1B)。

图1 不同浓度CPS对hBD-3 mRNA和蛋白表达的影响Fig.1 Effects of different concentrations of CPS on expr-ession of hBD-3Note:*.P<0.05 vs 0 μg/ml group(Control group).
这表明肺炎克雷伯菌能诱导BEAS-2B细胞表达hBD-3。
2.2TLR4介导肺炎克雷伯菌CPS诱导BEAS-2B细胞hBD-3表达 为了探讨CPS诱导hBD-3表达是否经TLR4介导,首先采用siRNA干扰BEAS-2B细胞上TLR4表达(图2A),随后ELISA测定培养上清中hBD-3的表达量,结果显示,沉默TLR4后,CPS诱导hBD-3表达显著减少(图2B)。

图2 沉默TLR4对CPS诱导hBD-3表达的影响Fig.2 Effect of silencing TLR4 on CPS-induced hBD-3 expressionNote:A.RNA interference effect;B.Interfering with the effect of TLR4 on hBD-3 expression.Compared with control group(0 μg/ml),*.P<0.05;compared with the control siRNA group,#.P<0.05.
2.3肺炎克雷伯菌CPS经丝裂原蛋白活化激酶诱导BEAS-2B细胞表达hBD-3 TLR4与相关配体结合后,可激活下游丝裂原活化蛋白激酶(MAPKs)通路如p38、JNK和ERK[9]。Western blot结果显示,10 μg/ml CPS处理30 min后均可激活p38、JNK和ERK,并持续至120 min(图3A)。而采用25 μmol/L p38和ERK抑制剂SB203580及PD98059处理细胞后,hBD-3无明显影响,而采用25 μmol/L JNK抑制剂SP600125处理后,hBD-3分泌明显降低(图3B)。
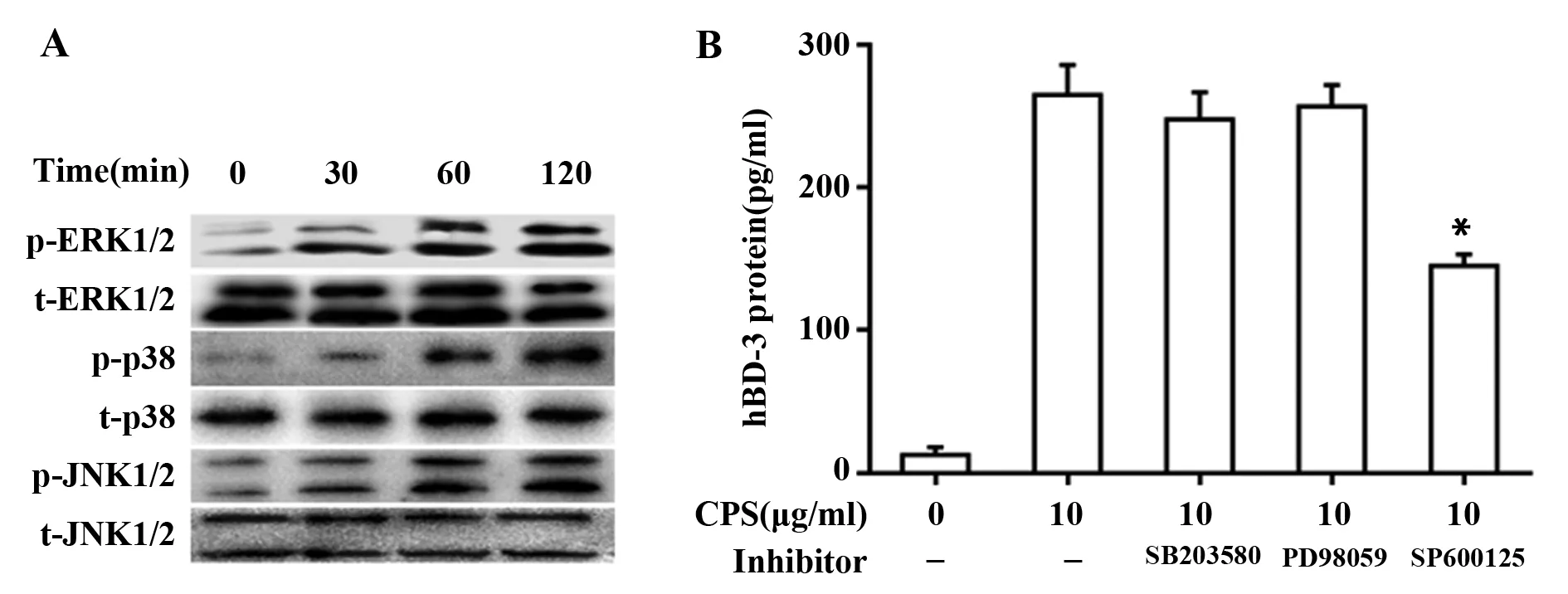
图3 MAPKs介导CPS诱导hBD-3分泌Fig.3 MAPKs mediate CPS-induced secretion of hBD-3Note:A.CPS induced MAPKs phosphorylation;B.MAPKs inhibitors on CPS-induced hBD-3 expression.Compared with control group(0 μg/ml),*.P<0.05.
2.4AP-1参与调控hBD-3表达 研究表明,肺炎克雷伯菌可激活NF-κB。但采用NF-κB抑制剂PDTC预处理细胞后,对hBD-3表达无明显影响(图4A),相比之下,CPS可诱导AP-1亚基c-Jun磷酸化(图4B)。染色质共沉淀结果证实,CPS处理后可显著增强AP-1与hBD-3启动子的结合(图4C)。
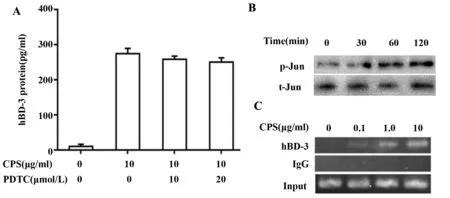
图4 肺炎克雷伯菌CPS经AP-1诱导hBD-3表达Fig.4 K.pneumoniae CPS induces hBD-3 expression via AP-1
3 讨论
病原微生物感染后,可诱导肺上皮细胞hBD-3的分泌,后者对多种病原体具有杀菌作用。细菌性肺炎患者中,血清中hBD-3水平明显增高[10]。由于hBD-3具有广泛的抗菌和免疫调节功能,它在宿主保护肺抵抗细菌病原体方面起着重要作用。在本研究中,我们发现肺炎克雷伯菌毒力因子夹膜多糖可诱导肺上皮细胞中的hBD-3分泌。在浓度1~10 mg/ml 的情况下,hBD-3被证明具有很强剂量依赖性。虽然细胞上清液中的hBD-3浓度仅在pg/ml范围内检测到,但目前还不清楚体内人呼吸道肺炎克雷伯菌感染所引起的分泌型hBD-3的浓度,而本研究发现肺炎克雷伯菌CPS刺激的细胞中hBD-3分泌量比基础水平增加了近20倍。这表明肺炎克雷伯菌CPS可有效上调hBD-3的表达,但hBD-3在体内的抗菌活性还有待进一步探讨。
病原微生物感染后,首先被宿主细胞膜上的Toll样受体识别[11,12]。参与识别细菌的主要模式识别受体是TLR2和TLR4。TLR2主要识别细菌的各类脂蛋白,而TLR4主要识别多糖[13]。有研究表明,肺炎克雷伯菌CPS可通过TLR4诱导人单核细胞表达促炎性细胞因子[1]。本研究通过RNA干扰TLR4后发现,CPS对hBD-3的诱导能力明显降低。这表明hBD-3受TLR4的介导。TLR4激活后,可活化丝裂原活化蛋白激酶如p38、ERK1/2和JNK,但本研究发现尽管CPS可诱导p38、ERK1/2和JNK磷酸化,但采用p38和ERK1/2抑制剂处理后,对hBD-3的诱导水平并无显著影响,而抑制JNK后,hBD-3水平显著降低,这表明JNK直接参与hBD-3的表达。本研究的另一个发现是NF-κB并不参与调控CPS诱导hBD-3表达,相比之下,hBD-3主要受AP-1的调控,本研究通过检测c-Jun磷酸化以及染色质共沉淀也证实了这一点。
综上所述,本研究证实肺炎克雷伯菌致病物质CPS可诱导气道上皮细胞表达hBD-3,后者可能是机体拮抗并清除病原微生物的机制。该机制有赖于TLR4/JNK/AP-1通路,最终导致hBD-3的表达而参与免疫应答。
