ER stress活化促进星形胶质细胞NLRP3表达和IL-1β合成分泌
2020-02-29夏龙飞刘运江
洪 洋 刘 彬 夏龙飞 贾 佳 刘运江
(河北医科大学第四医院,石家庄 050000)
阿尔兹海默病(Alzheimer′s disease,AD)又称老年痴呆,是以记忆和认知功能障碍为主要特征的中枢神经系统退行性病变[1]。越来越多的证据表明Aβ诱导的神经炎症反应能够导致认知能力下降和神经功能退化[2],Aβ脑内的沉积可能是诱发包括星形胶质细胞在内多种神经细胞功能失调的主要原因,明显影响到星形胶质细胞间的信息加工和传导能力,并导致大范围的脑内神经炎症反应[3]。这就提示我们,调节星形胶质细胞功能可能成为治疗大脑神经炎症反应的重要靶点。
多种证据表明,内质网应激(endoplasmic reticulum stress,ER stress)的产生与AD之间的联系是多样的也是复杂的。ER作为一种重要的细胞器调节着细胞内蛋白质的合成代谢功能。多种病理学改变都会诱导ER stress的形成,主要表现为ER分子伴侣蛋白的形成和未折叠蛋白反应(unfolded protein response,UPR)的激活。当UPR过度或持久激活时,最终则会诱导细胞功能性紊乱甚至细胞死亡[4]。越来越多的证据显示,AD患者脑内和动物模型中,在ER部位附近聚集大量Aβ蛋白,从而诱导ER stress的持久性激活,导致GRP78、ATF4的大量表达,进而影响蛋白质的合成[4,5]。目前Aβ蛋白诱导神经毒性的具体机制尚不完全清楚,但是ER功能障碍有可能在Aβ蛋白引起星形胶质细胞异常活化以及炎症反应的发生中发挥重要调节作用。
1 材料与方法
1.1材料 Aβ1-42片段,ER stress抑制剂Salubrinal(Sal),ER stress促进剂Tunicamycin(TM)均购置美国Sigma公司(St.Louis,MO,USA),DMEM培养液和胎牛血清FBS购置Gibco(Carlsbad,CA,USA),GRP78、NLRP3、pro-IL-1β、β-actin抗体购置Cell Signaling公司(Beverly,MA,USA)。羊抗兔/FITC多克隆抗体购置 Bioss公司(Beijing,China)。
1.2方法
1.2.1原代星形胶质细胞培养 星形胶质细胞来源于新生SD大鼠大脑皮层,无菌条件下破碎组织,制备单细胞悬液,37℃,5%CO2条件下孵育培养,每2 d更换培养液,待细胞充分覆盖后,37℃震荡去除多余小胶质细胞,应用免疫荧光染色法鉴定星形胶质细胞纯度(纯度>95%),纯化后的细胞分别接种于细胞培养板(用于ELISA、免疫荧光、Western blot试验)。
1.2.2ELISA检测 取正常培养星形胶质细胞,经过干预处理后,应用ELISA试剂盒检测细胞上清IL-1β的分泌水平改变。首先,建立1 000、500、250、125、62.5、31.25、15.625和0 pg/ml标准曲线。然后取上清100 μl加入到预先孵育抗IL-1β培养板内。根据试剂盒说明书要求,分别要求依次加入检测试剂。最后应用酶标仪在450 nm处检测细胞上清IL-1β浓度。
1.2.3Western blot检测 取星形胶质细胞裂解后提取总蛋白,BCA蛋白试剂盒计算蛋白含量。取提取蛋白分别制备10%或15%SDS分离胶分离蛋白,并通过半干转法转移至PVDF膜。PVDF膜应用5%脱脂奶粉封闭,4℃分别孵育GRP78、pro-IL-1β和NLRP3抗体过夜,室温孵育二抗2 h,ECL光化学显色。最后应用Image J分析软件对扫描条带进行定量分析。
1.2.4免疫荧光检测 取4%甲醛固定星形胶质细胞,0.05% Triton X-100和3%BSA封闭打孔,4℃分别孵育GRP78、NLRP3抗体过夜,室温孵育二抗2 h,DAPI进行核染色,应用荧光显微镜检测细胞。
1.2.5药物干预与分组 取正常培养星形胶质细胞,随机分为对照组、Aβ组(5 μmol/L)、TM组(5 μmol/L)、Sal处理组(10 μmol/L)。Aβ组给予多聚化Aβ1-42干预6 h;TM处理组应用TM干预处理2 h;Sal处理组应用Sal预处理1 h,然后与Aβ共处理6 h。对照组给予DMEM培养基对照处理。

2 结果
2.1Aβ促进星形胶质细胞GRP78表达 前期预实验研究发现,Aβ处理6 h,星形胶质细胞开始出现早期的神经炎症反应。为了研究Aβ干预早期星形胶质细胞内病理学改变。我们应用Aβ处理星形胶质细胞6 h。免疫荧光结果显示(图1A),相比CTL组,Aβ组星形胶质细胞体积出现明显膨胀,在胞内ER stress相关蛋白GRP78出现了大量表达,在胞浆和胞核附近均出现明显大量聚集。Western blot结果显示(图1B),相比对照组,Aβ显著促进了星形胶质细胞GRP78表达(P<0.05)。


图1 Aβ促进星形胶质细胞GRP78表达
Fig.1 Aβ induced GRP78 expression in astrocytes
Note: A.Immunostained against antibodies GRP78 (green),DAIP was used to stain nuclei (blue);B.Compared with control group,*.P<0.05,the difference was statistically significant.
2.2ER stress活化促进星形胶质细胞IL-1β合成分泌 ELISA结果显示(图2),相比对照组,Aβ组和TM组IL-1β分泌水平均出现明显增加(P<0.01);相比Aβ组,TM组IL-1β分泌水平未出现明显差异(P>0.05)。研究结果说明,ER stress诱导剂TM促进了星形胶质细胞分泌IL-1β。
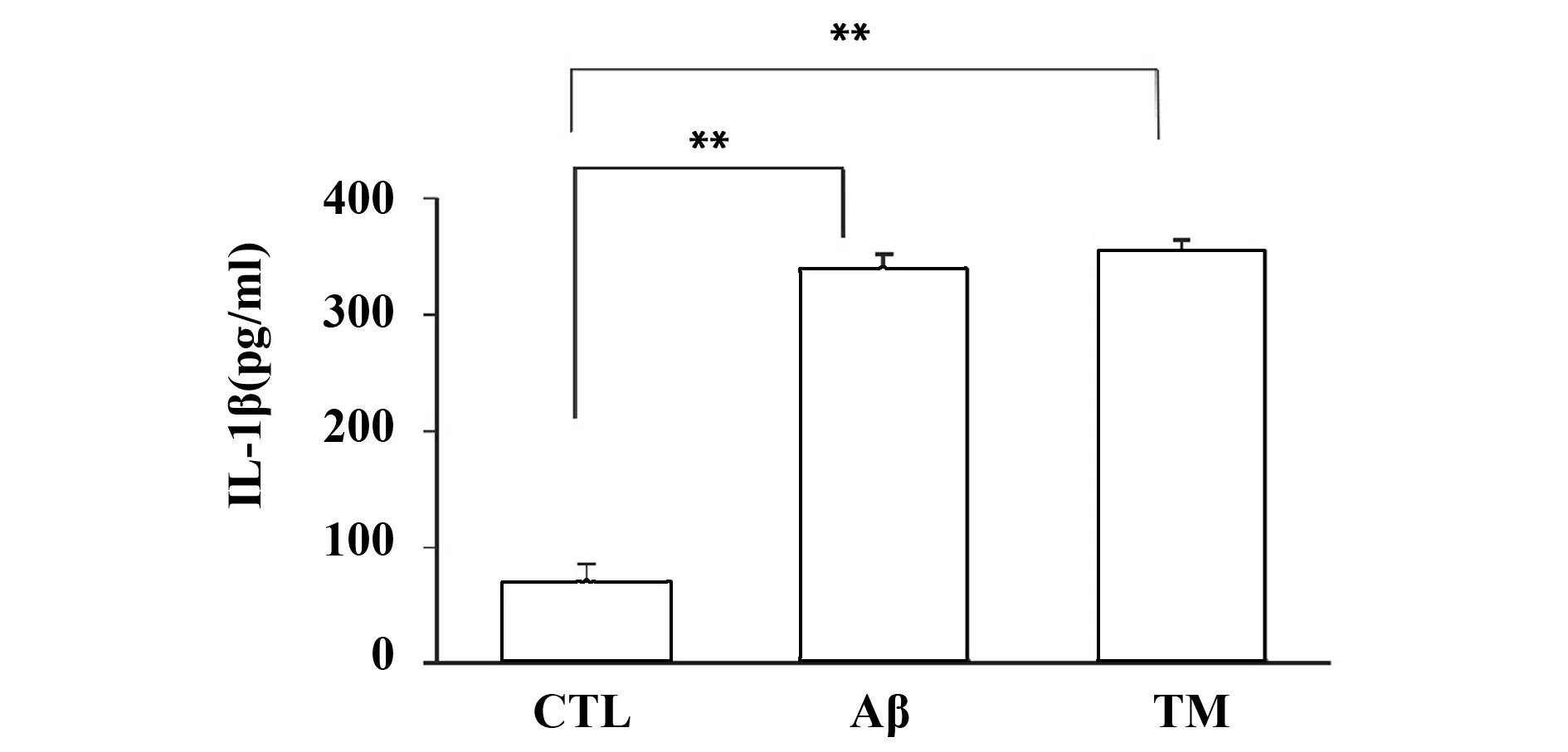
图2 ER stress活化促进星形胶质细胞IL-1β分泌Fig.2 ER stress activation induced IL-1β secretion in astrocytesNote:**.P<0.01,compared with control group,the difference was statistically significant.
2.3ER stress活化促进星形胶质细胞pro-IL-1β表达 Western blot结果显示(图3),相比对照组,Aβ和TM均促进了星形胶质细胞pro-IL-1β表达(P<0.05)。研究结果说明,ER stress活化促进星形胶质细胞成熟型pro-IL-1β片段的表达。
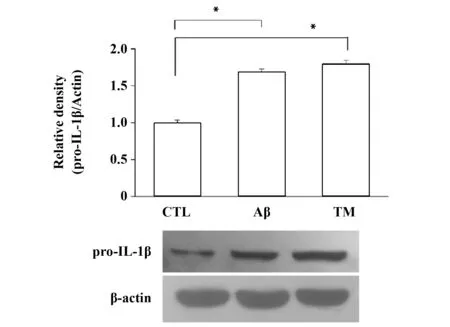
图3 ER stress活化促进星形胶质细胞pro-IL-1β表达Fig.3 ER stress activation induced pro-IL-1β expression in astrocytesNote:*.P<0.05,compared with control group,the difference was statistically significant.
2.4ER stress抑制剂Sal抑制星形胶质细胞NLRP3表达活化 Western blot结果显示(图4A),相比对照组,Aβ组明显促进星形胶质细胞NLRP3表达活化(P<0.05)。ER stress抑制剂Sal显著抑制了Aβ所诱导NLRP3表达(P<0.05)。另外,免疫荧光结果显示(图4B),Aβ组星形胶质胞浆和胞核附近均表达大量NLRP3。相比Aβ组,Sal组星形胶质细胞NLRP3表达出现明显减少。研究结果说明,Aβ通过调节ER stress活化促进星形胶质细胞NLRP3表达。


图4 Sal抑制星形胶质细胞NLRP3表达活化Fig.4 Sal inhibited NLRP3 expression in Aβ-induced astrocytesNote: A.*.P<0.05,compared with Aβ group,the difference was statistically significant;B.Immunostained against antibodies NLRP3 (green),DAIP was used to stain nuclei (blue).
3 讨论
神经炎症反应作为AD重要的病理学特征之一,非常易于在AD患者脑内易感区域发生,表现为大量促炎症调节因子的合成分泌[6]。这种炎症调节因子的大量分泌严重影响到AD的神经病理学特征,特别是引起记忆和认知功能的下降[7]。IL-1β是一个能诱发或加重多种细胞反应的主要促炎症细胞因子。IL-1β水平的提升被诸多研究者认为是与疾病发展密切相关,比如Ⅱ型糖尿病,癌症或是神经退行性疾病等[8,9]。研究证实,阻断或消除IL-1β信号通路,则明显改善AD认知功能异常状态并能有效调节AD病理学症状[10,11]。
星形胶质细胞在中枢神经系统内是数量最庞大的一类细胞。然而,当星形胶质细胞异常活化后会产生大量炎症调节因子,包括IL-1β、TNF-α以及COX-2等。事实上,当星形胶质细胞处于应激状态会导致其异常活化。我们前期预实验研究发现,Aβ处理6 h,星形胶质细胞开始出现异常活化状态,表现为早期的神经炎症反应。为了研究Aβ干预早期星形胶质细胞内病理学改变,我们应用多聚化Aβ1-42处理6 h。研究结果显示,星形胶质细胞体积出现明显膨胀,在胞浆中表达了大量ER stress相关蛋白GRP78并在胞浆和胞核附近出现大量聚集。多种证据表明,当ER stress过度或持久激活时,最终则会诱导细胞功能性紊乱甚至细胞死亡。ER stress发生时,与蛋白激酶(PKR-like ER kinase,PERK)结合的免疫蛋白结合蛋白GRP78会解离,并游离与胞浆中,使PERK蛋白磷酸化,进一步促使elF2α发生磷酸化修饰,从而引起蛋白质合成障碍,影响细胞正常功能[12]。因此我们推断,Aβ诱导星形胶质细胞ER stress活化与星形胶质细胞开始出现的异常活化状态存在潜在联系。
在NLRs家族中,NLRP3是最受专家学者关注的炎症小体之一。NLRP3炎症小体是由多种蛋白构成的复合物,包括核心蛋白NLRP3、调节分子ASC以及pro-Caspase-1组成。它常被看作是活化促炎症细胞因子IL-1β和IL-18的上游蛋白[13]。尽管NLRP3炎症小体在细胞分子内的调控机制尚未完全阐明,但是可以肯定的是,在溶酶体损伤[14],线粒体钙离子通量改变[15]以及氧化应激片段ROS形成[16]等应激条件下常常激活细胞内NLRP3大量合成。本研究发现,Aβ能够诱导ER stress在星形胶质细胞内激活,主要表现为GRP78的表达。为了证实本研究假设,我们应用ER stress诱导剂TM干预星形胶质细胞,结果显示TM能显著促进pro-IL-1β、IL-1β和NLRP3的表达合成。然而,ER stress抑制剂Sal显著抑制了Aβ诱导NLRP3表达。研究结果说明,Aβ通过调节ER stress活化促进星形胶质细胞NLRP3表达以及pro-IL-1β、IL-1β合成分泌。
综上所述,我们可以推断 Aβ在星形胶质细胞内的大量聚集能够诱导ER stress的激活并表现出来的早期神经炎症细胞毒性反应。因此,异常折叠蛋白所诱导ER stress的激活表现出NLRP3炎症小体所介导炎症信号的启动,并进一步诱发神经炎症因子的合成和分泌。
