松果菊苷改善脓毒症大鼠的肝损伤和炎症反应与激活Nrf通路相关①
2020-02-29兰戴天李茂德赵晓晨
兰戴天 何 力 李茂德 赵 源 赵晓晨
(四川省医学科学院·四川省人民医院普外科,成都 610100)
脓毒症是一种由宿主对感染的反应失调引起,可导致全身炎症和多器官功能障碍综合征的致命性疾病。尽管使用了积极的外科治疗、特定的抗生素和其他药物制剂,脓毒症与住院死亡率相关性仍高于10%[1]。脓毒症发展和进展的主要病理生理机制在于中炎症介质和抗炎因子之间动态平衡的失调[2]。肝功能障碍和衰竭是脓毒症的传统并发症,影响内源性和外源性的生物转化和运输,是脓毒症的早期和频发事件[3]。虽然肝功能障碍的发生率比其他重要器官的功能障碍的发生率低40% 左右,但肝功能障碍患者的死亡率比脓毒症引起的呼吸系统功能障碍(最常见的器官功能障碍)患者的脓毒症死亡率高54%[4]。此外,有研究表明在肝病患者中,脓毒症的发病率比普通ICU患者高30%~50%[4]。考虑到肝脏在脓毒症发病、发展和结局中的关键作用,肝损伤是脓毒症患者临床管理中开发新的治疗工具的重要目标。松果菊苷(Echinaco-side,ECH)是一种从中国传统中药肉苁蓉中分离得到的苯乙醇苷类化合物(图1),具有抗氧化、抗炎、抗肿瘤、保护肝脏、保护神经、改善学习记忆及调节免疫等多种药理作用[5],因此,预测松果菊苷可改善脓毒症大鼠的肝损伤和炎症反应。本文主要研究松果菊苷对脓毒症大鼠的肝损伤和炎症反应的作用及机制。

图1 松果菊苷的结构式Fig.1 Structural formula of echinacoside
1 材料与方法
1.1材料 120 只体重为180~200 g的雌性Wistar大鼠,购自四川夏派森医药科技有限公司,许可证号:SYXK(川)2017-203。大鼠在25℃,12 h光照/12 h黑暗循环的饲养室,自由获取水和食物。在实验前1周开始适应性喂养。松果菊苷(HPLC≥98%,百灵威科技有限公司,货号:82854-37-3),地塞米松(上海联硕生物科技有限公司,货号:D1756),苏木素伊红(Hematoxylin eosin,HE)染色试剂、过氧化氢酶检测试剂盒、谷胱甘肽过氧化物酶活性检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒(索莱宝科技有限公司,货号:G1120、BC0200、BC1190、BC0170),总蛋白定量测试盒、白蛋白含量测试盒、碱性磷酸酶试剂盒、丙氨酸氨基转移酶、总胆红素、γ-谷氨酰环化转移酶、IL-1β、IL-6、TNF-α ELISA试剂盒(上海联硕生物刻科技有限公司,货号: ml016898、ml076981、ml016867、ml037336、ml016910、ml027458、ml037361、ml002813-1、ml00 2859),HMGB1 ELISA试剂盒(上海基免实业有限公司,货号: JM-ELISA-0126),TBARS试剂盒(上海起发实验试剂有限公司,货号:0801192)。
1.2方法
1.2.1给药及模型构建 将大鼠分为假手术组(Sham)、模型组(Model)、松果菊苷低剂量组(ECH-L)、松果菊苷中剂量组(ECH-M)、松果菊苷高剂量组(ECH-H)、阳性对照组(DEX),每组20只。在造模前1 h,通过尾静脉分别注射生理盐水、松果菊苷25、50、100 mg/kg[6]、地塞米松10 mg/kg[7]。通过盲肠结扎和穿刺(cecal ligation and puncture,CLP)模式诱导脓毒症[8]。简单地说,通过腹膜内注射15 mg/kg 氯胺酮和7.5 mg/kg甲苯噻嗪麻醉动物。然后,在前腹部正中切开3 cm,露出盲肠。将粪便拖至盲肠用5/0丙烯线结扎并固定在回盲部连接杆下方,但不能引起肠梗阻。用18号针头将盲肠穿刺10次并稍微挤压直至出现一小滴粪便。将盲肠重新放于腹腔,缝合伤口。假手术动物接受了相同的剖腹手术,但没有盲肠穿刺,并作为对照组。手术后不久,所有动物皮下注射2 ml 0.9% 氯化钠溶液。
1.2.2HE染色观察肝损伤 肝脏固定在10%福尔马林中,石蜡包埋,切成5 μm厚,二甲苯脱蜡,乙醇浓度降低时连续脱水。切片用苏木精-伊红染色,光镜下观察并使用ColorViewⅡ相机获取20个随机场(400倍放大)的图像,并由两名资深病理学家独立评估肝脏损伤的组织形态学。
1.2.3血清指标检测肝功能 根据所提供的试剂盒手册,评估血清总蛋白、白蛋白、天冬氨酸氨基转移酶(aspartate transaminase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT),总胆红素(total bilirubin,TBil)、碱性磷酸酶(alkaline phosphatase,ALP)和γ-谷氨酰转移酶(γ-glutamyl transferase,γ-GT)的水平来分析肝功能。
1.2.4肝脏氧化应激分析 根据所提供的试剂盒手册,肝脏组织中丙二醛(malondialdehyde,MDA)和巯基水平,以及抗氧化酶过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)的活性来分析肝脏氧化应激情况。
1.2.5炎症因子检测 按照ELISA试剂盒说明书操作:将样品加入各反应孔,37℃ 反应 45 min 。接着用洗涤液洗涤 4 次,再分别加入生物素标记IL-1β、IL-6、TNF-α、HMGB1的抗体,在37℃孵育30 min。洗涤后加链霉亲和素-HRP 混合均匀,在37℃ 反应 30 min。接着加入显色剂避光显色。最后加终止液终止反应,检测结果。
1.2.6流式细胞术分选CD8+和CD4+分离肝脏组织,将肝脏组织剪碎研磨,用200目钢网研磨过滤,用红细胞裂解液进行裂解 5 min,然后用33.75% Percoll分离纯化细胞,2 000 r/min离心20 min,再用0.5% BSA-PBS缓冲液重悬。用PMA和离子霉素刺激细胞4 h,并用针对PE-CD8和FITC-CD4的荧光缀合的抗体染色。 在FACS Calibur流式细胞仪中分析CD8+和CD4+细胞的频率。
1.2.7蛋白印迹法检测 在裂解缓冲液中提取总蛋白质,并用BCA测定试剂盒测量蛋白质浓度。将10 μg蛋白样品用10% SDS-PAGE分离后转移至PVDF膜上。 用5%脱脂奶粉封闭膜,然后用一抗(NQO1 1∶500、HO-1 1∶500、Nrf2 1∶1 000)在4℃ 封闭过夜,接着加入对应辣根过氧化物酶偶联的二抗室温孵育1 h,最后滴ECL曝光。以GAPDH为内参,使用Quantity One软件进行分析目标蛋白质的相对表达水平。

2 结果
2.1松果菊苷改善脓毒症大鼠的肝损伤 Sham组显示正常大鼠的肝组织没有炎症、坏死的迹象;Model组大鼠的肝脏组织存在着明显的水肿和炎症细胞的浸润;ECH各组随着给药浓度的增加,肝脏组织的水肿和炎症细胞浸润程度逐渐减轻(图2)。

图2 HE染色观察肝损伤程度Fig.2 Degree of liver injury was observed by HE staining
2.2松果菊苷改善脓毒症大鼠的肝功能 各组大鼠的血清总蛋白含量、γ-谷氨酰转移酶和天冬氨酸氨基转移酶活性无明显变化。与Sham组相比,Model组大鼠丙氨酸氨基转移酶和碱性磷酸酶活性、总胆红素含量明显增加(P<0.05,图3);与Model组相比,ECH-H组大鼠丙氨酸氨基转移酶和碱性磷酸酶活性、总胆红素含量明显减少(P<0.05,图3),其他各组无明显变化;说明高剂量的松果菊苷改善脓毒症大鼠的肝功能。
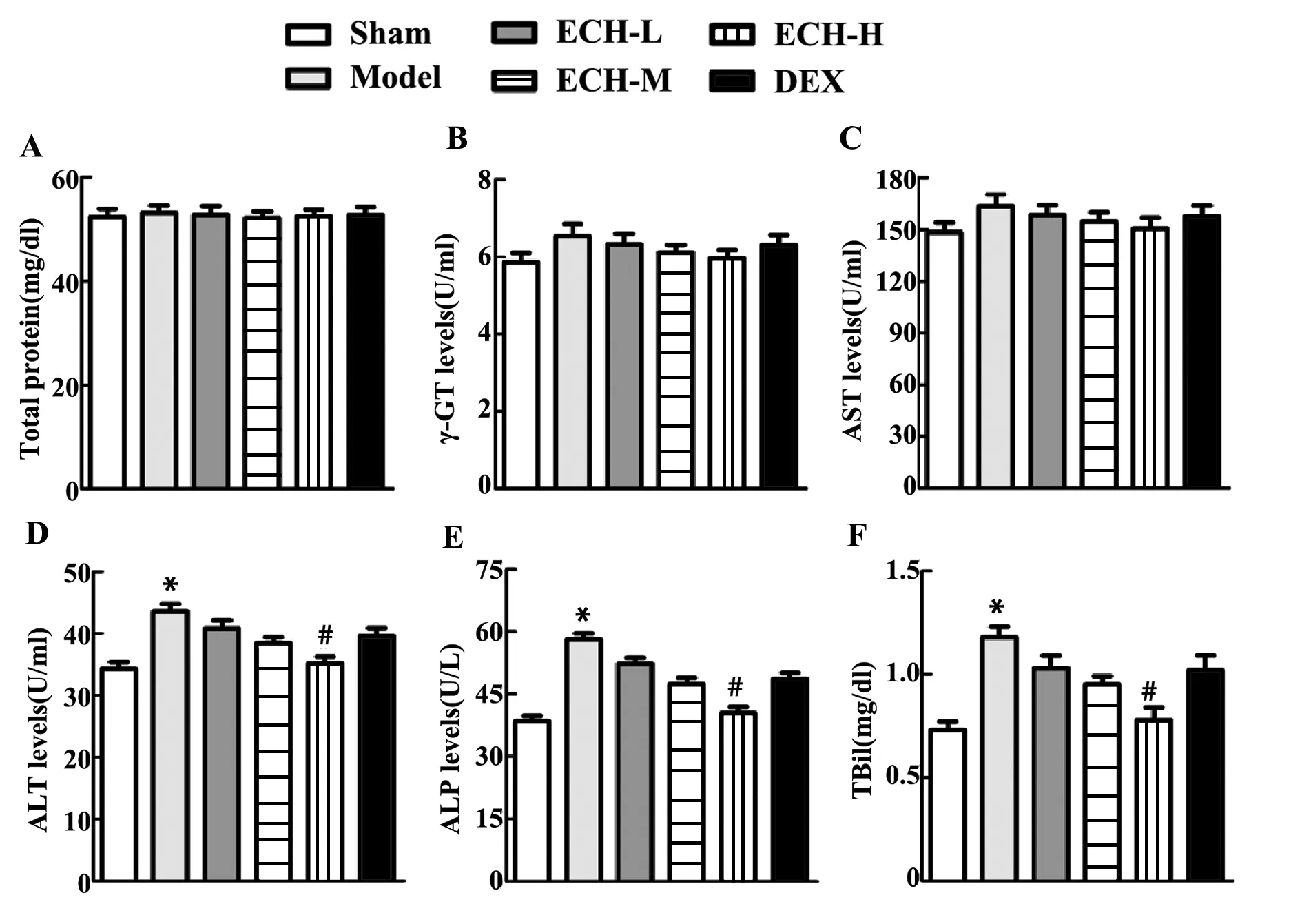
图3 通过试剂盒检测肝功能指标Fig.3 Liver function indicators detected by kitNote:A.Total protein content;B.γ-glutamyl transferase;C.Aspartate aminotransferase activity;D.Alanine aminotransferase activity;E.Alkaline phosphatase activity;F.Total bilirubin content;*.P<0.05 versus sham group;#.P<0.05 versus model group.
2.3松果菊苷改善脓毒症大鼠的肝氧化应激 与Sham组相比,Model组大鼠丙二醛含量明显增加,过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶明显减少(P<0.01,图4);与Model组相比,ECH-L组大鼠丙二醛含量、过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶活性无明显变化,ECH-M组大鼠丙二醛含量明显减少,过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶明显增加(P<0.05,图4),ECH-H组和DEX组大鼠丙二醛含量明显减少,过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶明显增加(P<0.01,图4);说明高剂量的松果菊苷和地塞米松一样能够改善脓毒症大鼠的肝氧化应激。
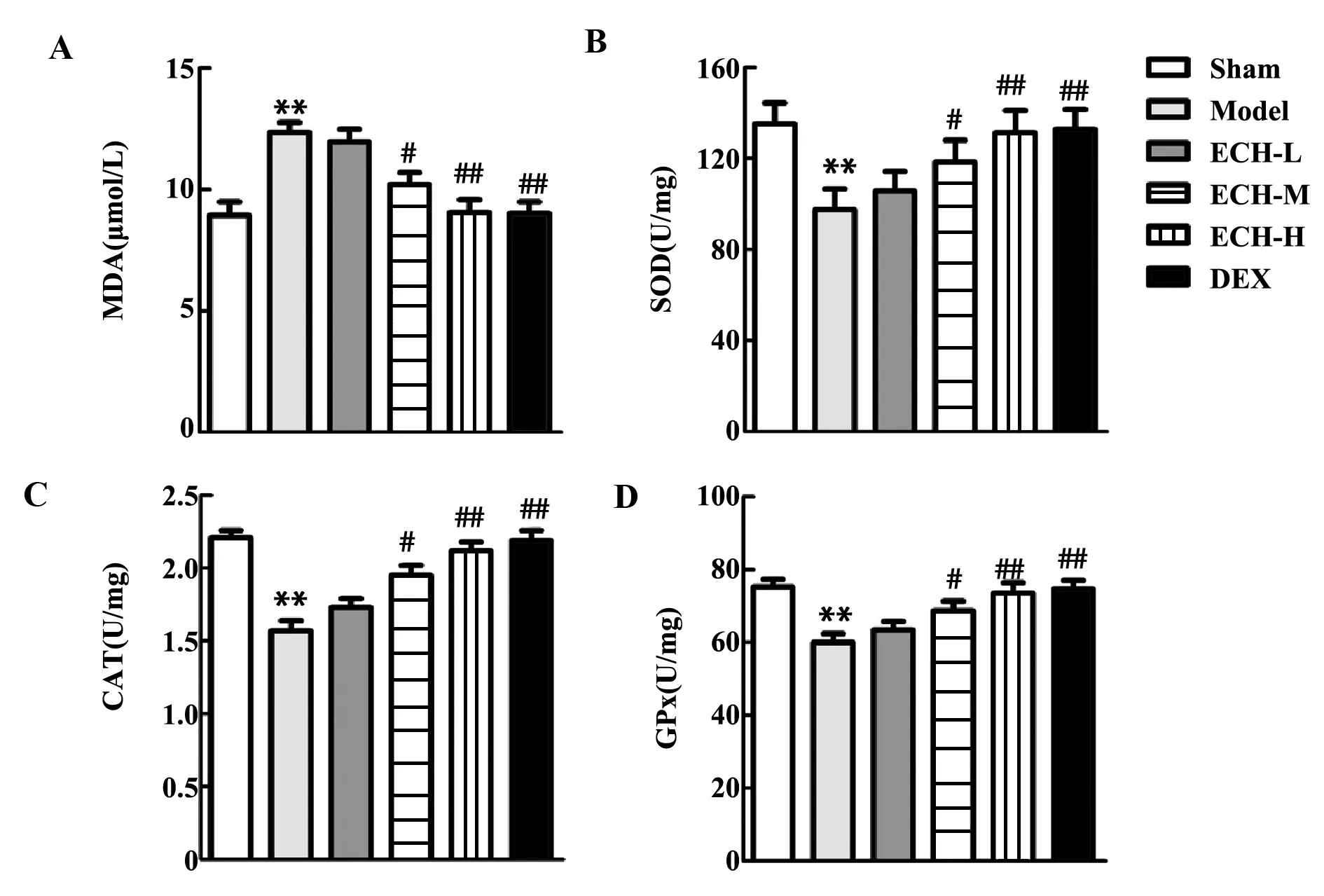
图4 通过试剂盒检测肝氧化应激水平Fig.4 Liver oxidative stress levels were detected by each kitNote:A.Malondialdehyde content;B.Superoxide dismutase;C.Catalase;D.Glutathione peroxidation;**.P<0.01 versus sham group;#.P<0.05,##.P<0.01 versus model group.
2.4松果菊苷改善脓毒症大鼠的炎症反应 与Sham组相比,Model组大鼠炎症因子TNF-α、IL-6、IL-1β、HMGB1含量增加,而CD4+、CD8+、CD4+/CD8+所占百分比均明显减少(P<0.01,图5、6);与Model组相比,ECH-L组大鼠炎症因子TNF-α、IL-6、IL-1β、HMGB1含量及CD4+、CD8+、CD4+/CD8+所占百分比无明显变化,ECH-M组大鼠炎症因子TNF-α、IL-6、IL-1β、HMGB1含量减少而CD4+、CD8+、CD4+/CD8+所占百分比明显增加(P<0.05,图5、6),ECH-H组和DEX组大鼠炎症因子TNF-α、IL-6、IL-1β、HMGB1含量减少、而CD4+、CD8+、CD4+/CD8+所占百分比明显增加(P<0.01,图5、6);说明高剂量的松果菊苷和地塞米松一样能够改善脓毒症大鼠的炎症反应。

图5 通过ELISA检测相关炎症因子表达水平Fig.5 Expression levels of inflammation-related factors were detected by ELISANote:A.TNF-α content was detected by ELISA;B.IL-6 content was detected by ELISA;C.IL-1β content was detected by ELISA;D.HMGB1 content was detected by ELISA;**.P<0.01 versus sham group;#.P<0.05,##.P<0.01 versus model group.
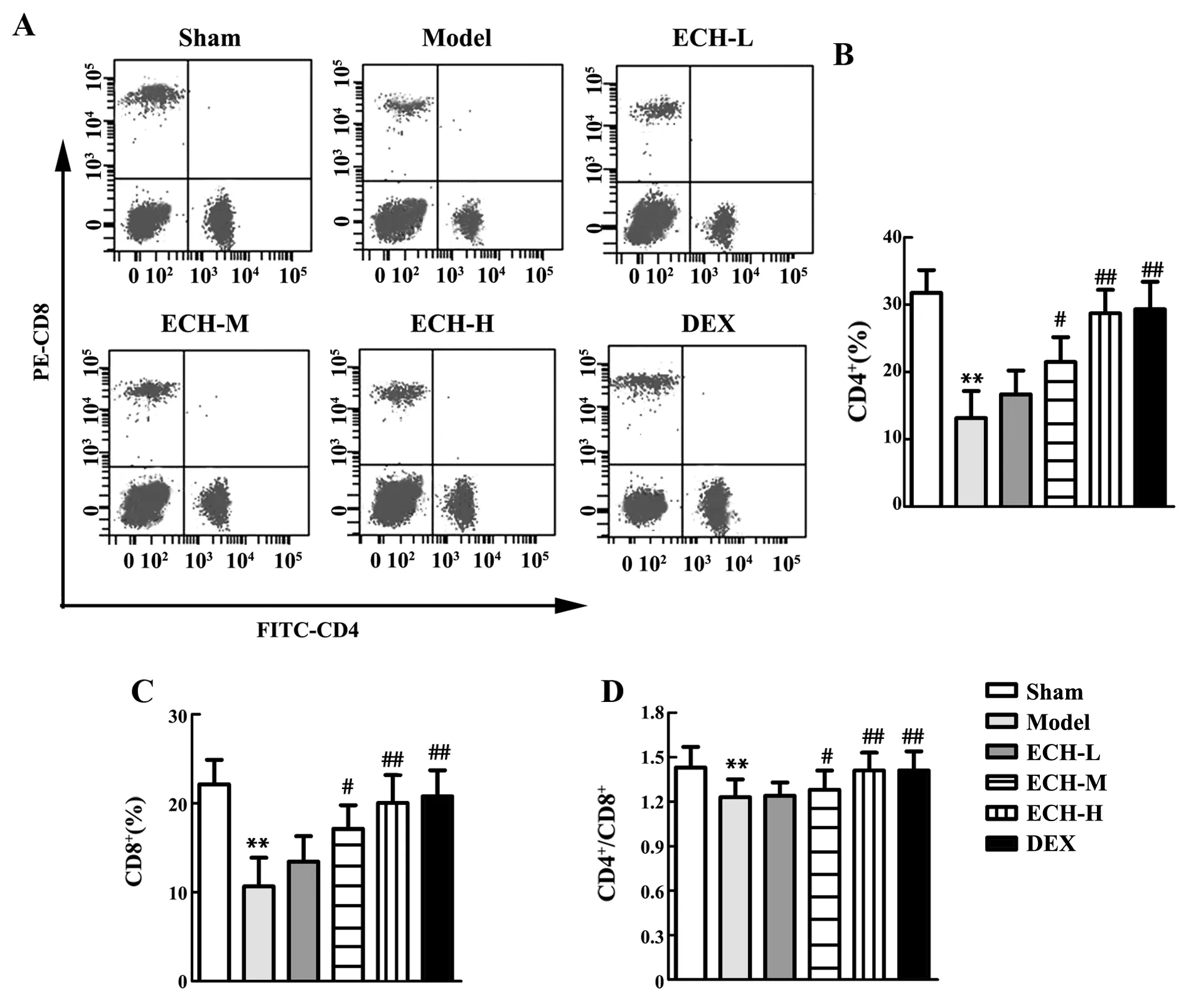
图6 通过流式细胞术检测肝脏CD8+和CD4+T细胞的比例Fig.6 Proportion of liver CD8+and CD4+T cells by flow cytometryNote:A.CD8+and CD4+were sorted by flow cytometry;B.Percentage of CD4+;C.Percentage of CD8+;D.CD4+/CD8+ratio;**.P<0.01 versus sham group;#.P<0.05,##.P<0.01 versus model group.
2.5松果菊苷激活脓毒症大鼠Nrf2信号通路 转录因子核因子红细胞2相关因子2(nuclear factor-erythroid-2-related factor 2,Nrf2)信号通路是治疗脓毒症所致肝损伤过程中关键信息通路,通过蛋白印迹检测Nrf2信号通路相关蛋白还原型辅酶/醌氧化还原酶[NAD(P) H:quinone oxidoreductase-1,NQO1]、血红素加氧酶-1(heme oxygenase-1,HO-1)、Nrf2表达发现:与Sham组相比,Model组大鼠NQO1、HO-1、Nrf2蛋白表达明显下调(P<0.01,图7);与Model组相比,ECH-L组大鼠NQO1、HO-1、Nrf2蛋白表达无明显变化,ECH-M组大鼠NQO1、HO-1、Nrf2蛋白表达明显上调(P<0.05,图7),ECH-H组大鼠NQO1、HO-1、Nrf2蛋白表达明显上调(P<0.01,图7);说明高剂量的松果菊苷激活脓毒症大鼠Nrf2信号通路。

图7 通过蛋白印迹检测NQO1、HO-1、Nrf2蛋白表达水平Fig.7 NQO1,HO-1,Nrf2 protein expression levels were detected by Western blotNote:**.P<0.01 versus sham group;#.P<0.05,##.P<0.01 versus model group.
3 讨论
脓毒症是由如内毒素、外毒素、病毒或成熟因子等多种因素引起的全身性炎症反应,可激活强大的免疫反应,甚至免疫失调,从而引起器官功能障碍和器质损害。尽管在治疗方法和重症监护方面有所改善,但脓毒症的发生率和死亡率仍在继续增加[9]。脓毒症患者通常发生多器官功能衰竭,肺、肝、肾和心脏是严重受影响的器官,有研究表明,每增加一个器官的衰竭,患者死亡风险增加15%~20%[10]。肝功能障碍是一种与脓毒症密切相关的临床并发症,并已作为严重脓毒症和感染性休克的重症患者高死亡率的有力预测因子[11]。本研究发现,松果菊苷能够明显降低脓毒症大鼠的丙氨酸氨基转移酶和碱性磷酸酶活性、总胆红素含量。其中,丙氨酸氨基转移酶被世界卫生组织推荐为肝功能损害最敏感的检测指标;碱性磷酸酶是一种经肝脏向胆外排出的酶,是诊断胆道系统疾病时常用的指标;总胆红素是胆汁的重要成分之一,临床上主要用于诊断肝脏疾病和胆道梗阻。且已有研究表明松果菊苷对小鼠急性肝损伤具有明显的保护作用[12],这与本文研究结果相一致。
有证据证实氧化应激是脓毒症的一个病理过程,它会损害细胞功能,最终导致多个器官功能障碍。因此,人们提出了几种抗氧化处理方法,并取得了成功。如,褪黑素通过抗氧化治疗脓毒症后肝功能损害[13]。本文研究表明松果菊苷能减少脓毒症大鼠肝组织中丙二醛含量,增加过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶活性,从而改善脓毒症大鼠的肝氧化应激,进而减轻脓毒症后肝功能损害。
脓毒症肝损伤的主要原因是炎症介质的过度生成。在脓毒症中,肝细胞尤其是库普弗细胞被微生物因子激活,激活库普弗细胞产生大量的炎症介质如IL-1β、IL-6和TNF-α等[14]。这些介质或被释放到体循环中介导多器官损伤,或通过旁分泌介导肝损伤与肝细胞和窦内皮细胞相互作用。已有研究表明,抑制肝脏炎症可减轻肝损伤,降低脓毒症的发病率和死亡率[15]。在脓毒症炎症的初始阶段,TNF-α是第一个释放的促炎因子。IL-1β和IL-6的持续增加表明脓毒症的预后不良。晚期的炎症反应可以通过单核巨噬细胞激活HMGB1的大量分泌。本文研究发现,松果菊苷能减少脓毒症大鼠肝组织中TNF-α、IL-6、IL-1β、HMGB1含量。促炎和抗炎不平衡导致脓毒症的发生,T淋巴细胞亚群在一定程度上可针对细胞免疫状态诱导相应的反应。脓毒症会引起CD4+和CD8+含量的下降,据报道,CD4+/CD8+下降表明脓毒症加重且预后较差[16]。CD4+T 细胞为辅助/诱导T淋巴细胞,其在细胞免疫反应方面作用的发挥主要是通过分泌细胞因子和趋化因子的激活和(或) 募集靶细胞来实现。CD4+T细胞在多种病原微生物脓毒症中具有启动免疫反应的作用,促进早期病原菌细胞的清除,从而减轻脓毒症引起的器官损伤[17]。CD8+T 细胞在抗胞内感染的免疫机制中,细胞杀伤效应占重要地位,能识别和溶解靶细胞,杀伤病原体,对细胞内病原体产生有效和持久的免疫应答。CD4+、CD8+的变化基本可以反映脓毒症患者的细胞免疫状况。本文研究发现,松果菊苷能增加脓毒症大鼠CD4+和CD8+含量,并增加CD4+/CD8+,说明松果菊苷能通过调节免疫反应来减轻脓毒症。
治疗脓毒症肝损伤的有效途径之一就是Nrf2信号通路,如骨髓间充质干细胞通过激活Nrf2信号通路改善脓毒症模型大鼠肝脏损伤[3]。Nrf2由NFE2L2基因编码,是碱性亮氨酸拉链转录因子。在静止条件下,Nrf2通过其阻遏型kelch样ECH相关蛋白1(Keap1)保持在细胞质中,并通过酶降解将其除去。当细胞暴露于氧化应激、炎症等有害攻击时,Nrf2从Keap1解离并转化为细胞核,在那里它与其下游基因启动子内的抗氧化反应元件(anti-oxidant response element,ARE)结合,包括尿苷5′-二磷酸葡萄糖醛酸转移酶,还原型辅酶/醌氧化还原酶[NAD(P) H:quinone oxidoreductase-1,NQO1],血红素加氧酶-1(heme oxygenase-1,HO-1),谷胱甘肽S-转移酶,谷氨酸半胱氨酸连接酶和谷胱甘肽过氧化物酶等[18]。这些基因中的大多数是重要的抗氧化酶和细胞保护基因。Nrf2通过与ARE结合可以上调NQO1的表达,进而调节抗氧化和炎症细胞因子。HO-1被认为是血红素降解的初始和限速酶的诱导型同种型,有助于免疫调节和抗炎功能,可以通过Nrf2核转位来调节氧化应激反应和炎症反应[19]。已有研究表明,松果菊苷通过Nrf2/HO-1依赖途径保护血管内皮细胞免受高糖诱导的氧化应激[20]。本文研究发现,松果菊苷改善脓毒症大鼠的肝损伤和炎症反应与激活Nrf通路相关。
综上所述,松果菊苷能够减轻肝损伤,改善肝功能、肝氧化应激和炎症反应,并激活Nrf通路,分子机制还有待进一步研究。本文为松果菊苷的开发利用提供参考数据,为脓毒症的预防和治疗奠定基础。
