miR-143-3p靶向TREM1基因对狼疮性肾炎小鼠肾小球系膜细胞炎性因子分泌及凋亡的调控机制
2020-02-29罗慧臣胡丹慧
罗慧臣 胡丹慧 张 济
(南华大学附属第一医院风湿免疫科,衡阳 421001)
系统性红斑狼疮是临床上常见的一种由遗传、免疫反应、激素、感染等因素共同作用的自身免疫性疾病[1]。狼疮肾炎(lupus nephritis,LN)是系统性红斑狼疮患者常见的并发症之一,也是引起患者残疾和死亡的重要因素[2]。LN常见的病理特征包括肾小球系膜细胞炎性因子的过度分泌、细胞增殖不断增加等[3]。因此探究LN中炎性因子的变化以及可能对其进行调控的途径对于明确LN的发病以及LN的治疗均具有重要意义。
髓细胞触发受体1基因(triggering receptor expressed by myeloid cells-1,TREM1)是多核细胞中的炎性受体,其能够向细胞内激活接头发出信号进而作用于下游通路[4]。TREM1也被称为炎性因子的放大器,在慢性炎症性肠炎等炎症疾病患者血清中表达显著提高[5]。也有研究证实TREM1在类风湿性关节炎的发病中发挥重要作用[6]。此外,中科院北京基因组研究所发现,TREM1的同源基因,TREML2可能对自身免疫性疾病的发病具有遗传影响[7]。个体免疫系统失调往往导致炎性反应,而炎症体在自身免疫性疾病中也发挥重要作用。miR-143经以往研究证实能够对多种炎症反应进行调节,如Pekow等[8]发现,miR-143在溃疡性结肠炎中表达被显著下调,miR-143的缺失能够促进慢性炎症的进展。也有研究证实,miR-143能够靶向ATG2B进而抑制克罗恩病中自噬和炎症反应[9]。本研究旨在探讨miR-143-3p靶向TREM1基因在狼疮性肾炎小鼠肾系膜细胞炎性因子分泌以及细胞凋亡中的作用并探讨其调节机制。
1 材料与方法
1.1材料 雄性MRL/faslpr小鼠及MRL/MPJ小鼠购自南京大学模式动物研究所;pcDNA3.1(+)质粒购自Addgene;高糖DMEM培养基购自北京索莱宝;所有抗体均购自ABCAM;荧光素酶试剂盒购自美国BioVision;Lipofectamin 3000试剂盒、CCK-8试剂盒、Annexin-V-FITC/PI细胞凋亡检测试剂盒购自美国赛默飞世尔;细胞裂解液、BCA试剂盒购自北京奥维亚生物技术有限公司;CytomicsTMFC 500流式细胞仪购自德国贝克曼;HBS-1096A酶标仪购自南京德铁实验设备有限公司;KH-FL20E液相色谱荧光检测器购自上海科哲生化科技有限公司;FRD-4C倒置显微镜购自北京世纪科信科学仪器有限公司。
1.2方法
1.2.1TREM1沉默载体构建 在NCBI的Nucleotide上获取小鼠TREM1的1号转录本全长序列(NM_021406.5),随后在BLOCK-iTTMRNAi Designer(http://rnaidesigner.thermofisher.com/rna-iexpress/)设计1对shRNA序列(5′-CACCGCCA-GACTTTGACAGTGAAGTCGAAACTTCACTGTCAAAG-TCTGGC-3′)及1对阴性对照序列(5′-CCGGCCTAA-GGTTAAGTCGCCCTCCTCGAGGAGGGCGACTTAAC-CTTAGGTTTTTG-3′),随后交由华大基因合成并在两端分别添加EcoRⅠ和BamHⅠ酶切位点。质粒pcDNA3.1(+)用EcoRⅠ和BamHⅠ酶切并回收大片段。取适量合成序列与大片段用T4 DNA连接酶连接过夜,温度4℃。随后转化至DH5α大肠杆菌中进行克隆,使用氨苄青霉素进行抗性菌落的筛选。经琼脂糖凝胶电泳鉴定后,采用DNA大量抽提试剂盒提取大肠杆菌中重组载体,冻存备用。
1.2.2肾小球系膜细胞分离纯化 雄性MRL/faslpr小鼠15只(狼疮性肾炎模型组)及健康雄性MRL/MPJ小鼠5只(正常对照组)购自南京大学模式动物研究所,周龄11~12周,体重18~22 g,于SPF级动物房适应性喂养1周,小鼠自由进食、饮水,饲养条件:相对温度(20±2)℃,相对湿度(50±2)%,阴暗和光照各12 h。每周收集24 h尿量,以尿八联试纸测定尿蛋白,浓度大于0.1~1 mg/L提示狼疮性肾炎发病[10]。发病小鼠和正常小鼠均腹腔注射1%戊巴比妥钠(60 mg/kg)溶液进行麻醉后处死。无菌收集小鼠两侧肾脏及外周血,随后将发病小鼠剥离肾皮质剪成1 mm × 1 mm的碎末并使用1 mg/ml胶原酶37℃水浴消化30 min。之后培养基终止消化;研磨消化产物后收集过筛液体并在4℃下1 000 r/min离心5 min。弃上清,加入含FBS的高糖DMEM培养基重悬肾小球细胞液。37℃,5%CO2条件下用Ⅰ型胶原蛋白包被过的培养皿孵育2 d。待培养皿中细胞汇合度为70%时,2.5 g/L胰酶消化2 min,随后迅速加入适量完全培养基终止消化,重复多次轻轻吹打细胞使其悬浮,之后置于37℃,5%CO2条件下继续培养。每隔36 h换液传代,传至4~6次即可得纯化的肾小球系膜细胞。本研究所有动物实验均经我院动物伦理委员会审批同意。
1.2.3免疫组化染色 制备发病及正常小鼠肾脏组织的石蜡切片,随后在60℃烘烤2 h,常规二甲苯脱蜡,梯度酒精脱水,PBS洗涤4次,每次2 min;高压抗原修复2 min,在pH6.0的0.01 mol/L柠檬酸缓冲液中浸泡3 h,水浴30 min;将切片浸泡于3%的双氧水溶液中15 min从而阻断外源过氧化物酶活性;室温下山羊血清封闭15 min,再与一抗TREM1在4℃条件下孵育过夜;PBS洗涤3次,每次2 min,室温下加入二抗IgG孵育30 min;反应产物用DAB显色3 min,再用流水冲洗3次,苏木素复染20 s,流水冲洗多余染液;梯度酒精脱水,二甲苯透明,中性树脂封片,显微镜下观察。对组织染色强度(SI)及阳性细胞率(PP)进行评分。SI分为4级:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。PP分为5级:0分为无阳性细胞<5%,1分为阳性细胞5%~25%,2级为25%~50%,3级为51%~75%,4级为>75%。综合评分为SI与PP乘积,0为阴性,1分为弱阳性(+),2分为中阳性(++),大于3分为强阳性(+++)[11]。
1.2.4双荧光素酶验证miR-143-3p与TREM1靶向关系 借助Targetscan靶向关系预测网站(http://www.targetscan.org/mamm_31/)预测miR-143-3p与TREM1的结合位点,双酶切将TREM1的3′UTR 片段克隆到荧光素酶报告基因pmirGLO上游,命名为TREM1-3′UTR-WT。挑菌、测序后提纯质粒备用。对miR-143-3p与TREM1的结合位点进行定点突变,构建TREM1-3′UTR-MUT突变载体。依据LipofectamineTM3000说明书,将miR-143-3p mimic和mimic NC分别与TREM1-3′UTR-WT及TREM1-3′UTR-MUT两两共转染至293T细胞。转染后4 h换液,在37℃、5%CO2的培养箱中培养48 h 后,收获细胞。按照Promega公司双荧光素酶报告基因试剂盒说明书中的要求,借助化学发光检测仪对荧光素酶活性进行检测。荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.2.5系膜细胞转染及分组 将狼疮性肾炎小鼠肾小球系膜细胞分为如下几组:mimic NC组(细胞转染含mimic NC的脂质体)、miR-143-3p mimic组(细胞转染含miR-143-3p mimic的脂质体)、sh-TREM1组(细胞转染含TREM1 shRNA质粒的脂质体)、sh-NC组(细胞转染含shRNA NC质粒的脂质体)、miR-143-3p mimic+sh-TREM1组(细胞共转染含TREM1 shRNA和miR-143-3p mimic的脂质体)
转染方式:将处于对数生长期的肾小球系膜细胞接种至6孔板,待细胞密度50%左右时依据Lipofectamin 3000说明书对细胞进行转染。首先使用250 μl不含血清培养基Opti-MEM分别稀释100 pmol miR-143-3p mimic(终浓度50 nmol/L)以及5 μl Lipofectamin 3000,混匀后室温孵育5 min,之后将以上混合物再次混合在一起,孵育20 min后加入细胞培养孔,5%CO2培养6~8 h,更换完全培养基培养24~48 h,进行后续实验。
1.2.6Western blot检测系膜细胞释放的炎性因子 于各组系膜细胞中加入1 ml细胞裂解液(裂解液组成:50 mmol/L Tris、150 mmol/L NaCl、5 mmol/L EDTA、0.1%SDS、1%NP-40、5 μg/ml Aprotinin、2 mmol/L PMSF),之后将其置冰浴上研成匀浆,加入蛋白裂解液,于4℃条件下裂解30 min,每隔10 min 振摇一次。4℃,12 000 r/min离心20 min,弃除脂层,取上清液采用BCA试剂盒测定每个样品的蛋白浓度,去离子水调整上样量为30 μg蛋白/泳道。配制10%SDS分离胶与浓缩胶。样品与上样缓冲液混合,100℃煮沸5 min,冰浴、离心后用微量加样器等量加入各泳道进行电泳分离,再将凝胶上的蛋白转移至硝酸纤维素膜上。5%脱脂奶粉4℃封闭硝酸纤维素膜过夜。加入稀释的一抗核因子κB p65(nuclear factor kappa-B p65,NF-κB p65)、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)或TREM1孵育过夜,室温下PBS 洗涤3次,每次5 min。滴加HRP标记的IgG二抗37℃振荡孵育1 h。室温下PBS缓冲液洗涤3次,每次5 min。膜与ECL液在室温下反应1 min。吸去液体,覆盖保鲜膜,拍摄X光片,观察结果。以GAPDH为内参,以目标条带与内参条带的灰度值之比作为蛋白质的相对表达量。
1.2.7CCK8测定系膜细胞活力 转染后细胞生长密度达到80%左右,PBS冲洗2遍,使用浓度为0.25%的胰酶消化细胞,之后将细胞悬液以4×103个/孔的密度接种至96孔板,各孔体积0.2 ml,每组设置6个复孔,分别在培养至24 h、48 h、72 h时取出培养板并加入含10%CCK8溶液(5 g/L)的培养基,继续培养4 h。吸取上清后每孔加入100 μl二甲基亚砜,振荡混匀使其充分溶解活细胞产生的甲瓒晶体。之后使用酶标仪对各孔490 nm处吸光度值进行检测并绘制细胞活力曲线,横坐标为时间点,纵坐标为OD值。
1.2.8PI单染法检测系膜细胞周期 各组细胞转染48 h后,0.25%胰酶消化细胞,1 000 r/min离心 5 min弃上清,冷PBS洗涤细胞3次,离心弃上清,PBS重悬细胞,调整其浓度在1×104ml-1左右。将2 ml 浓度为75%的乙醇置于-20℃预冷,之后用于固定细胞,4℃条件下固定30 min,离心后弃乙醇,PBS冲洗,之后加入100 μl RNase A,在37℃、避光条件下水浴30 min,加入400 μl PI染液,混匀后置于4℃避光条件下30 min,流式细胞仪记录激发波长在488 nm处红色荧光以检测细胞周期。
1.2.9Annexin-V FITC/PI双染检测系膜细胞凋亡 细胞转染48 h后,使用0.25%不含EDTA的胰酶消化细胞,1 000 r/min离心5 min,调整细胞浓度在1×104ml-1,取1 ml细胞悬液,离心后弃上清。冷PBS冲洗,再次离心弃上清。依据Annexin-V-FITC/PI试剂盒说明书,将Annexin-V-FITC、PI、HEPES缓冲液按照1∶2∶50的比例混匀配制Annexin-V-FITC/PI染液。100 μl染液重悬1×106个细胞,振荡混匀后室温孵育15 min。以488 nm波长激发515 nm、620 nm滤光片分别检测FITC、PI荧光从而检测细胞凋亡情况。左上象限代表细胞收集过程中的损伤细胞,左下象限代表正常细胞,右上象限为晚期凋亡细胞和坏死细胞,右下象限为早期凋亡细胞。

2 结果
2.1光镜下观察肾系膜细胞 倒置显微镜下观察分离纯化后传至5代的肾系膜细胞,可见细胞体积较大,多为多角形或梭形,胞质多突起,细胞核位于中央,多呈圆形或椭圆形。见图1。

图1 光镜下观察肾系膜细胞(×100)Fig.1 Mesangial cells were detected under optical microscope(×100)
2.2免疫组化染色结果 免疫组化染色检测狼疮性肾炎小鼠及正常对照肾组织中TREM1的表达。结果显示:TREM1主要表达于细胞核中。与正常小鼠相比(+),狼疮性肾炎小鼠肾组织中TREM1蛋白表达呈强阳性(+++)。见图2。

图2 TREM1蛋白在狼疮性肾炎小鼠肾组织中的表达(×100)Fig.2 Protein expression of TREM1 in kidney tissue of mice with LN(×100)
2.3miR-143-3p靶向下调TREM1表达 Targets-can预测发现miR-143-3p与TREM1存在结合位点。采用双荧光素酶报告系统验证两者靶向关系。结果显示:与共转染mimic NC与TREM1-3′UTR-WT相比,共转染miR-143-3p mimic与TREM1-3′UTR-WT的293T细胞中的荧光素酶活性显著下降(P<0.05),其余组则无显著变化(P>0.05)。同时,与mimic NC组相比,miR-143-3p能显著下调TREM1的蛋白表达(P<0.05)。见图3。

图3 miR-143-3p与TREM1的靶向关系验证Fig.3 Targeting relationship validation between miR-143-3p and TREM1Note:A.Prediction results through Targetscan;B.Verification results of dual fluorescein reporting system;C.Protein bands of TREM1;D.Quantification of TREM1 protein.Compared with group co-transfected with mimic NC and TREM1-3′UTR-WT,&.P<0.05;compared with mimic NC group,#.P<0.05.
2.4miR-143-3p靶向TREM1抑制系膜细胞炎性因子生成 系膜细胞的促炎因子的分泌是狼疮性肾炎最主要的病理改变。Western blot对各组系膜细胞NF-κB p65、TNF-α、IL-1β和MCP-1蛋白进行定量。结果显示:与mimic NC相比,miR-143-3p过表达后NF-κB p65、TNF-α、IL-1β和MCP-1因子的生成被显著抑制(P<0.05)。sh-TREM1组细胞较sh-NC组而言,其NF-κB p65、TNF-α、IL-1β和MCP-1表达显著下调(P<0.05)。TREM1沉默联合miR-143-3p模拟物能更加显著地抑制上述因子的表达(P<0.05)。见图4。
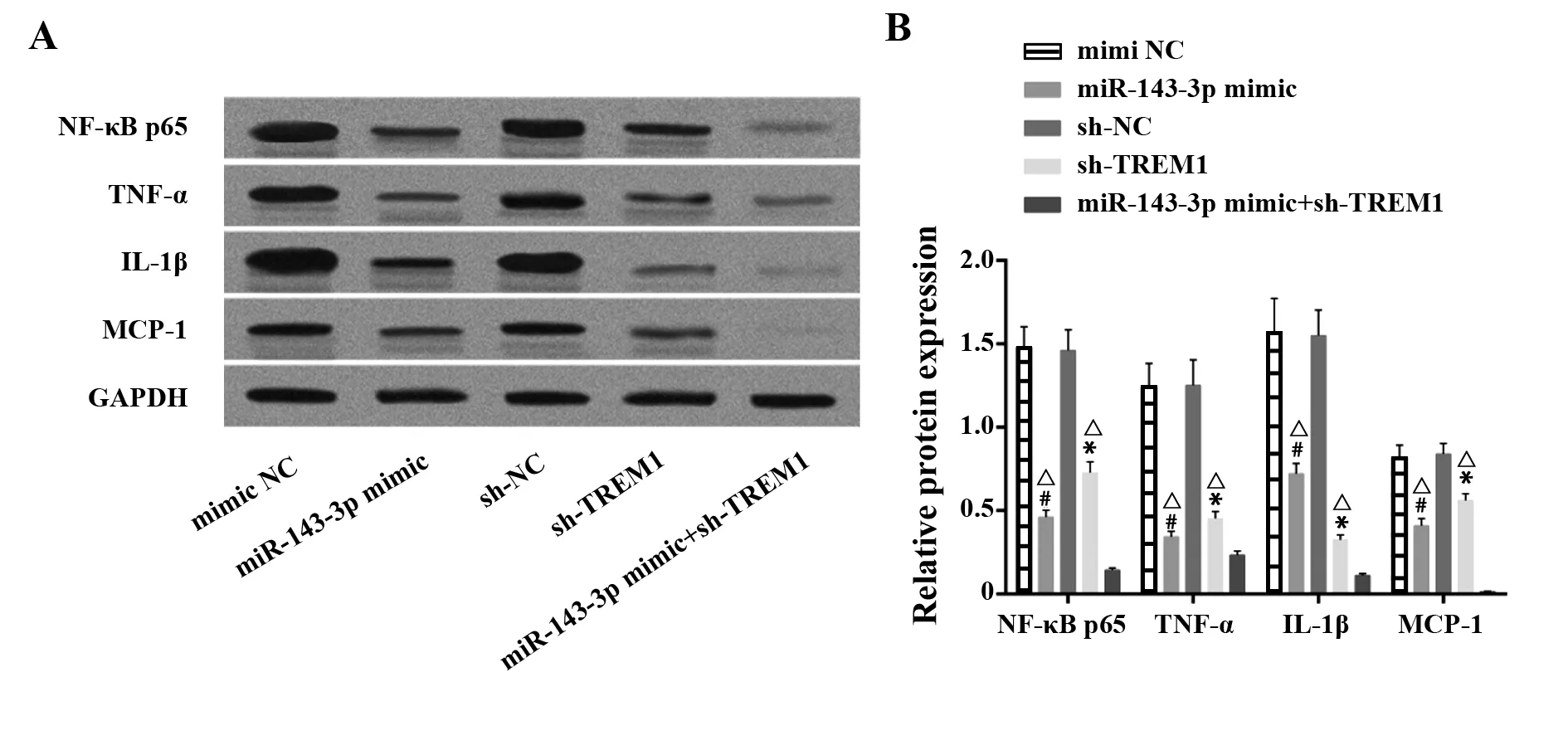
图4 NF-κB p65、TNF-α、IL-1β和MCP-1蛋白在系膜细胞中的表达Fig.4 Protein expression of NF-κB p65,TNF-α,IL-1β,MCP-1 in each group of mesangial cellsNote:A.Immunoblotting bands of NF-κB p65,TNF-α,IL-1β,MCP-1 in each group;B.Quantification of NF-κB p65,TNF-α,IL-1β,MCP-1.Compared with mimic NC group,#.P<0.05;compared with sh-NC group,*.P<0.05;compared with miR-143-3p mimic+sh-TREM1 group,△.P<0.05.
2.5miR-143-3p靶向TREM1抑制系膜细胞增殖活力 过度的系膜细胞增生同时也是狼疮性肾炎的诱因之一。CCK8法测定各组系膜细胞活力,结果如下:与各自的阴性对照相比,sh-TREM1组和miR-143-3p mimic组在各个时间点细胞活力被显著抑制(P<0.05),miR-143-3p mimic+sh-TREM1组抑制效果更加显著(P<0.05)。见图5。

图5 各组系膜细胞活力Fig.5 Viability of mesangial cells in each groupNote:Compared with mimic NC group at the corresponding time point,#.P<0.05;compared with sh-NC group at the corresponding time point,*.P<0.05;compared with miR-143-3p mimic+sh-TREM1 group at the corresponding time point,△.P<0.05.
2.6miR-143-3p靶向TREM1使系膜细胞停滞在G0/G1期 通过PI单染了解各组系膜细胞的细胞周期分布。结果发现:与各自的阴性对照相比,sh-TREM1组和miR-143-3p mimic组G1/G0期细胞比例显著升高(P<0.05),但S期和G2期细胞比例明显减少(P<0.05)。说明miR-143-3p能下调TREM1进而阻滞系膜细胞周期。miR-143-3p mimic+sh-TREM1组阻滞效果更加明显。见图6。
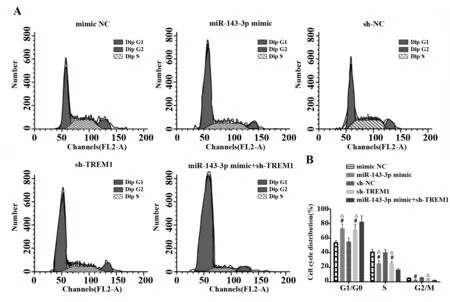
图6 各组系膜细胞周期分布Fig.6 Cell cycle distribution in each group of mesang-ial cellsNote:A.Cell cycle chart in each group;B.Cell cycle distribution in each group.Compared with mimic NC group at the corresponding time point,#.P<0.05;compared with miR-143-3p mimic+sh-TREM1 group at the corresponding time point,△.P<0.05.
2.7miR-143-3p对系膜细胞凋亡无显著影响 为检测miR-143-3p对系膜细胞的影响,本研究使用Annexin V/PI双标染色检测各组系膜细胞早期与晚期凋亡细胞的情况。结果显示:与mimic NC组相比,miR-143-3p组和miR-143-3p mimic+sh-TREM1组系膜细胞凋亡率有所上升,但不具有统计学意义(P>0.05)。sh-NC组与sh-TREM1组细胞凋亡情况无显著差异(P>0.05)。见图7。

图7 各组系膜细胞凋亡情况Fig.7 Apoptosis of mesangial cells in each groupNote:A.Mesangial cells apoptosis was detected by flow cytometry;B.Quantification of apoptosis rate in each group.
3 讨论
肾小球系膜细胞的过度增殖被认定为LN的首要病理学指标,也是造成肾损伤的重要原因[12]。miRNA经研究证实在生物体基因的表达以及多种细胞活动的调控中发挥重要作用,另外也有越来越多的研究证实miRNA能够对免疫功能进行调节[13,14]。以往研究证实诱发miR-143的表达能够抑制丙酸杆菌介导的皮肤炎性反应[15]。此外,miR-143在炎症性肠病中的保护作用也被越来越多的证实[8,16]。本研究进一步证实了miR-143-3p能够靶向调控TREM1基因进而对LN小鼠肾小球系膜细胞炎性因子以及细胞凋亡进行调控。
免疫组化染色对LN小鼠肾组织中TREM1表达进行观察,发现LN小鼠肾组织中TREM1呈强阳性表达。TREM1经以往研究证实在炎症反应的调节中以及自身免疫性疾病的发病中发挥重要作用,相对于健康人群,类风湿性关节炎标本中TREM1表达显著增高[6]。本研究进一步证实了TREM1在LN小鼠肾组织中表达升高,并且通过双荧光素报告以及Western blot实验证实TREM1受miR-143-3p调控,miR-143-3p能够抑制TREM1的表达。炎症因子的过度分泌是LN的重要病理表现。本研究通过Western blot对各组细胞中炎性相关因子的蛋白进行定量,观察miR-143-3p靶向TREM1对系膜细胞炎症因子的影响。LN发病时往往伴随NF-κB p65、TNF-α、IL-1β和MCP-1等炎症因子表达水平的提高,而炎症因子的增强又会进一步加重肾脏固有细胞损伤以及免疫反应,加重病情进展[17]。我们的研究结果发现,过表达miR-143-3p或抑制TREM1表达能够显著抑制系膜细胞中炎症因子的生成。
LN肾小球系膜细胞是增殖性肾损伤发挥作用的重要靶细胞[18]。正常健康状态下,肾小球系膜细胞的形态和数量均维持在相对稳定的状态,但特定损伤类因素则容易引起肾小球系膜细胞凋亡减少、过度增殖,使得细胞外基质的过度生成,最终引起肾小球硬化[19,20]。因此,诱导肾小球系膜细胞的凋亡、减少其增殖对于LN的治疗以及防止肾小球硬化具有重要意义。本研究通过CCK8以及流式细胞术对各组LN小鼠肾小球系膜细胞的增殖活性、细胞周期以及细胞凋亡情况进行观察,发现过表达miR-143-3p以及沉默TREM1基因能够抑制LN小鼠肾系膜细胞增殖活性且联合处理效果更显著。此外,过表达miR-143-3p以及沉默TREM1后促进了LN小鼠肾系膜细胞的G0/G1期阻滞且联合处理效果更明显,但是各组之间凋亡率差异不显著。表明LN小鼠肾系膜细胞增殖活性的改变主要是由细胞周期的变化引起的,而miR-143-3p能够靶向下调TREM1进而促进G0/G1期细胞阻滞进而抑制细胞的增殖活性。
综上所述,LN小鼠肾系膜细胞中miR-143-3p表达相对于正常小鼠显著降低,miR-143-3p能够靶向抑制TREM1进而抑制肾小球系膜细胞炎性因子的分泌以及细胞增殖活性,miR-143-3p有望成为LN治疗中的重要靶点。但是对于其具体作用机制以及是否通过下游通路发挥作用仍然需要通过更多的实验进行证实。
4 结论
miR-143-3p在LN小鼠肾小球系膜细胞中表达显著降低,TREM1表达则显著增强,miR-143-3p能够靶向抑制TREM1的表达进而抑制肾小球系膜细胞炎性因子的分泌以及细胞增殖活性,在LN中发挥保护作用,因此miR-143-3p有望成为LN治疗的重要靶点。
