KLF4在弥漫性大B细胞淋巴瘤组织中的表达及其作用机制研究①
2020-02-29林志美邹忠晴余晓玲
林志美 李 建 饶 进 邹忠晴 余晓玲
(成都大学附属医院血液科,成都 610081)
非霍奇金淋巴瘤是发病率增长比较快的恶性肿瘤之一,其最常见的病理类型为弥漫性大B细胞淋巴瘤,弥漫性大B细胞淋巴瘤是一种侵袭性肿瘤,具有明显异质性,通过联合化疗可使一半以上的患者生存期延长,但部分患者仍因肿瘤进展而死亡,因此探讨弥漫性大B细胞淋巴瘤发病的分子机制对治疗具有重要的指导意义[1,2]。人锌指转录因子Krüppel 样因子4(Krüppel-like factor 4,KLF4)是人锌指转录因子KLF家族成员,在多种细胞的生理功能中发挥重要作用,研究表明KLF4在多种恶性肿瘤的发生发展中具有重要作用,与恶性肿瘤细胞的增殖、侵袭和迁移等关系密切[3],过表达KLF4可抑制白血病细胞的增殖和迁移[4,5]。淋巴瘤患者磷脂酰肌醇激酶(phosphatidylinositol kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路被异常激活,抑制该信号通路对淋巴瘤具有抑制作用[6]。但KLF4在弥漫性大B细胞淋巴瘤组织中的表达及其对弥漫性大B细胞淋巴瘤增殖和侵袭迁移的影响及机制尚不清楚,本文对KLF4在弥漫性大B细胞淋巴瘤中的表达及其对细胞增殖和侵袭迁移能力以及PI3K/Akt信号通路的影响进行研究,为临床提供依据。
1 材料与方法
1.1材料
1.1.1研究对象 选择我院2017年6月~2018年6月初诊弥漫性大B细胞淋巴瘤患者的弥漫性大B细胞淋巴瘤石蜡组织标本60例和同期淋巴结反应增生患者的淋巴结石蜡组织标本60例为对照。弥漫性大B细胞淋巴瘤患者年龄(48.31±5.36)岁,男性37例,女性23例;淋巴结反应增生患者年龄(47.84±4.97)岁,男性35例,女性25例。弥漫性大B细胞淋巴瘤患者均为初治患者,均经病理证实为弥漫性大B细胞淋巴瘤,两组患者均签署知情同意书。
1.1.2细胞株 弥漫性大B细胞淋巴瘤细胞系ly1细胞和人B淋巴母细胞系HMy2.CIR细胞购自中国科学院细胞库。
1.1.3主要试剂 苏木素、二甲苯、中性树胶、DAB试剂盒、3%过氧化氢、抗原修复液(北京中杉金桥生物技术有限公司),兔抗人KLF4单克隆抗体、兔抗人Akt多克隆抗体、兔抗人磷酸化-Akt(phospho-rylation-Akt,p-Akt)多克隆抗体、兔抗人PI3K多克隆抗体、兔抗人磷酸化-PI3K多克隆抗体(phospho-rylation-PI3K,p-PI3K)(美国Abcam公司),BCA蛋白浓度测定试剂盒、CCK-8试剂、Transwell小室、Matrigel、逆转录-聚合酶链反应(reverse transcri-ption-polymerase chain reaction,RT-PCR)试剂盒(美国Hyclone公司),胎牛血清、RPMI1640培养基(美国Gibco公司)等。
1.2方法
1.2.1免疫荧光双标双染色测定弥漫性大B细胞淋巴瘤组织和对照组织中KLF4表达情况 将弥漫性大B细胞淋巴瘤石蜡组织和对照石蜡组织进行切片,烤片30 min,梯度酒精水化,蒸馏水洗涤,PBS浸泡,加入抗原修复液修复30 min,PBS冲洗,加入过氧化氢孵育30 min,PBS洗涤,加入山羊血清封闭30 min,加入两种一抗:KLF4抗体和CD20抗体(1∶50),过夜孵育,对照组加入PBS代替一抗,PBS洗涤,加入荧光二抗(红色荧光和绿色荧光)1∶500过夜孵育,PBS洗涤,取出玻片,加入缓冲甘油,覆盖玻片,荧光显微镜400倍视野下观察。KLF4阳性细胞细胞核显红色荧光,CD20阳性细胞细胞膜显绿色荧光,计算400倍视野下5个视野KLF4和CD20双阳性细胞数量,在每个400倍视野中KLF4阳性细胞大于15个为高表达,低于15个位低表达。
1.2.2Western blot测定弥漫性大B细胞淋巴瘤细胞系ly1细胞和人B淋巴母细胞系HMy2.CIR细胞中KLF4蛋白水平 取生长良好的ly1细胞和HMy2.CIR细胞,加入蛋白裂解液提取ly1细胞和HMy2.CIR细胞总蛋白,将ly1细胞和HMy2.CIR细胞蛋白加入到SDS-PAGE胶不同泳道中电泳,转膜,加入脱脂奶粉封闭2 h,加入鼠抗人KLF4抗体(1∶100)过夜孵育,以β-actin(1∶1 500)为内参照,加入羊抗鼠IgG(1∶1 500)孵育1 h,加入发光显色液显色,Bio-Rad凝胶成像系统成像,KLF4蛋白相对表达量以KLF4吸光度值/β-actin吸光度值。
1.2.3RT-PCR测定弥漫性大B细胞淋巴瘤细胞系ly1细胞和人B淋巴母细胞系HMy2.CIR细胞中KLF4 mRNA水平 取生长良好的ly1细胞和HMy2.CIR细胞,加入Trizol提取细胞总RNA,将ly1细胞和HMy2.CIR细胞总RNA反转录为cDNA,以cDNA为模板,采用PCR法测定ly1细胞和HMy2.CIR细胞中KLF4 mRNA(KLF4上游引物:5′-GGCTGATGGGCAAGTTTGTG-3′,下游引物:5′-CAAGTGTGGGTGGCTGTTCT-3′),以β-actin为内参照,反应条件为:94℃ 5 min,94℃ 15 s、55℃ 30 s,72℃ 30 s,共40个循环。以2-ΔΔCt作为KLF4 mRNA的相对表达量。
1.2.4ly1细胞分组及转染 将生长良好的ly1细胞分为空白对照组、阴性对照组和过表达KLF4组,每组设7个复孔。将三组生长良好的ly1细胞接种到96孔板中(每孔103个细胞)培养24 h,空白对照组不转染病毒,阴性对照组转染阴性对照病毒,过表达KLF4组转染过表达KLF4病毒,根据感染复数=150稀释病毒液,取10 μl病毒液加入相应培养孔中,再加入促转染剂Polybrene,混匀后培养48 h。
1.2.5Western blot法测定转染后三组ly1细胞中KLF4蛋白水平,RT-PCR测定转染后三组ly1细胞中KLF4 mRNA水平,具体方法同1.2.2和1.2.3。
1.2.6CCK-8测定转染后ly1细胞增殖情况 将三组转染后ly1细胞制成细胞悬液,接种到96孔板中(每孔5×106个细胞),每孔加入含胎牛血清的培养液,分别在接种后1 d、3 d和5 d于每孔中加入CCK-8液10 μl继续培养4 h(每组每个时间点设7个复孔),酶联免疫检测仪上测定波长490 nm处吸光度(A)值。
1.2.7Transwell小室法测定转染后ly1细胞侵袭和迁移能力 在Transwell小室底部膜下表面均匀涂抹10 μl纤连蛋白(1 g/L),将小室置入培养箱中孵育4 h,将三组转染后ly1细胞100 μl加入到小室上室(5×105个细胞/ml),下室加入含FBS培养液,每组设7个复孔,培养24 h,取出小室用棉签擦去上室细胞,多聚甲醛固定迁移到下室的细胞,用0.1%结晶紫染色下室细胞30 min,用PBS洗涤3遍,100倍显微镜下观察迁移细胞数。ly1细胞侵袭能力测定:将Transwell上室用Matrigel胶包被,培养箱中孵育2 h至基质胶凝固,其余实验步骤与迁移实验相同。
1.2.8Western blot法测定转染后三组ly1细胞Akt、p-Akt、PI3K、p-PI3K蛋白水平,具体方法同1.2.2。

2 结果
2.1弥漫性大B细胞淋巴瘤组织和淋巴结反应增生组织中KLF4表达情况 CD20表达在除浆细胞(分泌免疫球蛋白的B细胞)外的发育分化各阶段的B细胞的表面,是最常用的B细胞标记。KLF4和CD20同时阳性细胞代表B细胞中KLF4阳性表达细胞。弥漫性大B细胞淋巴瘤组织B细胞中KLF4阳性表达率(38.33%)低于对照组织B细胞中(56.67%)(P<0.05)。见表1和图1。

表1 弥漫性大B细胞淋巴瘤组织和对照组织B细胞中KLF4表达情况比较[n=60,n(%)]Tab.1 Comparison of KLF4 expression in diffuse large B-cell lymphoma tissue and control tissues[n=60,n(%)]

图1 免疫组化染色检查弥漫性大B细胞淋巴瘤组织和对照组织中KLF4表达(×100)Fig.1 Immunohistochemical staining for KLF4 expression in diffuse large B-cell lymphoma tissue and control tissues(×100)Note:A.Diffuse large B-cell lymphoma tissue;B.Control tissue.
2.2弥漫性大B细胞淋巴瘤细胞系ly1细胞和人B淋巴母细胞系HMy2.CIR细胞中KLF4蛋白和mRNA水平 弥漫性大B细胞淋巴瘤细胞系ly1细胞中KLF4蛋白和mRNA水平低于人B淋巴母细胞系HMy2.CIR细胞(P<0.01)。见表2和图2。

表2 ly1细胞和HMy2.CIR细胞中KLF4蛋白和mRNA水平比较Tab.2 Comparison of KLF4 protein and mRNA levels in ly1 cells and HMy2.CIR
Note:Compared with HMy2.CIR cell group,1)P<0.01.
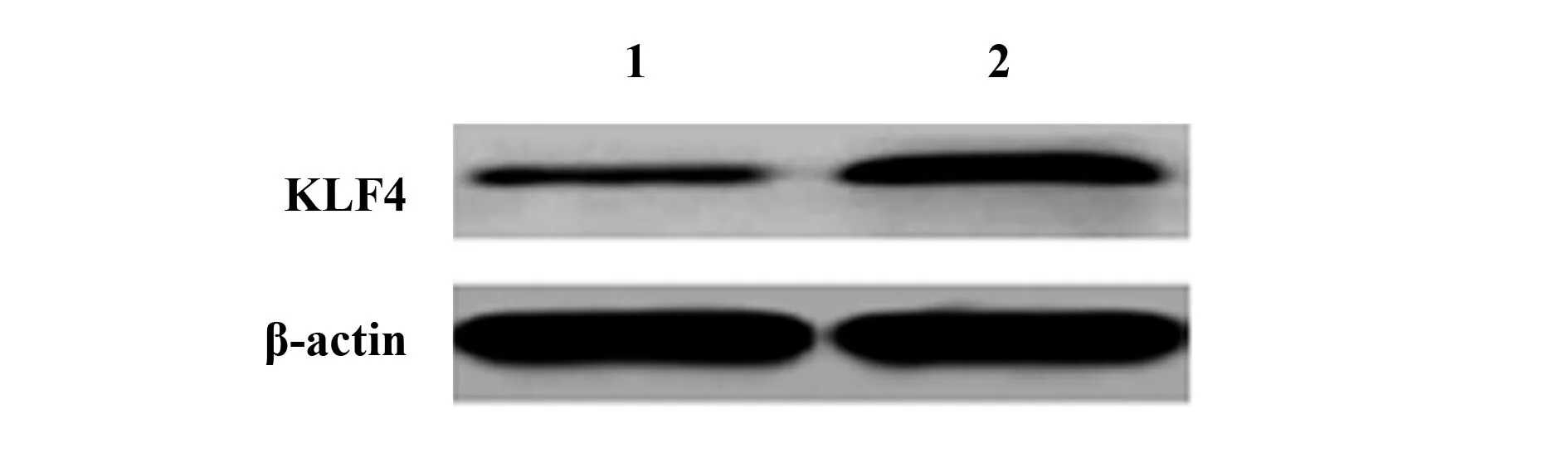
图2 ly1细胞和HMy2.CIR细胞中KLF4蛋白Western blot电泳图Fig.2 Western blot analysis of KLF4 protein in ly1 cells and HMy2.CIR cellsNote:1.ly1;2.HMy2.CIR.
2.3过表达KLF4对ly1细胞中KLF4蛋白和mRNA水平的影响 与空白对照组和阴性对照组比较, 过表达KLF4组ly1细胞中KLF4蛋白和mRNA水平升高(P<0.01);空白对照组和阴性对照组ly1细胞中KLF4蛋白和mRNA水平比较差异无统计学意义(P>0.05)。见表3和图3。

表3 三组ly1细胞中KLF4蛋白和mRNA水平比较Tab.3 Comparison of KLF4 protein and mRNA levels in three groups of ly1
Note:Compared with the blank control group,1)P<0.01;compared with the negative control group,2)P<0.01.

图3 三组ly1细胞中KLF4蛋白Western blot电泳图Fig.3 Western blot analysis of KLF4 protein in three groups of ly1 cellsNote:1.Blank control group;2.Negative control group;3.Overexpressing KLF4 group.
2.4过表达KLF4对ly1细胞增殖的影响 第1天,三组ly1细胞A值比较差异无统计学意义(P>0.05);第3天和第5天,与空白对照组和阴性对照组比较,过表达KLF4组ly1细胞A值降低(P<0.01);空白对照组和阴性对照组ly1细胞A值比较差异无统计学意义(P>0.05)。见表4。

表4 三组ly1细胞A值比较Tab.4 Comparison of A values of three groups of ly1
Note:Compared with the blank control group,1)P<0.01;compared with the negative control group,2)P<0.01.
2.5过表达KLF4对ly1细胞侵袭迁移能力的影响 与空白对照组和阴性对照组比较,过表达KLF4组ly1细胞侵袭和迁移细胞数降低(P<0.01);空白对照组和阴性对照组ly1细胞侵袭和迁移细胞数比较差异无统计学意义(P>0.05)。见表5和图4、5。

表5 三组ly1细胞侵袭迁移细胞数比较Tab.5 Comparison of number of invading and migrating cells of three groups of ly1
Note:Compared with the blank control group,1)P<0.01;compared with the negative control group,2)P<0.01.

图4 测定三组ly1细胞侵袭能力(×100)Fig.4 Migration ability of three groups of ly1 cells(×100)Note:A.Blank control group;B.Negative control group;C.Overex-pressing KLF4 group.

图5 测定三组ly1细胞迁移能力(×100)Fig.5 Determination of invasive ability of three groups of ly1 cells(×100)Note:A.Blank control group;B.Negative control group;C.Overex-pressing KLF4 group.
2.6过表达KLF4对ly1细胞PI3K/Akt信号通路的影响 三组ly1细胞Akt、PI3K蛋白水平比较差异无统计学意义(P>0.05);与空白对照组和阴性对照组比较,过表达KLF4组ly1细胞p-Akt、p-PI3K蛋白降低(P<0.01);空白对照组和阴性对照组ly1细胞p-Akt、p-PI3K蛋白比较差异无统计学意义(P>0.05)。见表6和图6。

表6 三组ly1细胞Akt、p-Akt、PI3K、p-PI3K蛋白水平比较Tab.6 Comparison of Akt,p-Akt,PI3K,p-PI3K protein levels in three groups of ly1
Note:Compared with the blank control group,1)P<0.01;compared with the negative control group,2)P<0.01.
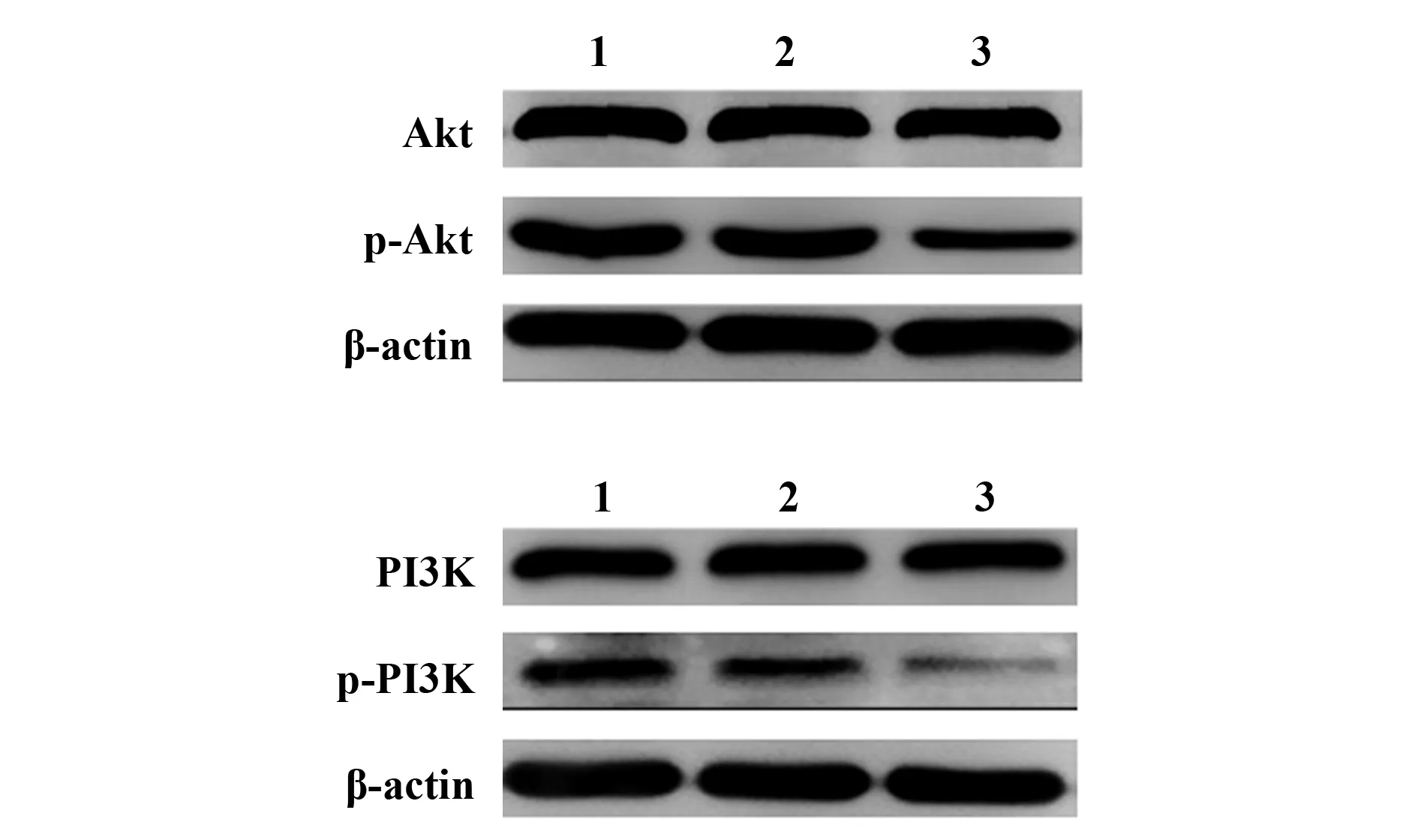
图6 三组ly1细胞Akt、p-Akt、PI3K、p-PI3K蛋白Western blot电泳图Fig.6 Western blot analysis of Akt,p-Akt,PI3K,p-PI3K proteins in three groups of ly1 cellsNote:1.Blank control group;2.Negative control group;3.Overexp-ressing KLF4 group.
3 讨论
KLF4在人类组织中广泛表达,目前发现的KLF家族成员有17名,在细胞增殖、分化、生长以及维持正常组织稳态中发挥重要作用,KLF4为KLF家族成员中最受关注的分子之一,KLF4位于9q31染色体上,包括DNA结合结构域、转录调节结构域、核定位序列3个结构域[7,8]。其中DNA结合结构域位于羧基端,高度保守,在调节和DNA结合的特异性中发挥重要作用;转录调节结构域在转录抑制或转录活性中发挥重要作用,位于氨基端;核定位序列在KLF4在细胞核内的定位中发挥重要作用[9,10]。KLF4和不同的靶基因结合在不同的肿瘤(mantle cell lymphoma)组织中发挥促癌或者抑癌作用,研究发现KLF4在口腔鳞癌、乳腺导管癌中表达水平升高,发挥癌基因的作用,而在胃癌、食管鳞癌、肺癌等恶性肿瘤中表达降低,发挥抑癌作用[11]。在血液系统疾病中,Filarsky等[12]发现KLF4在慢性淋巴细胞白血病中失活;李波等[13]发现过表达KLF4可促进白血病K562细胞凋亡,抑制K562细胞增殖;Jiang等[14]发现上调KLF4可诱导霍奇金淋巴瘤细胞凋亡;Li等[15]研究发现套细胞淋巴瘤组织中KLF4水平下降。本文研究发现弥漫性大B细胞淋巴瘤组织中KLF4表达水平下降,过表达KLF4可抑制弥漫性大B细胞淋巴瘤细胞增殖和侵袭迁移。本研究结果表明KLF4在弥漫性大B细胞淋巴瘤的发生发展中也发挥重要作用,KLF4有望成为弥漫性大B细胞淋巴瘤治疗的潜在靶点。
PI3K/Akt信号通路在人体各组织中普遍存在,在细胞生长、代谢、分化、增殖、存活中发挥重要作用,在恶性肿瘤的发生发展中,PI3K/Akt参与肿瘤细胞的增殖、凋亡等过程,和肿瘤的耐药关系也比较密切[16,17]。Akt为PI3K下游效应分子,Akt可通过磷酸化肿瘤抑制因子、激酶等多种细胞蛋白,促进肿瘤细胞增殖、抑制肿瘤细胞凋亡,从而促进肿瘤细胞生长。Akt活化可促进G1期细胞进展,从而加速细胞周期;Akt与肿瘤细胞的侵袭和迁移关系也比较密切,Akt的激活可促进肿瘤细胞的侵袭和迁移[18,19]。淋巴瘤中PI3K/Akt信号通路异常激活,马涛等[20]研究发现结外NK/T细胞淋巴瘤中PI3K/Akt信号通路异常激活。本研究观察过表达KLF4对弥漫性大B细胞淋巴瘤细胞中PI3K/Akt信号通路的影响,结果发现过表达KLF4可降低弥漫性大B细胞淋巴瘤细胞中p-Akt、p-PI3K蛋白水平,表明过表达KLF4可抑制弥漫性大B细胞淋巴瘤细胞中PI3K/Akt信号通路,KLF4对弥漫性大B细胞淋巴瘤细胞增殖和侵袭迁移的抑制作用可能与其抑制PI3K/Akt信号通路有关。
综上所述,弥漫性大B细胞淋巴瘤组织中KLF4表达降低,上调KLF4水平可能通过PI3K/Akt信号通路抑制弥漫性大B细胞淋巴瘤的增殖和侵袭迁移,KLF4有望成为弥漫性大B细胞淋巴瘤潜在的治疗靶点。
