姜黄素通过抑制TGF-β/smad2信号通路抑制人肝星状细胞纤维化作用研究①
2020-02-29王国泰李京涛魏海梁闫曙光
王国泰 李京涛 魏海梁 闫曙光 李 宁
(陕西中医药大学附属医院肝胆外科,咸阳 712000)
肝纤维化是肝细胞收到外源性炎症刺激后,受损肝脏周围大量聚集了胶原蛋白和纤维黏连蛋白等细胞外基质,同时导致正常胶原蛋白降解功能失常,进而造成纤维结缔组织和胶原等在受损肝脏周围异常沉积的病理过程[1,2]。肝脏受损时肝星状细胞在肝窦状隙中被激活,众多的证据表明HSC激活是肝纤维化过程的关键,是纤维状和非纤维状基质蛋白的主要来源。肝星形细胞(hepatic stellate cell,HSC)的激活能够增加细胞外基质的沉积、促进收缩平滑肌 α-肌动蛋白的表达增加、促炎细胞因子的释放和基质降解酶及其抑制物的释放。HSC的激活是导致肝纤维化的主要因素,激活的HSC分泌大量细胞外间质,影响肝脏的功能,引起细胞因子及细胞群的一系列变化。临床上大量数据表明早期的肝纤维化是可以通过治疗逆转,但是若病情进一步发展则会发展成肝硬化甚至是肝癌[3]。
目前临床上没有特别有效的药物来控制和治疗肝纤维化,因此针对肝纤维化的药物研究一直是临床的研究热点。TGF-β1/Smad通路是肝纤维化发生的重要信号通路,研究表明在体内建立以CCl4诱导的小鼠肝纤维化模型[3],探讨Smad2和Smad3在肝纤维化中的作用,结果发现在肝脏纤维化组织中发现了Smad2和Smad3的磷酸化[2]。因此针对抑制TGF-β1/Smad信号通路的药物就成为肝纤维化的研究热点。
姜黄素是从传统中医药姜黄中提取的一种单体,其物理特性表现为橙黄色粉末结晶,味苦,不溶于水,易溶于乙醇和冰醋酸以及碱溶液。现代研究发现姜黄素可以很好地抑制炎症的发生、同时可以抗氧化、抗凝降脂、消除自由基和抑制肿瘤增殖等作用[4]。结合姜黄素可以抗炎的作用,设想其是否对肝纤维化有一定的作用。因此,本研究采用人肝星状细胞LX-2为研究目标,来研究姜黄素是否可以抑制肝纤维的进程及其可能的作用机制,为临床上肝纤维化的治疗提供可行的治疗策略。
1 材料与方法
1.1材料
1.1.1试剂 人肝星状细胞LX-2购自中科院上海细胞库,姜黄素单体购自陕西省食品药品检验所,蛋白定量试剂盒、SDS凝胶试剂盒、细胞裂解液、结晶紫、高锰酸钾、草酸、冰醋酸和磷钨酸均购自西安科昊生物有限公司,蛋白酶抑制剂购自罗氏试剂生物有限公司,4%多聚甲醛、DMEM培养液、胎牛血清、胰蛋白酶消化液和青链霉素购自美国HyClone,β-actin、Ku70和CDK12抗体购自英国 Abcam,兔二抗购自英国 Abcam,Trans-well小室购自康宁。
1.1.2仪器 CFX96 real-time PCR仪、S1000TM Thermal Cycler PCR仪(Bio-Rad,美国);Western blot仪器(Bio-Rad,美国)。
1.2方法
1.2.1CCK-8增殖实验 调整LX-2细胞密度为4×105个/孔直接铺板,细胞密度达至80%左右,10 ng/ml TGF-β1刺激24 h,随后不同浓度姜黄素给药处理(5、10、15、20、25 μmol/L)48 h。结束后每孔加入20 μl CCK-8试剂,避光3 h,摇床振荡15 min。设置酶标仪450 nm检测细胞CCK-8混合液OD值进行活力分析。
1.2.2qRT-PCR 调整LX-2细胞密度为4×105个/孔直接铺板,细胞密度达至80%左右,10 ng/ml TGF-β1刺激24 h,随后不同浓度姜黄素给药处理(5、10、15、20、25 μmol/L)48 h,严格按照试剂盒步骤提取、定量、反转录和PCR反应。引物序列如下,CollagenⅠ:Forward-ATTTTTCTGDCGACACCCGAT,Reverse-TCCCAGGTGTAGACCAA;CollagenⅢ For-ward-ATTTTTGTACACACCCGAT,Reverse-TGACCG-GTGTAGACCAA;α-SMA Forward-ATTTTTGCCCGAT-ACCCGAT,Reverse-TGACCGTCATAGACCAA和β-actin:Forward-ATTTTTGTACACACAATGC,Reverse-TGACCGGTGTCCCTGACGAT。
1.2.3Western blot 调整LX-2细胞密度为4×105个/孔直接铺板,细胞密度达至80%左右,10 ng/ml TGF-β1刺激24 h,随后不同浓度姜黄素给药处理(5、10、15、20、25 μmol/L)48 h。随后消化细胞铺至培养皿,细胞密度80%时收集细胞,裂解液(含有蛋白酶抑制剂)冰上裂解30 min后高速离心机4℃ 13 000 r/min 离心30 min后吸取上层蛋白。蛋白定量完成后加上样缓冲液,沸水煮5 min。电泳结束后进行转膜,随后用脱脂牛奶进行封闭,PBST清洗,均为1∶1 000稀释一抗(Ku70、CDK12和β-actin),4℃过夜。第2天冷的PBS清洗条带3次,二抗孵育1 h,发光仪发光拍照。
1.2.4CCl4诱导小鼠肝纤维化模型 C57小鼠分组,分为空白对照组(Normal)、PBS组和姜黄素(Curcumin)组,每组6只。CCl4和橄榄油(2∶3)按比例混匀,每周两次皮下注射,注射剂量3 ml/kg,连续注射6周。PBS组小鼠PBS给药处理,姜黄素组给药100 mg/kg,每周3次给药,连续给药6周。6周后CO2处死所有小鼠,收集每只小鼠血液,肝脏固定在4%多聚甲醛,在液氮中快速冷冻并储存在-80℃。
1.2.5小鼠肝功能相关指标检测 肝纤维化模型造模成功6周后,采集小鼠血液,采用离心分离处理,台式离心机转速为13 000 r/min,处理时间为20 min,离心分离后取上清液进行检测。全自动生化分析仪、酶标仪及配套试剂盒完成检测,肝功能指标包括ALT、AST、ALB和TP。
1.2.6ELISA 测IL-10和IFN-γ水平 肝纤维化模型造模成功6周后,采集小鼠血液,采用离心分离处理,台式离心机转速为13 000 r/min,处理时间为20 min,离心分离后取上清液进行检测。严格按照ELISA试剂盒说明书步骤,检测血液上清中IL-10和IFN-γ的含量。
1.2.7羟脯氨酸的测定 称取小鼠肝组织100 mg,置于安瓿瓶中,加入2.5 ml纯水和2.5 ml浓盐酸封瓶,置于105℃烘箱中水解18 h,滤纸过滤即得肝组织水解液。取10 μl水解液,加入10 μl内标溶液(10 mg/L),用72%乙腈水溶液定容至10 ml,取稀释液1 ml,以13 000 r/min离心10 min,取上清,用试剂盒进行测定。
1.2.8HE染色 按1.2.4方法进行分组和给药。给药6周后,CO2处死小鼠,分离出肝脏尽量去除结缔组织,PBS冲洗,4%多聚甲醛固定24 h,EDTA脱钙,常规石蜡包埋,并将包埋标本切成4 μm薄片,依次进行石蜡切片脱蜡至水、苏木素(Hematoxylin)染色、伊红(Eosin)染色、脱水封片操作,显微镜镜检,图像采集,Image J软件进行分析。
1.2.9马松染色 中性甲醛液固定组织,石蜡切片,常规脱蜡至水。入天青石蓝液染10 min。蒸馏水洗3次。马松和苦味酸染30 min。无水酒精直接分化和脱水。二甲苯透明,中性树胶封固。染色的结果胶原呈蓝色。

2 结果
2.1姜黄素抑制了LX-2的增殖作用 正常体外培养LX-2细胞,不进行任何处理,分别不同浓度姜黄素给药处理(5、10、15、20、25、30、35、40、45、50 μmol/L)48 h,结果发现5~35 μmol/L姜黄素对LX-2细胞增殖没有影响(图1A),而45和50 μmol/L则现在抑制LX-2细胞增殖,导致细胞凋亡,因此后续姜黄素给药浓度控制在50 μmol/L以内。

图1 不同浓度姜黄素对LX-2细胞的作用Fig.1 Effect of curcumin at different concentrations on LX-2 cellNote:A.Toxicity of curcumin at different concentrations on LX-2 cells;B.Inhibition of curcumin at different concentrations on TGF-β activated LX-2 cells.***.P<0.001.
正常生理条件下人肝星状细胞处于静态,肝脏受到外源性损伤发生炎症反应时会激活人肝星状细胞的活化与增殖,使其在受损肝脏周围快速增殖聚集。体外我们用10 ng/ml TGF-β1刺激人肝星状细胞LX-2 24 h,来模拟这种损伤。随后不同浓度姜黄素给药处理(5、10、15、20、25 μmol/L)48 h,CCK-8检测各组LX-2细胞的增殖情况。结果发现随着姜黄素浓度的增高,可以显著抑制活化状态下的LX-2细胞的增殖(P<0.05),并且发现且姜黄素20 μmol/L抑制作用最强(图1B)(P<0.05),因此后续实验均以20 μmol/L姜黄素为研究基础。此结果说明姜黄素对活化状态下的人肝星状细胞LX-2具有抑制作用,为后续的研究奠定一定基础。
2.2姜黄素抑制LX-2细胞纤维相关蛋白和免疫炎性因子的表达 姜黄素对活化状态下的人肝星状细胞LX-2的增殖具有抑制作用,通过qRT-PCR和Western blot我们检测了CollagenⅠ、CollagenⅢ和α-SMA表达变化,结果发现姜黄素可以显著抑制CollagenⅠ、CollagenⅢ和α-SMA的表达(P<0.05),降低其在活化状态下LX-2细胞的含量;通过ELISA检测了IL-10和IFN-γ的表达变化,结果同样发现姜黄素可以有效抑制免疫炎性因子IL-10和IFN-γ的表达(P<0.05),说明姜黄素对纤维相干蛋白和免疫炎性反应具有抑制作用。见图2。

图2 姜黄素对纤维相关蛋白和免疫炎性因子表达的影响Fig.2 Effect of curcumin on expression of fiber-related proteins and immunoinflammatory factorsNote:A.qRT-PCR was used to detect the effect of curcumin on fiber-related protein expression;B.ELISA was used to detect curcumin on immuno-inflammatory factors IL-10 and IFN-γ expression effect;C.Western blot was used to detect the effect of curcumin on fiber-related protein expression.**.P<0.01,***.P<0.001.
2.3姜黄素抑制LX-2细胞内p-smad2介导的p-65/NF-κB信号通路 目前已有研究结果表明,TGF-β1可以激活smad2的磷酸化,促使其进入细胞核促进p-65的表达从而发挥调节促纤维化的作用,Western blot结果显示姜黄素显著抑制smad2的磷酸化和p-65的表达(P<0.05),说明在细胞水平姜黄素素抑制了p-smad2介导的p-65/NF-κB经典纤维化信号通路。见图3。
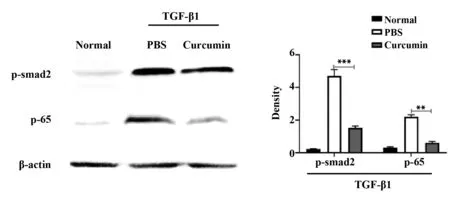
图3 姜黄素对p-smad2和p-65表达的影响Fig.3 Effect of curcumin on expression of p-smad2 and p-65Note:**.P<0.01;***.P<0.001.
2.4姜黄素改善CCl4诱导的肝纤维小鼠肝组织和肝功能损伤 经CCl4诱导成功构建C57肝纤维化小鼠模型,姜黄素腹腔给药,6周后处死小鼠,收集各组小鼠血清和肝组织进行肝功和HE染色。肝纤维化过程中,谷草转氨酶(AST)及谷丙转氨酶(ALT)、肌酐(Cr)及尿素氮(BUN)对肝功能具有一定的指向性,血液分析结果显示,与PBS组相比,姜黄素显著降低了CCl4诱导小鼠血液中AST、ALT、Cr和BUN的表达(P<0.05);同时HE染色结果显示姜黄素有效改善了CCl4诱导小鼠肝组织损伤,组织中中性粒细胞和巨噬细胞数量显著减少(P<0.05),与PBS组相比,组织结构排列有序,细胞碎片明显减少。这说明在体内姜黄素可以改善纤维化小鼠肝组织损伤和肝功能损伤,有利于小鼠维持更长的生存期。见图4。
2.5姜黄素抑制CCl4诱导的肝纤维小鼠肝组织内胶原的沉积 胶原的沉积是造成肝脏发生纤维化的主要原因,小鼠造模给药结束后马松染色检测各组肝组织内纤维蛋白的表达,与PBS组相比较,发现姜黄素可以有效抑制纤维蛋白的表达(P<0.05);Western blot检测结果发现姜黄素显著抑制肝组织内α-SMA的表达(P<0.05)。见图5。
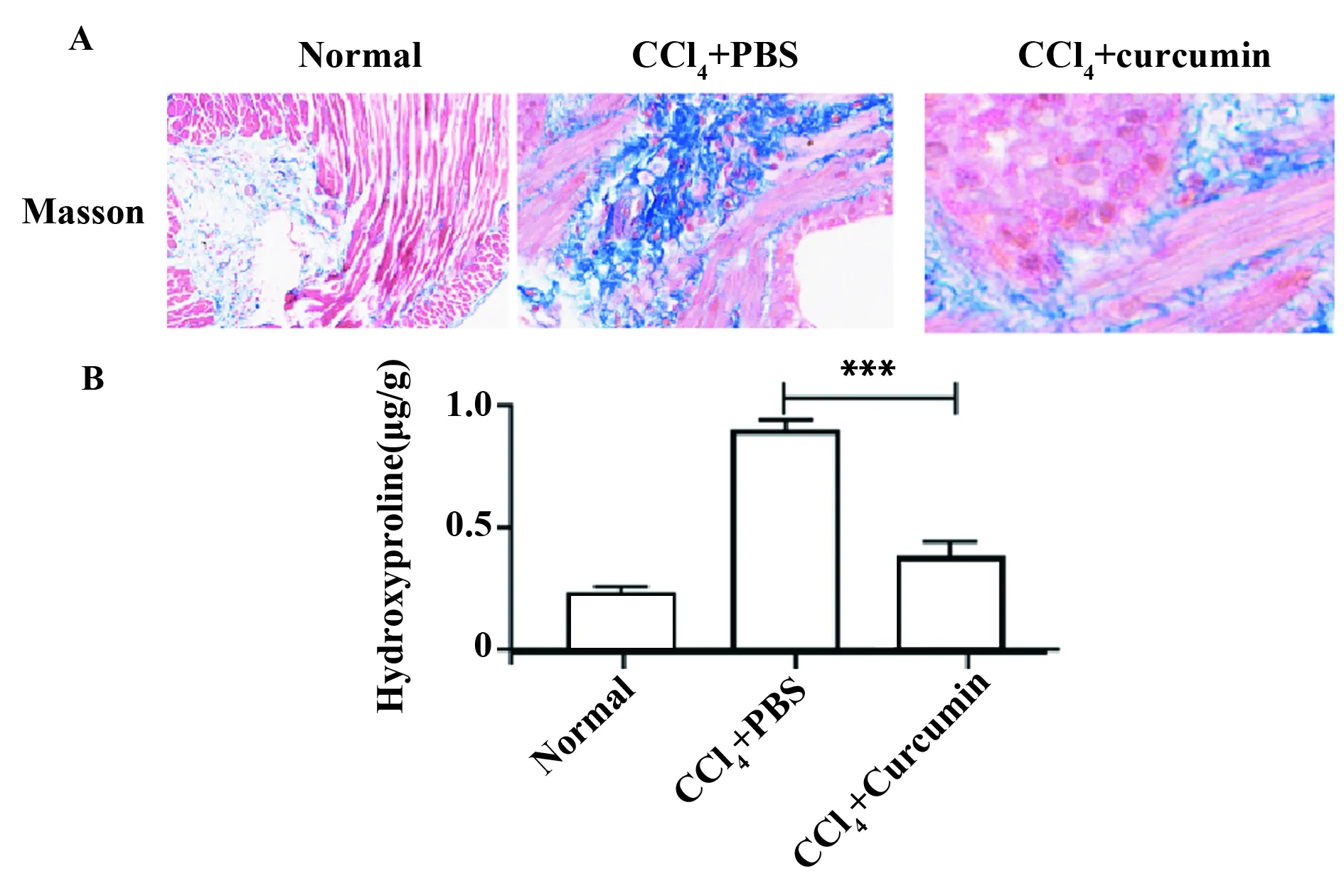
图5 姜黄素对小鼠肝组织纤维化的抑制情况Fig.5 Inhibition of curcumin on liver fibrosis in miceNote:A.Masson staining to detect the expression of curcumin in liver tissue of mice;B.Effect of curcumin on the expression of hydroxyproline in liver tissue of mice.***.P<0.001.
2.6姜黄素抑制CCl4诱导的p-smad2介导的p-65/NF-κB信号通路 在细胞水平研究发现姜黄素可以抑制p-smad2介导的p-65/NF-κB信号通路,在体内这种抑制作用是否仍存在,我们通过Western blot检测了各组小鼠肝组织内p-smad2和p-65的表达,结果表明在体内姜黄素同样可以有效抑制p-smad2介导的p-65/NF-κB信号通路,从而抑制肝纤维化的发生发展。见图6。

图6 姜黄素在体内对p-smad2和p-65表达影响Fig.6 Effect of curcumin on expression of p-smad2 and p-65 in vivo3Note:**.P<0.01,***.P<0.001.
3 讨论
肝纤维化是临床上较为常见的一种肝脏疾病,在发病早期具有一定的可逆转性,若不及时治疗随着病情的发展会形成肝硬化甚至是肝癌[5],很多患者发现时已经处于肝纤维化病情较为严重的阶段[6]。肝纤维化形成的原因,目前尚不完全清楚,其是多基因多因素参与形成的结果[7,8]。目前较为公认的说法是胶原沉积和纤维黏连蛋白的过度表达以及免疫相关炎性因子释放是造成肝纤维化的主要原因[9,10]。目前TGF-β/p-smad2介导的p-65/NF-κB信号通路是纤维化研究的热点[10]。
传统中药在肝病的治疗上有独特的优势[11,12],毒副作用小,来源广泛,可以作为治疗肝病等多种疾病的宝库。姜黄素是从传统中医药姜黄中提取的一种单体,其物理特性表现为橙黄色粉末结晶,味苦,不溶于水,易溶于乙醇和冰醋酸以及碱溶液。现代研究发现姜黄素可以很好地抑制炎症的发生,同时可以抗氧化、抗凝降脂、消除自由基和抑制肿瘤增殖等作用[9,13]。姜黄素对肝纤维化的作用目前报道较少,具体机制更是阐明不清楚。
本研究主要研究了传统中药姜黄的提取单体姜黄素对肝纤维化的作用及其作用机制。体外研究结果可知姜黄素可以有效抑制TGF-β1激活的人肝星状细胞LX-2细胞的增殖,同时显著抑制CollagenⅠ、CollagenⅢ和α-SMA以及免疫炎性因子IL-10和IFN-γ的表达,说明姜黄素在体外对肝纤维化相关的因子具有很好的抑制作用,为证明这种抑制作用是否通过TGF-β/p-smad2介导的p-65/NF-κB信号通路来实现,随后检测了LX-2细胞内p-smad2和p-65的表达,结果发现姜黄素可以有效抑制smad2的磷酸化和p-65的表达,其可能的机制是通过抑制smad2的磷酸化从而阻止其入核,进而影响p-65/NF-κB信号通路,影响下游纤维蛋白基因的编码和翻译。体外实验中我们通过CCl4构建C57小鼠肝纤维化模型,腹腔给药的方式注射姜黄素,结果发现姜黄素可以有效改善小鼠肝功能损伤,降低小鼠血液中谷草转氨酶(AST)及谷丙转氨酶(ALT)、肌酐(Cr)及尿素氮(BUN)的表达,同时减少组织中中性粒细胞和巨噬细胞等免疫细胞的数量,减轻炎症反应。通过马松染色和羟脯氨酸的测定,我们发现姜黄素可以显著减少小鼠体内纤维蛋白的表达,通过Western blot检测我们发现在体内姜黄素同样可以有效抑制smad2的磷酸化和p-65的表达。
综上所述,在体内和体外姜黄素是通过阻滞p-smad2介导的p-65/NF-κB信号通路抑制了肝纤维化的作用,这为中药姜黄素的临床应用和肝纤维化的药物治疗都提供了一定的实验依据。但是姜黄素又是通过哪些上游因素来调控TGF-β/smad2信号通路,除了对p-smad2介导的p-65/NF-κB信号通路有抑制作用,对其他纤维化信号通路是否同样有抑制作用,这将是我们下一步的研究重点。
