肿瘤相关巨噬细胞对宫颈癌SiHa细胞迁移和侵袭的影响①
2020-02-29吉紫阳任云青
吉紫阳 任云青
(山西医科大学汾阳学院,汾阳 032200)
妇科癌症近年来日益引起人们的关注,成为一个重要的全球卫生保健问题。其中,宫颈癌已经成为全球女性第四大常见癌症[1],肿瘤的浸润转移成为宫颈癌患者预后差的主要原因。研究宫颈癌的浸润转移机制对于提高患者生存率,改善患者预后情况具有重要意义。
巨噬细胞来源于血液单核巨噬细胞,是重要的免疫效应细胞,也是肿瘤浸润性细胞的主要成分之一。根据局部组织微环境中存在的因子不同,巨噬细胞会呈现不同的表型和激活状态。近来引起人们关注的是M2型(替代活化型)巨噬细胞,它主要浸润于肿瘤免疫微环境中并包围着癌巢,也被称为肿瘤相关巨噬细胞(tumour associated-macrophages,TAMs)[2]。TAMs通过释放多种细胞因子与肿瘤细胞相互作用进而促进肿瘤的浸润和转移[3]。虽然在许多肿瘤中如乳腺癌[4]、肺癌[5]等已发现TAMs有促瘤作用,但TAMs在宫颈癌的发生和进展中的作用及具体分子机制尚不清楚。因此,本研究通过探讨TAMs对宫颈癌SiHa细胞迁移和侵袭的影响,进一步研究TAMs对宫颈癌进展的潜在作用,从而为宫颈癌的临床治疗提供新思路。
1 材料与方法
1.1材料 宫颈癌SiHa细胞和人急性白血病单核细胞系THP-1分别由山西医科大学第二医院、清华大学医学院分子生物学实验室馈赠。Transwell小室(孔径0.4 μm和8 μm)、基质胶Matrigel(美国Corning公司);PE anti-human CD204抗体、PE anti-human CD206抗体(美国Biolegend公司);E-cadherin抗体、N-cadherin抗体(CST公司);佛波脂(Phorbol 12-myristate 13-acetate,PMA)(联科生物有限公司);白细胞介素-4(Interleukin-4,IL-4)(武汉三鹰生物技术有限公司);逆转录试剂盒(上海碧云天生物技术有限公司);荧光定量PCR试剂盒(德国Qiagen公司);DMEM高糖培养基、RPMI1640培养基(武汉博士德生物技术有限公司)。
1.2方法
1.2.1肿瘤相关巨噬细胞诱导分化 取对数生长期THP-1细胞离心,PRMI1640完全培养基重悬,按1.0×106个/孔细胞接种至6孔板,经预实验结果选取50 ng/ml PMA处理THP-1细胞24 h,IL-4(20 ng/ml)继续处理72 h,此时细胞分化效果最佳。
1.2.2肿瘤相关巨噬细胞表型鉴定 取诱导完成的TAMs,消化离心弃去上清,PBS洗涤细胞沉淀,100 μl PBS重悬细胞,分别加入5 μl PE标记的 CD204和 CD206抗体,避光4℃孵育30 min,离心,弃上清,PBS洗涤细胞沉淀,500 μl PBS重悬细胞,流式细胞仪检测。THP-1细胞作阴性对照。
1.2.3划痕实验 选择对数生长期SiHa细胞消化离心,DMEM完全培养基重悬,按2.0×105个/孔细胞接种于6孔板,让其贴壁生长,待细胞呈单层融合时,吸弃培养基,用10 μl无菌枪头进行划痕,PBS洗去脱落细胞,未共培养组置于无血清DMEM培养,共培养组于TAMs培养上清中培养。分别于0 h、12 h、24 h、48 h对固定的划痕区拍照,比较各时间点细胞迁移率。细胞迁移率(%)=(0 h划痕愈合平均宽度-每12/24 h后划痕愈合平均宽度)/0 h划痕愈合平均宽度×100%,以此来评价TAMs培养上清对SiHa细胞迁移能力的影响。
1.2.4Transwell非接触式共培养实验 共培养选用Transwell(孔径0.4 μm)小室,上室接种THP-1细胞,按1.2.1步骤进行诱导;诱导完成后,将小室置于种植SiHa细胞的6孔板中进行共培养48 h,弃去小室,PBS洗涤SiHa细胞,用于随后实验。侵袭实验选用Transwell(孔径8 μm)小室,上室用50 μl Matrigel胶(1∶5稀释)包被,SiHa细胞接种于Transwell上室,无血清DMEM培养,下室加入TAMs为共培养组,未共培养组下室为DMEM完全培养基,37℃ 5%CO2培养24 h;4%多聚甲醛室温固定30 min,0.1%结晶紫室温避光染色20 min,湿棉棒擦去小室内表面细胞,显微镜下随机选取5个视野拍照并计数,统计结果;每组设置3个复孔,实验重复3次。迁移实验Transwell小室不包被Matrigel胶,其余步骤与侵袭实验相同。
1.2.5Western blot PBS清洗待测细胞3次,加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取,BCA法测定蛋白质浓度。100℃变性5 min后等量蛋白进行SDS-PAGE凝胶电泳分离并转至NC膜,5%脱脂奶粉封闭2 h,根据目的蛋白加入对应的一抗,4℃过夜孵育;TBST洗膜3次,每次10 min,加入辣根过氧化物酶标记的二抗室温孵育2 h,重复洗膜。最后加入发光液于凝胶成像仪进行曝光拍照并统计灰度值计算相对表达量。
1.2.6荧光定量RT-PCR 参照RNA提取试剂盒操作说明提取总RNA,测定RNA浓度并按照逆转录试剂盒操作说明将RNA反转录为cDNA,以cDNA为模板进行扩增,PCR扩增条件:95℃、2 min预变性;95℃、5 s,60℃、10 s,共40个循环。以β-actin为内参,结果采用 2-ΔΔCt法进行分析。用到的引物序列有β-actin F:5′-TGGACTTCGAGCAAGA-GATG-3′,R:5′-GAAGGAAGGCTGGAAGAGTG-3′;Snail F:5′-GGAAGCCTAACTACAGCGAGC-3′,R:5′-AGGACAGAGTCCCAGATGAGC-3′;Slug F:5′-AAGGACACATAGAACTCACACG-3′,R:5′-CACAGCAGCCAGATTCCTCA-3′。

2 结果
2.1TAMs诱导分化及表型鉴定 THP-1细胞呈圆球形,悬浮生长,经50 ng/ml PMA诱导24 h后,细胞停止增殖,呈贴壁生长;20 ng/ml IL-4继续诱导72 h,细胞呈聚集成簇生长,部分细胞伸出伪足(图1A~C)。流式细胞仪检测结果显示经PMA、IL-4诱导完成的细胞表面CD204和CD206分子表达与对照组相比明显增加。如图1D所示,CD204诱导组96.63%,对照组0.06%;CD206诱导组48.38%,对照组0.06%。以上结果提示TAMs诱导成功。
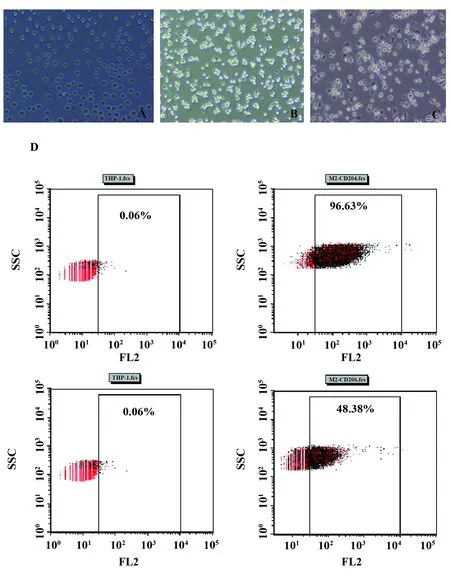
图1 TAMs的诱导分化及表型鉴定Fig.1 Induced differentiation and phenotypic identifica-tion of TAMsNote: A.Human acute leukemia monocyte line THP-1(×10);B.Undifferentiated macrophages induced by PMA for 24 hours(×10);C.Differentiated Macrophages induced by IL-4 for 72 hours(×10);D.Expression of CD204 and CD206 on the surface of THP-1 and differentiated macrophages by Flow cytometry.
2.2TAMs-SiHa细胞共培养对SiHa细胞形态的影响 TAMs与SiHa细胞共培养(0.4 μm Transwell)48 h后,镜下可见:未共培养组SiHa细胞呈“鹅卵石”样排列,边缘钝圆,细胞间融合度好;共培养组SiHa细胞形态变化明显,细胞呈长梭形,排列杂乱,细胞间隙增大,细胞间融合度降低,具有明显的间质细胞形态。见图2。
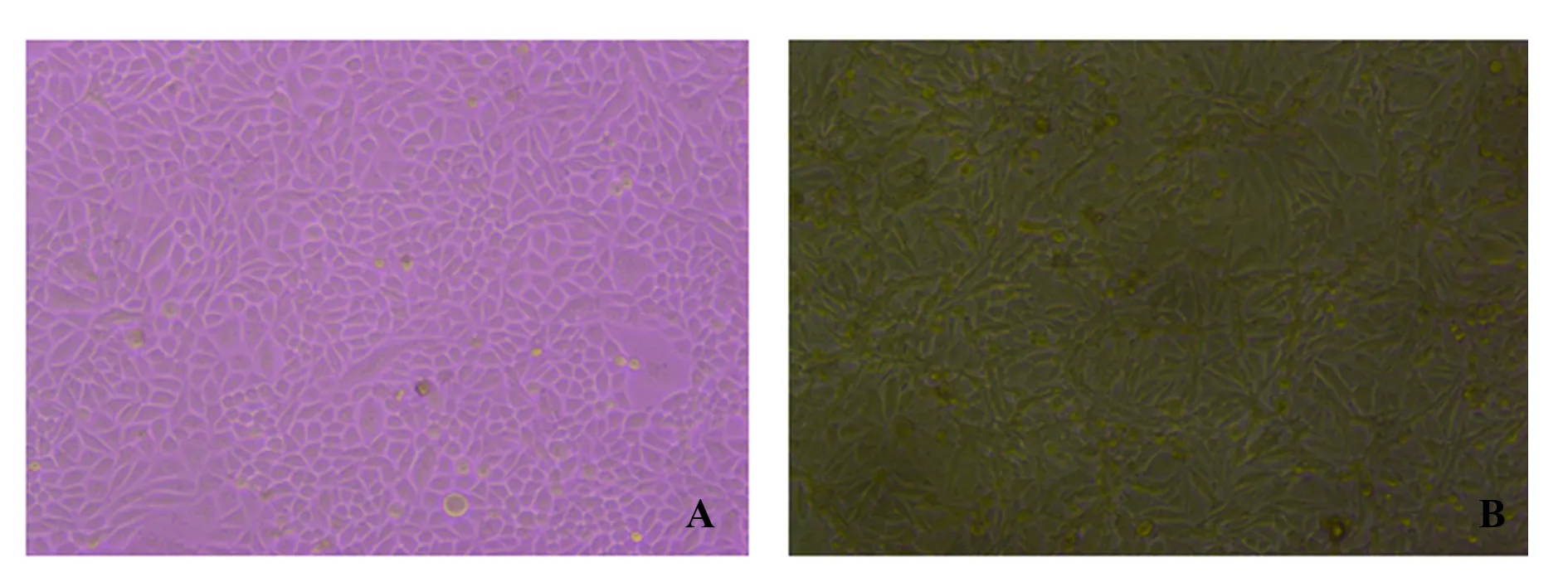
图2 与TAMs共培养后SiHa细胞的形态变化(×10)Fig.2 Morphological changes of SiHa cells after co-culture with TAMs (×10)Note: A.Non-culture;B.Co-culture group.
2.3TAMs-SiHa细胞共培养对SiHa细胞迁移、侵袭的影响 划痕实验结果显示:与未共培养组相比,各时间点与TAMs培养上清共培养的SiHa细胞迁移率均显著增大,差异有统计学意义(P<0.05),见图3和表1。此外,TAMs与SiHa细胞共培养(8 μm Transwell)24 h后,用0.1%结晶紫染色法检测穿过Transwell上室膜的SiHa细胞数来反映其迁移和侵袭能力。结果显示,迁移和侵袭实验共培养组穿过Transwell上室膜的SiHa细胞数均显著高于未共培养组,且差异有统计学意义(P<0.001)。提示与TAMs共培养后的SiHa细胞迁移和侵袭能力均增强。见图4和表2。
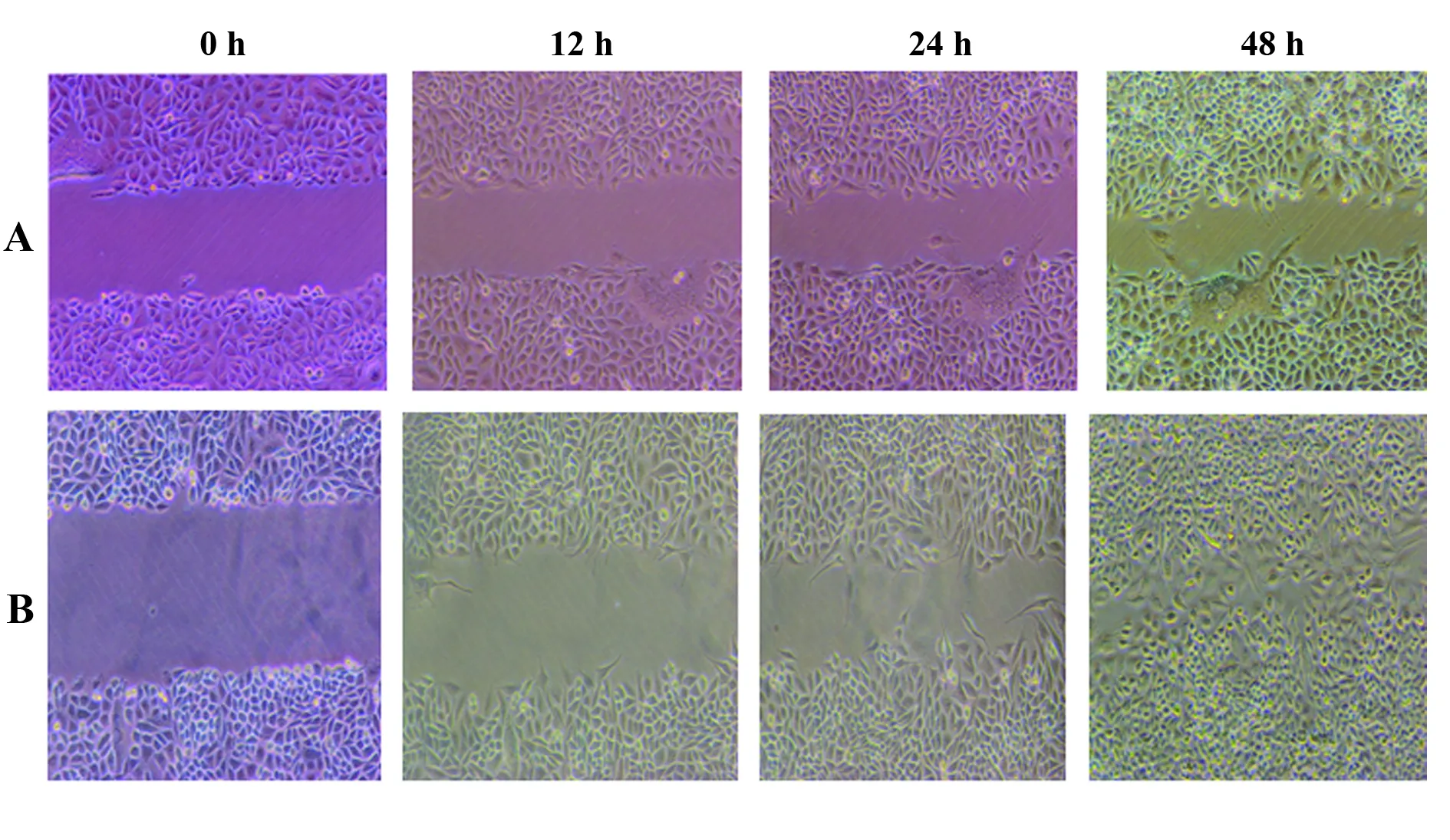
图3 TAMs培养上清对SiHa细胞迁移的影响Fig.3 Effect of TAMs culture supernatant on migration of SiHa cellsNote: A.Non-culture;B.Co-culture group.
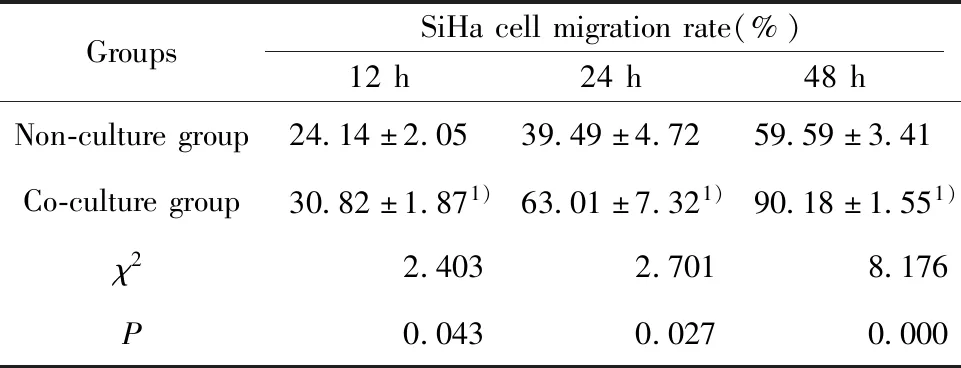
表1 TAMs培养上清对SiHa细胞迁移率的影响Tab.1 Effect of TAMs culture supernatant on migration rate of SiHa cells
Note:Compared with non-culture group, 1)P<0.05.

图4 TAMs-SiHa细胞共培养对SiHa细胞迁移与侵袭的影响Fig.4 Effect of TAMs-SiHa co-culture on migration and invasion of SiHa cells
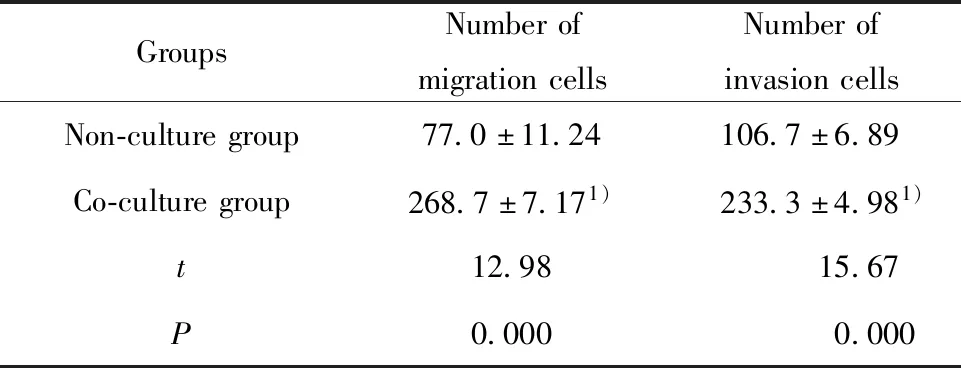
表2 TAMs-SiHa细胞共培养对SiHa细胞迁移与侵袭的影响Tab.2 Effect of TAMs-SiHa co-culture on migration and invasion of SiHa cells
Note:Compared with non-culture group, 1)P<0.001.
2.4TAMs-SiHa细胞共培养对SiHa细胞上皮间质转化相关蛋白表达水平的影响 TAMs与SiHa细胞共培养(0.4 μm Transwell)48 h后,共培养组SiHa细胞E-cadherin蛋白表达水平为0.18±0.01,显著低于未共培养组,差异有统计学意义(P<0.001)。共培养组SiHa细胞N-cadherin、Vimentin蛋白表达水平分别为0.89±0.04、0.64±0.03,均显著高于未共培养组,差异有统计学意义(P<0.01)。见图5和表3。
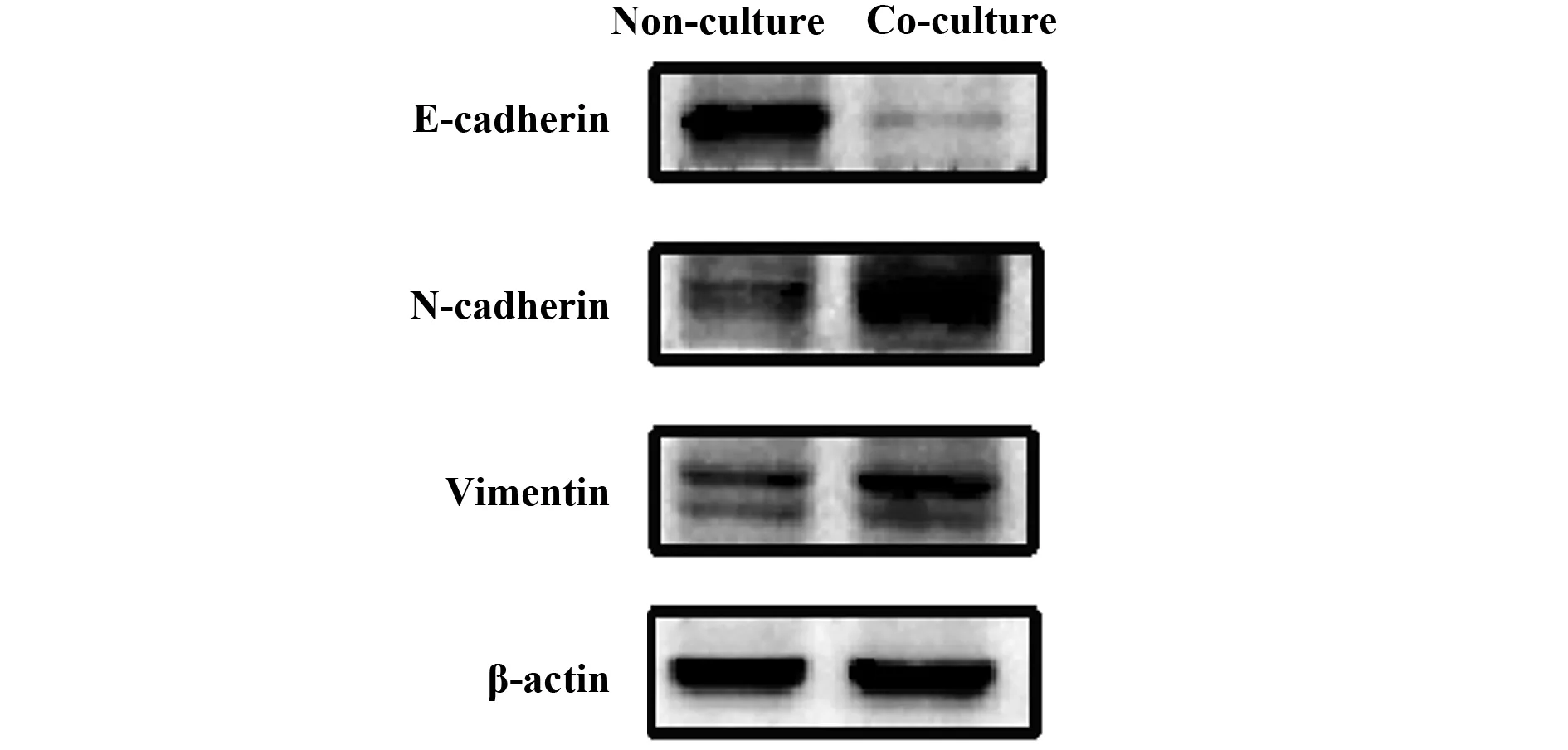
图5 TAMs-SiHa共培养对SiHa细胞上皮间质转化相关蛋白表达水平的影响Fig.5 Effect of TAMs-SiHa co-culture on expression levels of EMT related proteins in SiHa cells
2.5TAMs-SiHa细胞共培养对SiHa细胞Snail/Slug mRNA表达水平的影响 TAMs与SiHa细胞共培养(0.4 μm Transwell) 48 h后, RT-PCR检测转录因子Snail/Slug mRNA表达水平。结果显示,共培养组Snail、Slug mRNA表达水平分别为2.13±0.35、3.43±0.24,均显著高于未共培养组(P<0.05)。见表3。

表3 TAMs-SiHa细胞共培养对SiHa细胞上皮间质转化相关蛋白和Snail/Slug mRNA表达水平的影响Tab.3 Effect of TAMs-SiHa co-culture on expression levels of EMT related proteins and Snail/Slug mRNA in SiHa cells
Note:Compared with non-culture group, 1)P<0.05.

表4 SiHa细胞迁移和侵袭的细胞数与上皮间质转化相关蛋白、Snail/Slug mRNA表达水平的相关性分析Tab.4 Correlation analysis between number of migration and invasion of SiHa cells and expression levels of EMT related protein and Snail/Slug mRNA
2.6SiHa细胞迁移和侵袭的细胞数与上皮间质转化相关蛋白、Snail/Slug mRNA表达水平的相关性分析 结果如表4所示,SiHa细胞迁移和侵袭的细胞数与E-cadherin蛋白表达水平均呈负相关,而与N-cadherin、Vimentin蛋白表达水平均呈正相关(P<0.05)。SiHa细胞迁移和侵袭的细胞数与Snail mRNA表达水平均呈正相关(P<0.05),而与Slug mRNA表达水平均不相关。
3 讨论
近年来,宫颈癌的发病率逐年增加,且患病人群越来越年轻化,据估计全球每年新发宫颈癌病例约57万,死亡病例约31.1万[1]。尽管术前术后的辅助性化疗可以提高患者的生存率,但肿瘤的转移和侵袭仍然是宫颈癌患者治疗失败和死亡的主要原因[6]。目前,宫颈癌转移的具体机制尚未完全阐明。因此,进一步探讨宫颈癌的转移机制,积极探索有效防止肿瘤转移和复发的新方法,对于改善宫颈癌患者预后,提高患者生存率至关重要。
越来越多的研究表明肿瘤微环境对肿瘤的发生和进展起着重要作用[7]。肿瘤微环境不仅包括多种肿瘤细胞,还包括基质细胞,如内皮细胞、间充质干细胞以及巨噬细胞等,为肿瘤的进展提供支持[8]。在恶性肿瘤浸润的免疫细胞中,巨噬细胞含量最为丰富,通常具有明显的M2表型,称为肿瘤相关巨噬细胞(TAMs)。TAMs抗原提呈和吞噬作用能力弱,主要是通过自分泌、旁分泌多种细胞因子,诱导肿瘤周围微血管和淋巴管的生成,进而促进肿瘤细胞附着于血管表面,催化肿瘤外基质的降解和重建[9]。因此,TAMs作为肿瘤微环境的重要组成部分,在肿瘤的进展中发挥着重要作用。本研究通过体外实验将人急性白血病单核细胞系THP-1诱导成为TAMs,并采用Transwall小室将TAMs与宫颈癌SiHa细胞建立共培养体系,充分模拟体内肿瘤微环境,以此研究TAMs对SiHa细胞生长形态、迁移和侵袭的影响。结果显示,与TAMs共培养的SiHa细胞形态发生明显改变,细胞呈“长梭形、排列杂乱、细胞间融合度降低”,具有明显的间质细胞形态。癌细胞形态的改变与其功能密切相关,实验证实,与TAMs共培养的SiHa细胞迁移和侵袭能力明显增强,提示当SiHa细胞形态发生改变后,细胞间黏附变差,浸润和迁移能力增强,说明TAMs在促进SiHa细胞迁移和侵袭的过程中发挥了重要作用。
为了探究TAMs促进SiHa细胞迁移和侵袭的机制,本研究检测了上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白的表达。EMT是肿瘤进展的一个关键步骤,并且在肿瘤的侵袭和转移过程中发挥重要作用[10]。EMT通过促使上皮细胞在某些因素作用下,失去细胞极性,丢失细胞间紧密连接和黏附连接,获得浸润和迁移能力,最终实现远处转移[11]。有研究显示,TAMs可通过促进肿瘤细胞EMT进展进而促进乳腺癌[12]、肺癌[13]和肝癌[14]等肿瘤的侵袭和转移。那么在宫颈癌中,TAMs是否可以调控SiHa细胞的EMT进展,本实验通过TAMs与SiHa细胞共培养来观察SiHa细胞EMT相关蛋白的表达情况,结果显示与TAMs共培养的SiHa细胞上皮细胞标志物如E-钙黏蛋白(E-cadherin)表达水平显著降低,而间质细胞标志物如N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)表达水平显著升高,表明TAMs可以促进SiHa细胞的EMT进展。
机体内调控细胞EMT效应的关键转录因子(transcription factors,TFs)包括锌指蛋白、Snail、Slug和Twist等[15],其中Snail/Slug的研究最为多见。Snail是转录抑制因子Snail超家族的一员,家族成员有Snail、 Slug、E12/E47、ZEB1、SIP1。Snail家族的结构相似,C-末端含有4~5个C2H2型的锌指DNA的结合区域,每个锌指结构包括一个α螺旋和两个β链;N-末端含有SNAG结构域,对转录抑制因子复合物的结合至关重要[16]。有研究表明,转录因子Snail、Slug与促进前列腺癌转移的EMT进展相关[17]。Chien等[18]通过下调Snail、Slug表达水平,发现EMT相关蛋白E-cadherin表达升高,N-cadherin和Vimentin表达降低,证实了下调Snail/Slug表达水平可以逆转EMT进程。此外,在其他肿瘤中如结直肠癌[19]、乳腺癌[20]等也可观察到Snail参与调节E-cadherin的表达来调控EMT。因此,我们推测Snail/Slug途径可能是TAMs调控宫颈癌细胞EMT效应的通路之一。本研究通过RT-PCR技术检测了Snail、Slug的mRNA表达水平。结果显示,与TAMs共培养的SiHa细胞Snail、Slug的mRNA表达水平均显著升高,提示Snail/Slug可能在TAMs促进SiHa细胞EMT进展中起着重要作用。
为了探讨SiHa细胞迁移和侵袭能力与上皮间质转化相关蛋白、Snail/Slug mRNA表达水平之间的关系,本研究对SiHa细胞与TAMs共培养前后,SiHa细胞迁移和侵袭的细胞数与E-cadherin、N-cadherin、Vimentin蛋白和Snail/Slug mRNA表达水平进行了Pearson相关性分析。研究发现,SiHa细胞迁移和侵袭的细胞数与E-cadherin蛋白表达水平具有显著的负性相关性,而与N-cadherin、Vimentin蛋白表达水平具有显著正性相关性。SiHa细胞迁移和侵袭的细胞数与Snail mRNA表达水平呈正性相关,而与Slug mRNA表达水平不相关。据此推测,在TAMs促进SiHa细胞迁移和侵袭的过程中,Snail表达上调可能加快了SiHa细胞的EMT进展,从而促进了SiHa细胞的迁移和侵袭。
综上所述,本研究表明TAMs在促进宫颈癌细胞的迁移和侵袭过程中发挥了重要作用,可能是通过上调Snail表达促进宫颈癌细胞EMT进展来发挥作用的。因此,抑制肿瘤微环境中的巨噬细胞向TAMs的转化,负向调控Snail的表达可能会抑制宫颈癌细胞的EMT进展,从而阻止宫颈癌细胞的侵袭和转移,改善患者的预后情况。
