谷胱甘肽过氧化物酶-3在腮腺多形性腺瘤中的表达及意义
2020-02-25阿迪力麦木提敏安尼卡尔安尼瓦尔帕丽黛姆图尔迪吴佩玲
张 帆, 刘 啸, 阿迪力·麦木提敏, 安尼卡尔·安尼瓦尔,帕丽黛姆·图尔迪, 吴佩玲
(新疆医科大学第二附属医院口腔医学诊疗中心,新疆维吾尔自治区 乌鲁木齐 830000)
腮腺多形性腺瘤是由肿瘤上皮性组织和黏液样或软骨样间质所组成的一种唾液腺肿瘤,WHO根据其组织病理学及生物学特性,将其界定为临界瘤。该疾病手术治疗后易复发,肿瘤浸润包膜或多次复发后可导致肿瘤恶变[1]。研究发现,细胞遗传学改变、细胞外基质蛋白、癌基因、抑癌基因及黏附分子,均在腮腺多形性腺瘤的发生、恶变过程中发挥了一定的作用[2]。谷胱甘肽过氧化物酶-3(GPX-3)是已知GPX家族中唯一的细胞外亚型,是体内重要的过氧化物分解酶之一,在清除过氧化氢及脂质过氧化物中起重要作用[3]。研究发现,GPX-3可以通过传递电子体使体内的磷脂、脂肪酸过氧化氢减少。过氧化氢可参与肿瘤细胞的各种生物学行为过程,如肿瘤细胞的增殖、移动及侵袭[4]。多种因素可导致GPX-3表达变化,并与多种疾病的发生、发展相关,已有研究表明GPX-3在肿瘤组织中呈现低表达[5]。但国内外有关GPX-3在腮腺多形性腺瘤中表达的报道较为罕见。本研究通过荧光定量PCR及蛋白免疫印迹法检测腮腺多形性腺瘤及瘤旁组织中GPX-3基因和蛋白的表达水平,来探讨GPX-3的表达与腮腺多形性腺瘤发生与恶变的相关性,为腮腺多形性腺瘤的基因预测及治疗提供新思路。
1 资料和方法
1.1 临床资料
本研究随机选取2017-06—2019-04期间,新疆医科大学第一附属医院、新疆医科大学第二附属医院,以及新疆维吾尔自治区人民医院收集的标本(腮腺良性多形性腺瘤30例、腮腺多形性腺瘤瘤旁2 cm腺体组织30例、腮腺恶性多形性腺瘤10例)。其中男性42例,女性28例;50岁以上46例,50岁以下24例;肿瘤平均大小3.2 cm。纳入标准:临床病理诊断为腮腺良、恶性多形性腺瘤(图1)及瘤旁2 cm腺体组织的手术样本,且均未行任何辅助治疗;患者同意并签订样本留取知情同意书,并记录患者临床资料。排除标准:曾接受术前放疗或化疗患者的样本组织。30例腮腺良性多形性腺瘤组织为良性组,30例肿瘤边缘2 cm腮腺组织为正常组,10例腮腺恶性多形性腺瘤组织为恶性组。所有样本均由2名经验丰富的主治医师及以上级别的病理医师诊断。根据肿瘤大小从肿瘤中心至边缘分别取多个样本,分别分成2份,1份放置液氮罐中冻存,另1份送病理检查,经病理证实后纳入样本。
1.2 主要试剂和仪器
主要试剂和仪器包括:Trizol试剂(Invitrogen公司,美国)、反转录试剂盒(Thermo公司,美国)、荧光定量PCR试剂盒(QIAGEN公司,德国)、GPX-3羊抗人多克隆抗体 (Abcam公司,英国)、兔抗人βactin多克隆抗体(Abcam公司,英国)、聚偏二氟乙烯膜(罗氏公司,德国)、Applied Biosystems 7500荧光定量PCR仪(ABI公司,美国)、凝胶成像仪(Bio-Rad 公司,美国)、酶标仪(Thermo 公司,美国);GPX-3及β-actin引物均由上海生工基因合成。

图1 腮腺良性多形性腺瘤(A)和腮腺恶性多形性腺瘤(B)的组织病理学表现(×100)Figure 1 Histopathological findings of benign pleomorphic adenoma of parotid gland (A)and malignant pleomorphic adenoma of parotid gland(B) (×100)
1.3 荧光定量PCR检测GPX-3的mRNA表达
取100 mg组织,用眼科剪剪成小块,置于组织匀浆机中研成粉末,加入1 mL Trizol试剂,静置15 min;加入1/5体积的氯仿,混匀于冰上放置5 min。4℃下12 000 r/min离心15 min,吸取上清液至新的EP管中,加入等体积的异丙醇混匀,-20℃下放置0.5 h,4℃下12 000 r/min离心10 min。加入75%乙醇溶液1 mL,抽吸使沉淀物悬浮,4℃下12 000 r/min离心5 min,弃上清液,再次加入75%乙醇溶液;重复此步骤,后置于冰上待乙醇挥发;再加入适量焦碳酸二乙酯(DEPC)水,4℃12 000 r/min离心1 min,所得溶液即为总RNA。利用Nandrop分光光度计测定RNA浓度及A260/A280比值。根据试剂盒说明书,将RNA反转录为cDNA,以 cDNA为模板进行PCR扩增。采用相对定量法,以β-actin作为内参基因,相关目的基因及内参基因序列如表1所示。PCR体系为 20 μL,具体包括 2×SYBR Green PCR Master Mix、QN ROX Reference Dye 2 μL,上游、下游引物各 1.4 μL,RNase-free water 3.2 μL,cDNA 2 μL。并且每个样本设置3个复孔,检测3个生物学重复。反应条件为:95℃预变性 2 min;95℃变性5 s,60℃ 退火10 s,35个循环。在Applied Biosystems 7500荧光定量PCR仪器中进行,用 2-ΔΔCt法计算各组相对表达量,比较3组表达量的差异,并行统计学分析。

表1 荧光定量PCR引物序列Table 1 Real-time PCR primer sequences
1.4 蛋白免疫印迹法检测GPX-3的蛋白表达
取100 mg组织,用眼科剪剪成小块,置于组织匀浆机中研成粉末,加入1 mL的RIPA裂解液和10 μL的苯甲基磺酰氟超声处理。处理完后置冰上裂解0.5 h,10 000 g/min离心10 min,取中层溶液即为所提蛋白,二喹啉甲酸(BCA)法测蛋白浓度。取20 μL蛋白在12%SDS-PAGE中进行电泳,半干法转膜,5%脱脂奶粉室温封闭2 h,4℃一抗孵育过夜。用1×TBST洗膜3次,每次15 min,加入二抗室温孵育2 h。用 1×TBST洗膜 3次,每次15 min,之后在暗室中加入ECT发光剂进行显影,Image Lab软件分析各条带灰度值,以GPX-3蛋白条带与β-actin蛋白条带的比值作为GPX-3蛋白的相对表达量。实验重复3次,比较3组表达量的差异,并行统计学分析。
1.5 统计学处理
使用SPSS 21.0软件对数据进行统计分析,采用K-S检验数据是否呈正态分布,Levene检验方差齐性,GPX-3 mRNA及蛋白表达量采用均数±标准误表示,不符合正态分布则使用秩和检验,多组组间差异性检验采用ANOVA方差分析,两两比较以对照组为参照进行Dunnett检验,GPX-3在不同年龄、性别及肿瘤大小中的表达阳性率运用独立四格表χ2检验,均以双侧P<0.05为差异具有统计学意义。
2 结果
2.1 GPX-3 mRNA的表达
腮腺良性多形性腺瘤、腮腺恶性多形性腺瘤中mRNA的相对表达量明显低于瘤旁组织,且腮腺恶性多形性腺瘤中mRNA的相对表达量最低,组间差异有统计学意义(P<0.01,表 2、图 2、图 3)。
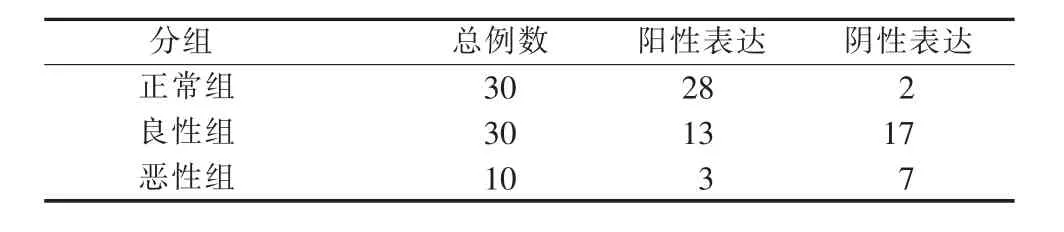
表2GPX-3 mRNA在瘤旁腺体组织及腮腺良恶性多形性腺瘤中的表达结果(例)Table 2 Expression of GPX-3 mRNA in para-tumor glandular tissue and benign and malignant parotid pleomorphic adenoma(case)

图2 荧光定量PCR分析GPX-3基因在瘤旁腺体组织及腮腺良恶性多形性腺瘤中的相对表达量Figure 2 Quantitative PCR analysis of GPX-3 gene in paraneoplastic glandular tissue,benign and malignant parotid pleomorphic adenoma
2.2 GPX-3蛋白在瘤旁组织与腮腺良恶性多形性腺瘤中的表达
腮腺多形性腺瘤瘤旁腺体组织、腮腺良性多形性腺瘤、腮腺恶性多形性腺瘤中蛋白的表达量分别为 0.94±0.01、0.35±0.02、0.11±0.01(表 3),差异有统计学意义(P<0.01)。GPX-3 蛋白在腮腺良、恶性多形性腺瘤中的表达明显低于瘤旁组织(P<0.01,表3、图4、图 5)。

图3 腮腺良恶性多形性腺瘤中GPX-3基因相对瘤旁腺体组织的表达分布Figure 3 Expression distribution of GPX-3 gene in benign and malignant pleomorphic adenomas of the parotid gland relative to adjacent tumor tissue

表3 GPX-3蛋白在瘤旁腺体组织、腮腺良恶性多形性腺瘤中的表达结果(例)Table 3 Expression of GPX-3 protein in paraneoplastic glandular tissue,benign parotid pleomorphic adenoma,malignant parotid pleomorphic adenoma(case)

图4 蛋白免疫印迹法分析GPX-3蛋白在瘤旁腺体组织及腮腺良恶性多形性腺瘤中的表达Figure4 Western blot analysis of GPX-3 protein expression in para-glandularglandulartissue,benignparotidpleomorphicadenoma,malignantparotidpleomorphicadenoma
2.3 GPX-3 mRNA和蛋白的表达与其临床病理特征的关系
如表4、表5所示:GPX-3 mRNA和蛋白在腮腺多形性腺瘤中的表达,与患者的年龄、性别、肿瘤大小、组织学分级及分化程度无关(均P>0.05),但与腮腺恶性多形性腺瘤的TNM分期、恶性成分比例有关(均P<0.05)。
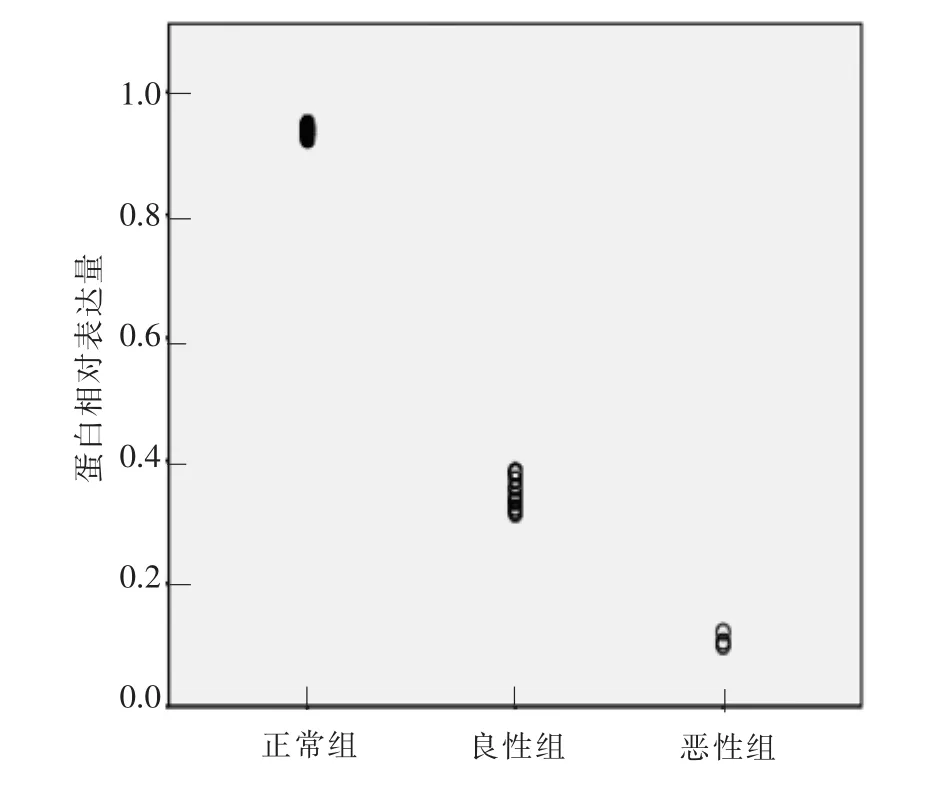
图5 GPX-3蛋白在瘤旁腺体组织及腮腺良恶性多形性腺瘤中的表达分布Figure 5 GPX-3 protein expression and distribution in benign and malignant pleomorphic adenomas of the parotid glands and parotid glands
3 讨论
腮腺多形性腺瘤的发生起源于腺管和肌上皮细胞,是名副其实的“混合瘤”,其病理学表现多样,可见肿瘤性上皮组织和黏液样或软骨样间质,根据其成分比例,可分为细胞丰富型和间质丰富型。一般认为,细胞丰富型相对较易恶变,间质丰富型相对较易复发。若处理不当,则易导致肿瘤复发[6]。如何减少术后复发是腮腺多形性腺瘤的一大挑战。许多学者认为,术中肿瘤切除不完全易导致复发[7],故腮腺多形性腺瘤的切除范围一直是研究的热点。程晗菲等[8]发现,基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)及血管内皮生长因子(vascular endothelial growth factor,VEGF)在恶性腮腺多形性腺瘤中呈高表达,相比瘤旁1 cm组织,差异有统计学意义(P<0.05),证实瘤旁1 cm是腮腺多形性腺瘤切除的安全界限。而刘志明等[9]研究发现,人第10号染色体缺失的磷酸酶(phosphatase and tensin homolog deleted on chromosome then,PTEN)在腮腺多形性腺瘤及瘤旁0.5~1.0 cm组织中表达均低于正常腺体组织(P<0.05),而PTEN在瘤旁2 cm组织与正常腺体组织中表达差异无统计学意义 (P>0.05),这为本实验采取瘤旁2 cm组织为正常对照组提供了理论依据。本研究结果发现,GPX-3在腮腺多形性腺瘤与瘤旁组织中的表达有显著差异 (P<0.05),在基因和蛋白的表达量上支持临床病理诊断。
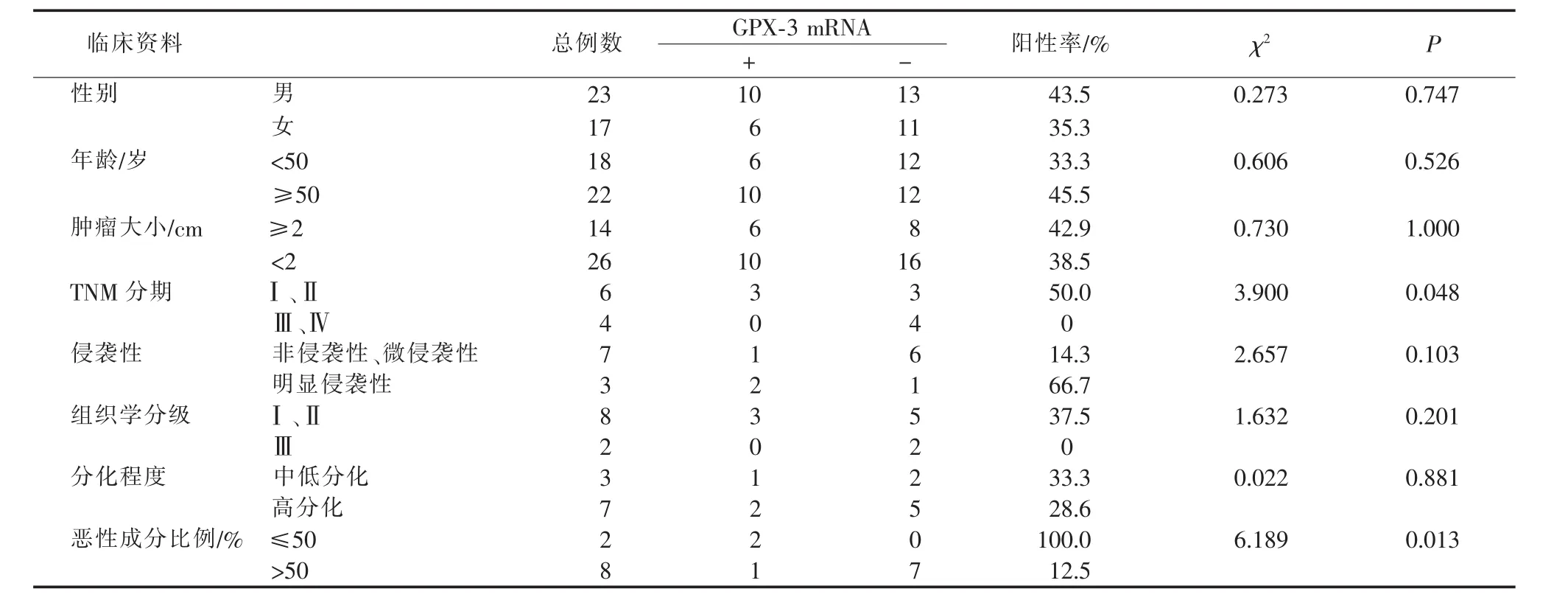
表4 GPX-3 mRNA与腮腺多形性腺瘤临床病理特征的关系(例)Table 4 Relationship between GPX-3 mRNA and clinicopathological features of parotid pleomorphic adenoma(case)

表5 GPX-3蛋白与腮腺多形性腺瘤临床病理特征的关系(例)Table 5 Relationship between GPX-3 protein and clinicopathological features of parotid pleomorphic adenoma(case)
GPX家族有8个成员 (GPX1-GPX8),其主要功能是催化谷胱甘肽 (GSH)转化为还原型谷胱甘肽(GSSG)[10-11]。GPX-3是目前已知唯一含有细胞外抗氧化异构体的硒半胱氨酸,它能消除机体内的过氧化氢和脂质过氧化物,阻断活性氧自由基对机体的损害。GPX-3异常失活可能导致组织细胞中ROS的过度产生和积累,引起上皮细胞DNA损伤,最终导致肿瘤发生[12]。多种报道显示GPX-3是一种有效抑制肿瘤发展的基因。有学者发现GPX-3在乳腺癌中的表达明显低于相应的癌旁组织,GPX-3的表达与乳腺癌的恶性程度及预后有关[13]。Zhou等[14]发现GPX-3高甲基化导致GPX-3在胃癌中表达下调。而关于GPX-3在腮腺多形性腺瘤中的表达少有报道。本研究通过荧光定量PCR和蛋白印迹法,检测了GPX-3mRNA及其蛋白在腮腺良、恶性多形性腺瘤及瘤旁组织中的表达,发现GPX-3 mRNA及蛋白的表达在腮腺良恶性多形性腺瘤中较瘤旁正常组织中明显下降,差异有统计学意义 (P<0.05),提示GPX-3参与了腮腺多形性腺瘤的发生及恶变。本研究结果与GPX-3在其他肿瘤中的表达趋势一致,包括肺癌[15]、甲状腺癌[16]、结肠癌[17]、黑色素瘤[18]、食管腺癌[19]、胃癌[14]等。而在临床病理特征上,GPX-3在腮腺多形性腺瘤中的表达与患者年龄、性别、肿瘤大小、组织学分级及分化程度无明显关系,但与腮腺恶性多形性腺瘤的TNM分期、侵袭性、恶性成分比例有关,这与在乳腺癌中发现的结果基本一致。本研究结果提示,GPX-3的低表达与腮腺多形性腺瘤的发生、发展及恶变密切相关,为GPX-3作为一种辅助因子来预测腮腺多形性腺瘤是否恶变,并评估预后提供了理论基础。但因腮腺恶性多形性腺瘤较为少见,故本研究恶性组样本较少,可能使本研究中GPX-3与腮腺多形性腺瘤恶性程度的关系,与其他恶性肿瘤的相关研究结果略有差异。后期值得在更大样本中,进一步研究GPX-3与腮腺多形性腺瘤复发及恶变的关系。
关于GPX-3的表达机制,有研究显示DNA甲基化是导致基因表达沉默的常见机制之一[19],国外研究发现GPX-3高甲基化可能导致GPX-3在肿瘤中呈现低表达[20],且Zhou等[14]发现GPX-3高甲基化可能是老年胃癌患者术后复发的预后指标。本研究探讨了GPX-3的表达与腮腺多形性腺瘤发生及恶变的相关性,但GPX-3高甲基化与其表达下降的关系仍需进一步研究。最新研究通过调节肿瘤细胞中的GPX-3水平来抑制肿瘤细胞的生长及更新,进一步为GPX-3对肿瘤的靶向治疗提供了潜在可能[21]。本研究发现GPX-3在腮腺多形性腺瘤中的表达下降,且GPX-3的低表达与腮腺多形性腺瘤的发生及恶变密切相关,故GPX-3有望成为腮腺多形性腺瘤恶变及预后的生物学指标。目前GPX-3对肿瘤的作用机制尚不明确,在临床的靶向治疗上仍需进一步研究。随着GPX-3作用机制研究的深入,它终将在肿瘤基因靶向治疗上进一步被突破,为腮腺多形性腺瘤复发及恶变的治疗提供新思路,从而减少反复手术对患者造成的创伤。
