葛花解酲方对乙醇性HBV转基因小鼠肝癌前病变GST-Pi和PCNA表达及Wnt/β-catenin信号通路的影响①
2020-02-20吴文宇龙奉玺魏显鳗税会利唐东昕
吴文宇 杨 柱 龙奉玺 罗 莉 魏显鳗 税会利 唐东昕
(贵州中医药大学第一附属医院肿瘤科,贵阳 550001)
肝癌是我国常见的恶性肿瘤之一,肝癌的发病率和死亡率均比较高,对人类健康造成严重危害,有效防治肝癌的发生发展是临床工作中面临的艰巨而紧迫的问题。肝癌起病隐匿,预后差,肝癌的发生经历了慢性肝炎、肝硬化、肝癌前病变、肝癌等漫长的病情发展过程,肝硬化是肝癌的独立危险因素。肝癌前病变的形态学特征为异型增生结节,异型增生结节为肝硬化结节发展的结果,是肝癌启动、促进、演变过程的中间环节,阻断肝硬化结节向肝异型增生结节发展是阻断肝癌的理想时机[1]。葛花解酲方由豆蔻仁、葛花、砂仁、炒神曲、白术、干姜、泽泻、茯苓、猪苓、橘皮、人参、木香、青皮组成,具有分消酒湿、温中健脾、消补兼施的功效,在治疗酒精性肝病中具有良好效果,研究发现葛花解酲方对肝癌的发生发展也有阻止作用[2,3],但其机制尚不完全清楚。GST-Pi在癌前阶段已开始表达,是肝癌的早期诊断指标[4,5];PCNA为细胞核增殖相关抗原,可作为增殖期的标志物[6];Wnt/β-catenin信号通路在恶性肿瘤的生长、凋亡等过程中发挥中药作用,参与恶性肿瘤的增殖过程[7,8]。本文通过对葛花解酲方对乙醇性HBV转基因小鼠肝癌前病变GST-Pi和PCNA表达及Wnt/β-catenin信号通路的影响进行研究,探讨葛花解酲方逆转肝癌前病变的可能机制。
1 材料与方法
1.1材料
1.1.1实验动物 雄性、6~8周龄、体重20~24 g、HBV转基因小鼠100只,购自中国人民解放军第458医院全军肝病中心,许可证号:SCXK(军)2012-0018。
1.1.2实验用药 豆蔻仁15 g,葛花15 g,砂仁15 g,炒神曲6 g,白术6 g,干姜6 g,泽泻6 g,茯苓4.5 g,猪苓4.5 g,橘皮4.5 g,人参4.5 g,木香1.5 g,青皮0.9 g,所有药材购自北京同仁堂大药房,按照药方配方制成浓度为4 g/ml水煎剂备用。
1.1.3主要试剂 红星二锅头白酒(北京红星股份有限公司),免疫组化染色试剂盒、二氨基联苯胺(DAB)显色试剂盒、HE染色试剂盒(美国Sigma公司),兔抗鼠GST-Pi单克隆抗体、兔抗鼠PCNA单克隆抗体、兔抗鼠Wnt-1多克隆抗体、兔抗鼠β-catenin多克隆抗体等抗体(英国Abcam公司)等。
1.2方法
1.2.1动物分组 将100只小鼠根据随机数字法分为对照组、模型组、葛花解酲方组和葛花解酲方+LiCl组,每组25只。
1.2.2建立肝癌癌前病变小鼠模型 将模型组、葛花解酲方组和葛花解酲方+LiCl组小鼠给予53%(v/v)红星二锅头灌胃,10 ml/(kg·d),每天灌胃1次,对照组小鼠每天等量生理盐水灌胃,共20周。
1.2.3各组小鼠处理 葛花解酲方组和葛花解酲方+LiCl组小鼠在每天红星二锅头灌胃前30 min给予葛花解酲方水煎剂(40 g/kg)灌胃,每天1次;对照组和模型组每天给予等量生理盐水灌胃;葛花解酲方+LiCl组小鼠在葛花解酲方灌胃前30 min给予LiCl[1 mEq/(kg·d)]灌胃[9],每天1次,其他三组小鼠给予等量生理盐水灌胃。共20周。
1.2.4标本采集及处理 20周结束时,每组取10只小鼠脱臼处死,立即取小鼠肝脏用于测定肝脏重量、肝脏指数和Western blot检查;每组另取10只小鼠,脱臼处死后取肝脏组织于多聚甲醛中固定24 h,用于HE染色和免疫组化染色。
1.2.5肝脏重量和肝脏指数测定 将10只小鼠处死前称重,处死后立即取肝脏组织称重,计算各小鼠肝脏指数,肝脏指数=肝脏重量/小鼠体重(mg/g)。
1.2.6HE染色观察肝脏病理学变化 石蜡包埋多聚甲醛固定的肝脏组织,切成5 μm切片,经脱蜡至水,苏木素染色5 min,乙醇分色5 s,氨水返蓝20 s,伊红染色3 min,乙醇脱水,二甲苯透明,中性树胶封固。
1.2.7免疫组化染色测定肝脏GST-Pi和PCNA表达 将石蜡切片置入烤箱中烤片1 h,经脱蜡至水,放入枸橼酸钠缓冲液中修复10 min,加入过氧化氢封闭10 min消除内源性过氧化物酶的活性,加入抗原封闭液封闭30 min,加入一抗:兔抗鼠GST-Pi单克隆抗体(1∶200)、兔抗鼠PCNA单克隆抗体(1∶200)过夜孵育,加入抗兔二抗孵育30 min,DAB显色10 min,苏木素复染,二甲苯透明、中性树胶封片。阴性对照用PBS代替。细胞核或细胞浆中出现棕黄色颗粒为阳性,GST-Pi主要分布在肝细胞浆中,PCNA主要分布在肝细胞核中。每张切片拍摄5个高倍视野(400倍),采用Image-Pro-plus6.0图像分析软件测定GST-Pi和PCNA的积分光密度(IOD)。
1.2.8Western blot测定肝脏组织中Wnt-1、β-catenin蛋白水平 将肝脏组织匀浆,提取肝组织总蛋白,采用BCA测定肝组织蛋白浓度和含量,每孔上样量20 μg,进行转膜、脱脂奶粉封闭,加入一抗:兔抗鼠Wnt-1多克隆抗体(1∶1 000)、兔抗鼠β-catenin多克隆抗体(1∶1 000)过夜孵育,以β-actin为内参照,加入二抗孵育1 h,显色液显色,采用Quantity One软件分析条带亮度,肝脏组织中Wnt-1、β-catenin蛋白水平以Wnt-1、β-catenin条带灰度值/β-actenin条带灰度值表示。
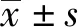
2 结果
2.1各组小鼠肝脏重量、肝脏指数比较 与对照组比较,模型组小鼠肝脏重量和肝脏指数升高(P<0.05);与模型组比较, 葛花解酲方组小鼠肝脏重量和肝脏指数降低(P<0.05);与葛花解酲方组比较,葛花解酲方+LiCl组小鼠肝脏重量和肝脏指数升高(P<0.05)。见表1。

GroupsnLiverweight(g)Liverindex(mg/g)Controlgroup101.358±0.02345.21±1.34Modelgroup101.542±0.0191)60.47±1.421)GehuaJiechenggroup101.411±0.0211)2)49.53±1.461)2)GehuaJiecheng+LiClgroup101.478±0.0221)2)3)54.37±1.391)2)3)F141.067218.290P0.0000.000
Note:Compared with the Control group,1)P<0.05;compared with the Model group,2)P<0.05;compared with the Gehua Jiecheng group,3)P<0.05.
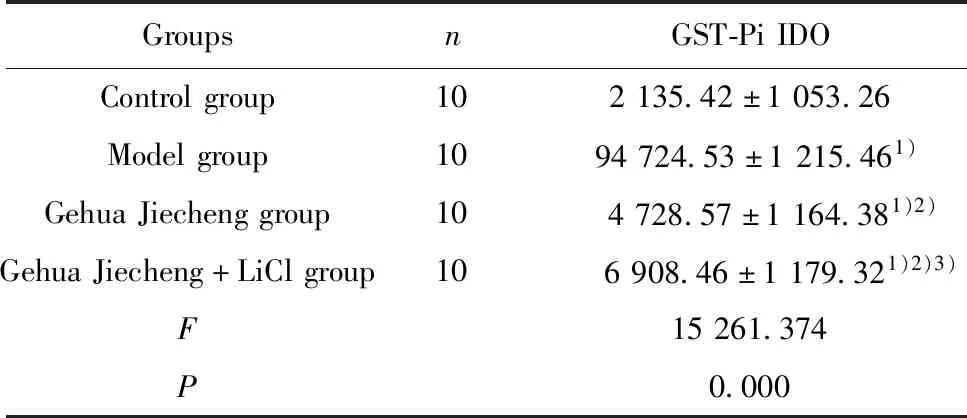
2.2各组小鼠肝脏HE染色情况 对照组小鼠肝脏结构和形态正常,有完整的汇管区和肝小叶;模型组小鼠肝细胞变质和结节性增生明显,可见典型的假小叶,肝细胞变质主要为小滴质变、水肿、点状坏死,增生肝细胞体积增大、核染色深,炎症细胞浸润、纤维增生和胆管异常增生明显,胆管上皮增生并具有异型性;葛花解酲方组小鼠肝细胞变质、结节性增生、炎症细胞浸润、胆管上皮增生及异型性较轻;葛花解酲方+LiCl组小鼠肝细胞变质、结节性增生、炎症细胞浸润、胆管上皮增生及异型性介于模型组和葛花解酲方组之间。见图1。
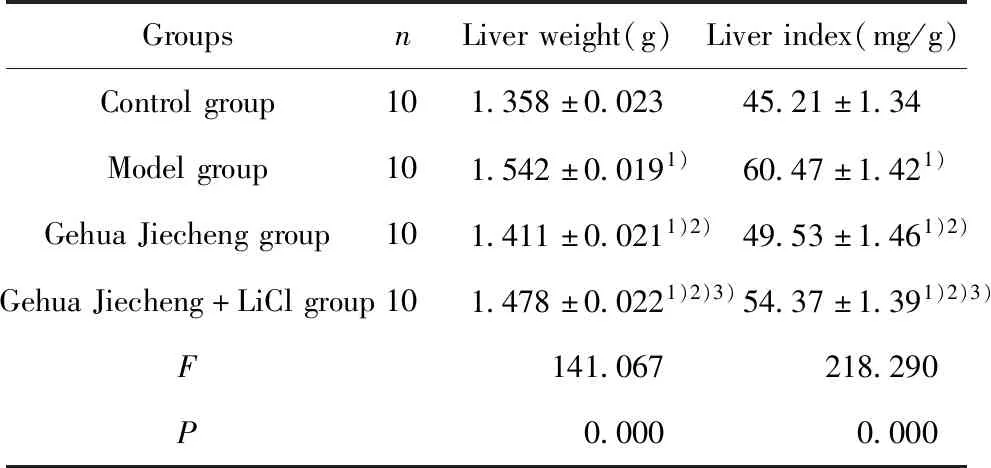
2.3各组小鼠肝脏GST-Pi表达比较 与对照组比较,模型组小鼠肝脏GST-Pi IDO升高(P<0.05);与模型组比较,葛花解酲方组小鼠肝脏GST-Pi IDO降低(P<0.05);与葛花解酲方组比较,葛花解酲方+LiCl组小鼠肝脏GST-Pi IDO升高(P<0.05)。见表2和图2。
2.4各组小鼠肝脏PCNA表达比较 与对照组比较,模型组小鼠肝脏PCNA IDO升高(P<0.05);与模型组比较,葛花解酲方组小鼠肝脏PCNA IDO降低(P<0.05);与葛花解酲方组比较,葛花解酲方+LiCl组小鼠肝脏PCNA IDO升高(P<0.05)。见表3和图3。

图1 各组小鼠肝脏HE染色(×100)Fig.1 HE staining of liver in each group of mice(×100)Note:A.Control group;B.Model group;C.Gehua Jiecheng;D.Gehua Jiecheng+LiCl group.

GroupsnGST-PiIDOControlgroup102135.42±1053.26Modelgroup1094724.53±1215.461)GehuaJiechenggroup10 4728.57±1164.381)2)GehuaJiecheng+LiClgroup10 6908.46±1179.321)2)3)F15261.374P0.000
Note:Compared with the Control group,1)P<0.05;compared with the Model group,2)P<0.05;compared with the Gehua Jiecheng group,3)P<0.05.
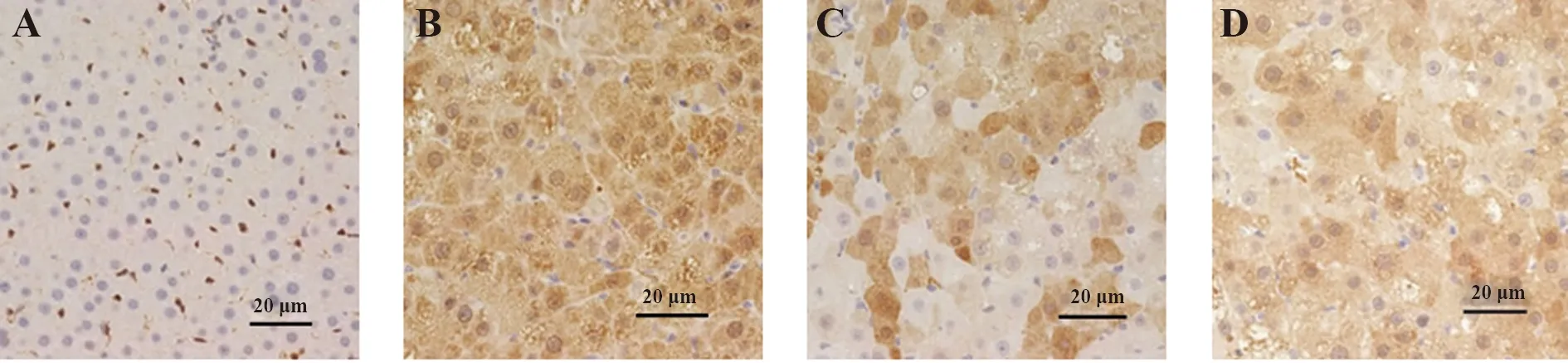
图2 各组小鼠肝脏GST-Pi免疫组化染色(×400)Fig.2 Immunohistochemical staining of liver GST-Pi in each group of mice(×400)Note:A.Control group;B.Model group;C.Gehua Jiecheng;D.Gehua Jiecheng+LiCl group.

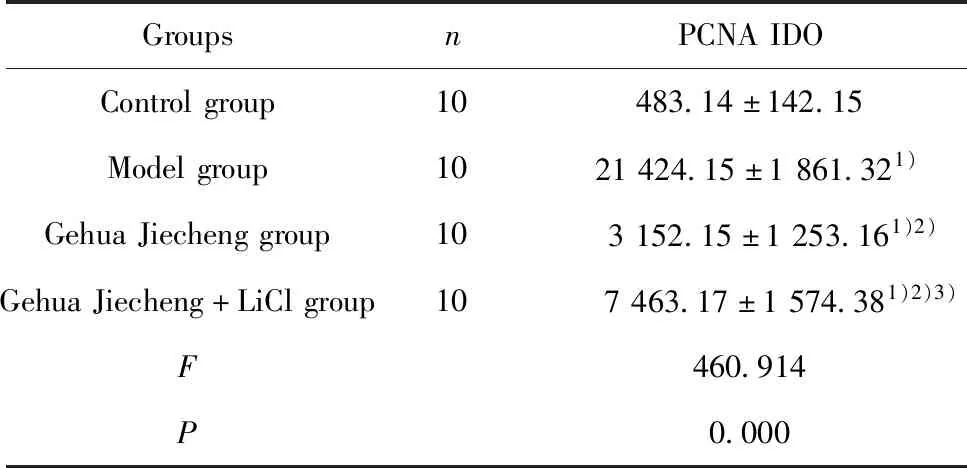
GroupsnPCNAIDOControlgroup10483.14±142.15Modelgroup1021424.15±1861.321)GehuaJiechenggroup10 3152.15±1253.161)2)GehuaJiecheng+LiClgroup10 7463.17±1574.381)2)3)F460.914P0.000
Note:Compared with the Control group,1)P<0.05;compared with the Model group,2)P<0.05;compared with the Gehua Jiecheng group,3)P<0.05.

图3 各组小鼠肝脏PCNA IDO免疫组化染色(×400)Fig.3 Immunohistochemical staining of PCNA IDO in liver of each group of mice(×400)Note:A.Control group;B.Model group;C.Gehua Jiecheng;D.Gehua Jiecheng+LiCl group.

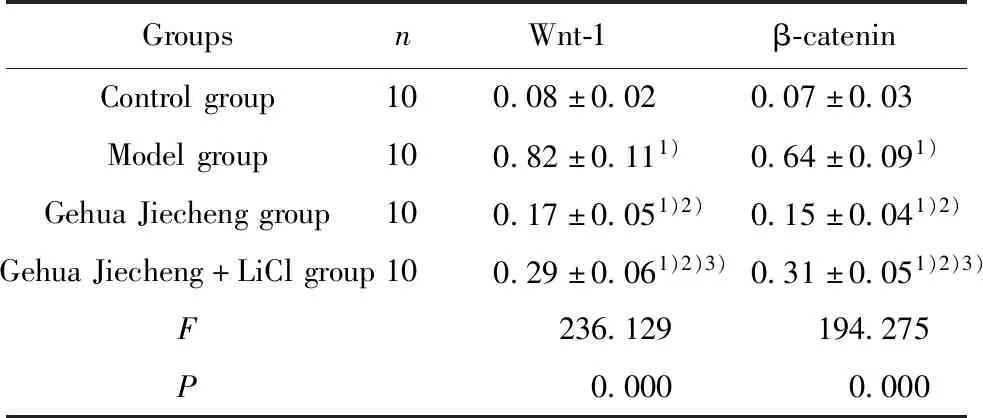
GroupsnWnt-1β-cateninControlgroup100.08±0.020.07±0.03Modelgroup100.82±0.111)0.64±0.091)GehuaJiechenggroup100.17±0.051)2)0.15±0.041)2)GehuaJiecheng+LiClgroup100.29±0.061)2)3)0.31±0.051)2)3)F236.129194.275P0.0000.000
Note:Compared with the Control group,1)P<0.05;compared with the Model group,2)P<0.05;compared with the Gehua Jiecheng group,3)P<0.05.

图4 各组小鼠肝脏组织中Wnt-1、β-catenin蛋白Western blot电泳图Fig.4 Western blot analysis of Wnt-1 and β-catenin proteins in liver tissues of mice in each groupNote:1.Control group;2.Model group;3.Gehua Jiecheng group;4.Gehua Jiecheng+LiCl group.
2.5各组小鼠肝脏组织中Wnt-1、β-catenin蛋白水平比较 与对照组比较,模型组小鼠肝脏组织中Wnt-1、β-catenin蛋白水平升高(P<0.05);与模型组比较,葛花解酲方组小鼠肝脏组织中Wnt-1、β-catenin蛋白水平降低(P<0.05);与葛花解酲方组比较,葛花解酲方+LiCl组小鼠肝脏组织中Wnt-1、β-catenin蛋白水平升高(P<0.05)。见表4和图4。
3 讨论
肝癌前病变的发生是一个复杂而缓慢的过程,癌前病变是癌症启动、促进和演变的中间阶段,仅有少量细胞在特定条件下发生癌变,因此癌前病变过程是可逆的,是癌症防治的重点。HBV感染可促进肝癌的发生发展,我国大部分肝癌由HBV感染进一步发展而来;我国酒精性肝损伤是继肝炎后的第二大肝损伤原因。慢性肝病经过癌前病变演变为肝癌是多步骤多阶段的过程,其中细胞失控性生长是恶性恶性肿瘤发生的生物学特征,细胞失控性生长的主要分子机制为细胞增殖过度以及细胞凋亡减少[10]。GST-Pi是谷胱甘肽S-转移酶家族成员之一,是细胞抗癌变的重要解毒系统[11],在多种恶性肿瘤中表达,在癌前状态中表达升高,是癌症启动细胞最早和最准确的标志酶,其表达数量和癌细胞的增殖多少关系密切[12,13]。PCNA和DNA合成关系密切,是DNA聚合酶辅助蛋白,在DNA复制的调节中发挥重要作用[14];在细胞增殖后期G1期PCNA表达升高,在G1/S期交界时其表达达高峰,和细胞增殖关系密切[15];在增殖活性旺盛的肿瘤细胞中表达升高,和恶性肿瘤的发生发展关系密切[16,17]。本研究通过建立乙醇性HBV转基因小鼠肝癌前病变模型,发现乙醇性HBV转基因肝癌前病变小鼠中,肝脏重量、肝脏指数升高,肝细胞变质和结节性增生明显,可见典型的假小叶,炎症细胞浸润明显,胆管上皮增生并具有异型性,表明肝癌前病变小鼠模型建立成功;小鼠肝脏组织中GST-Pi和PCNA表达量升高,GST-Pi和PCNA表达量与癌前病变细胞增殖关系密切,表明肝癌前病变小鼠肝脏细胞存在异常增殖。
中医无肝癌前病变之说,根据肝癌前病变的病因病机,考虑类似于“肋痛”、“黄疸”、“积聚”、“臌胀”等范畴。肝癌前病变由多种致病因素共同作用的结果,病因包括:①内因:阴阳气血亏虚、脏腑经络失调;②外因:伤食、六淫等邪毒郁积,从而导致邪毒缩聚成块,形成癌瘤。葛花解酲方来自李东垣的《脾胃论》,具有减少肝细胞破坏、稳定肝细胞、调节细胞因子水平、减轻肝损伤;减轻肝细胞变性坏死等作用,是治疗酒精性肝病的良方。近来研究发现葛花解酲方对肝癌具有保护作用,如王镜辉等[18]研究发现葛花解酲方通过抑制端粒酶蛋白表达、抑制细胞增殖对小鼠肝癌原位移植瘤发挥防治作用;李军等[19]发现葛花解酲方可通过调节外周血中免疫炎症因子含量改善小鼠的免疫功能,从而抑制小鼠移植性肝癌的生长;郭斌等[20]发现葛花解酲方可通过调控细胞周期调控因子的表达逆转肝癌癌前病变的发生,发挥肝脏保护作用。本文对肝癌前病变小鼠给予葛花解酲方处理,发现经葛花解酲方处理小鼠肝脏重量、肝脏指数、GST-Pi IDO、PCNA IDO降低;肝细胞变质、结节性增生、炎症细胞浸润、胆管上皮增生及异型性较轻。表明葛花解酲方可逆转乙醇性HBV转基因小鼠肝癌前病变,其机制可能与葛花解酲方可降低GST-Pi和PCNA表达、抑制肝组织细胞增殖有关。
Wnt信号通路为一条多作用位点、多环节的开放通路,在细胞增殖、细胞分化和细胞凋亡中发挥重要作用,Wnt/β-catenin信号通路为典型的Wnt通路[21,22];β-catenin为多功能细胞浆蛋白,其在机体处于疾病状态下,因体内环境的改变,游离的β-catenin进入细胞核,调节相关基因的表达,参与细胞的增殖过程[23-25]。如RARα敲低通过抑制Wnt/β-catenin信号通路抑制其下游靶标PCNA、Ki67、MMP7和MMP9的表达抑制食道癌的增殖和转移[26];姜黄素通过抑制Wnt/β-catenin途径抑制其下游细胞周期蛋白D1和PCNA的表达[27]。上述研究表明通过抑制Wnt/β-catenin信号通路可抑制恶性肿瘤细胞的增殖,且PCNA为Wnt/β-catenin信号通路的下游基因,通过抑制Wnt/β-catenin信号通路可抑制其下游PCNA等细胞增殖相关因子,从而发挥抑制细胞增殖的作用。本文研究发现肝癌前病变小鼠肝组织中Wnt-1、β-catenin蛋白水平升高,给予葛花解酲方处理后肝组织Wnt-1、β-catenin蛋白水平降低,在给予葛花解酲方处理的同时给予Wnt/β-catenin信号通路激动剂干预,则小鼠肝脏重量、肝脏指数、GST-Pi IDO、PCNA IDO、Wnt-1和β-catenin蛋白升高,可见Wnt/β-catenin信号通路激动剂对葛花解酲方对肝癌前病变的逆转有阻止作用,表明葛花解酲方可能通过Wnt/β-catenin信号通路抑制肝癌前病变的进展。
综上所述,葛花解酲方可能通过抑制Wnt/β-catenin信号通路降低肝组织GST-Pi和PCNA表达,从而抑制肝细胞增殖、逆转肝癌前病变过程。
