血清MASP2、MASP3在IgA肾病中的作用①
2020-02-20郑林花宋莎莎邢国兰郑州大学第一附属医院郑州450052
郑林花 张 颖 宋莎莎 邢国兰 (郑州大学第一附属医院,郑州 450052)
IgA肾病(IgAN)是我国最常见的原发性肾小球疾病[1],也是导致我国终末期肾衰的主要病因之一,IgAN的临床表现和组织学改变多样,预后不一[2,3],其中超过30%的患者在20年后会进展为终末期肾脏病[4],给社会带来了沉重的经济负担,因此阐明IgAN的发病机制,防止IgAN的进展尤为重要。
以往研究证实补体激活参与IgAN的发病及进展,且IgAN不仅有肾脏原位补体激活,而且存在循环补体活化[5]。补体由经典途径、旁路途径及甘露糖结合凝集素(MBL)途径三条途径激活,IgAN的补体激活主要通过旁路途径和MBL途径。很多资料显示补体活化的旁路途径参与了IgAN发病,但补体活化的MBL途径在IgAN发病中的作用及机制尚不清楚。MBL由四个结构域构成,分别为N末端区、O-糖基化胶原样区(CLR)、螺旋铰链区和C端识别区(CRD)。其中CRD为识别病原体的功能性结构,CRD识别后,CLR与MBL相关丝氨酸蛋白酶(MASP)结合形成MBL-MASPs,激活MBL途径[6]。在IgAN患者中,沉积在肾小球系膜细胞的MBL通过CRD与IgA1结构中的Fc段结合[7],其MBL中的CLR与MASP结合形成复合物,活化MASPs酶原,从而激活MBL途径。活化的MASP存在MASP1、MASP2、MASP3 三个亚型,MASP2是MBL途径的主要酶,它通过裂解C4、C2,形成C3转化酶,C3转化酶裂解C3为C3a和C3b,进一步形成C5转化酶,最终形成膜攻击复合物,导致细胞溶解死亡。MASP3是近年来新被发现的甘露糖结合丝氨酸蛋白酶家族成员,有研究显示它参与D因子的活化[8,9],而D因子是补体旁路途径过程中活化的关键酶。MASP3通过活化D因子,进而起到促进旁路途径活化的作用,进一步损伤肾脏。有研究发现IgAN中30%多的患者在肾小球系膜区有MBL的沉积,且具有肾小球MBL沉积的患者具有更严重的蛋白尿和肾功能损害,并且血清白蛋白水平降低和肾活检时高血压的可能性更大,根据牛津分类,他们的组织学变化更严重[10,11]。这些研究都提示了MBL途径可能是IgAN的重要发病机制,而血清MASP2、MASP3在IgAN发病中的作用未见报道,本研究旨在研究血清中的MASP2、MASP3与IgAN临床表现、病理改变的关系,进一步探讨MBL途径在IgAN发病中的作用,为IgAN的诊断、治疗提供可靠依据。
1 材料与方法
1.1材料
1.1.1一般资料 2016年9月至2017年3月在郑州大学第一附属医院肾脏内科住院行肾穿刺活检术,经病理确诊为IgAN的患者共143例,其中男性78例,女性65例,年龄(33.1±12.9)岁。排除标准:(1)肾活检光镜下肾小球数<8个。(2)病理伴有急性(亚急性)肾小管损伤、急性(亚急性)间质性肾炎、缺血性肾损伤及合并其他肾小球疾病等。(3)继发性IgAN:如过敏性紫癜等。(4)临床确诊感染性疾病、糖尿病、自身免疫病、肿瘤患者等。(5)既往应用激素及免疫抑制剂治疗患者。同时收集我院体检科健康体检者血清标本60例作为对照组,其中男性39例,女性21例;年龄(33.6±11.5)岁。各组间年龄、性别比例差异均无统计学差异(P>0.05)。本研究所有患者在研究前均签订知情同意书。
1.1.2临床资料采集及随访 包括年龄、性别、24 h 尿蛋白定量、血肌酐、有无肉眼血尿病史、肾穿刺病理报告。肉眼血尿定义为患者病例中记载存在肉眼可以直接发现的血样、浓茶样或洗肉水样真性血尿,且排除急性泌尿系感染、泌尿系肿瘤或泌尿系结石等引起的非肾小球源性血尿。采取门诊随访、住院随访及电话随访的方式,随访至2018年11月30日结束,随访时间中位数为23个月,终点事件定义为患者eGFR下降50%(排除急性肾功能损伤)或进入透析。
1.1.3实验试剂 ELISA试剂盒购于Hycult Biotech,Uden,the Netherlands。
1.2方法
1.2.1血清中MASP2、MASP3浓度检测 IgAN患者在肾活检当日采静脉血3 ml,健康对照组来源于我院体检科,均由无菌干燥管收集,离心取血清1 ml置于EP管-80℃冰箱分装保存待测。4℃冰箱解冻,用ELISA方法测定血清中MASP2、MASP3 浓度,操作步骤严格按试剂说明书进行。
1.2.2肾组织病理检查评分 所有病例均在局部麻醉下行超声引导下或CT引导下经皮肾穿刺活检术取肾组织,专用固定瓶保存送我院肾脏病理科进行染色制片及病理诊断,两名病理医师独立阅片且最终意见统一。(1)免疫荧光检查:免疫荧光法检测肾组织上IgA、C3沉积强度,荧光显微镜下半定量统计,按照IgA沉积强度不同分为2组:(+~2+)为弱阳性组,(3+~4+)为强阳性组;按照C3沉积强度不同分为3组:(-~±)为阴性组,(+~2+)为弱阳性组,(3+~4+)为强阳性组。(2)光镜检查:分别行HE、Masson、PAS、PASM染色,并按新版牛津分类评分(MEST-C)进行评分[12]。M0:系膜评分<0.5 ,M1:系膜评分>0.5;E0:无毛细血管内增生, E1:毛细血管内增生;S0:无节段性肾小球硬化,S1:节段性肾小球硬化;T0:肾小管萎缩/间质纤维化≤25%,T1:肾小管萎缩/间质纤维化26%-50%,T2:肾小管萎缩/间质纤维化> 50%;C0:无细胞/纤维细胞性新月体,C1:细胞/纤维细胞性新月体≥1个肾小球,C2:细胞/纤维细胞性新月体>25%。
2 结果
2.1病例组与对照组血清MASP2、MASP3水平比较 IgAN组与对照组血清MASP2水平无统计学差异(Z=-0.347,P=0.729),IgAN组血清MASP3水平高于对照组(Z=-3.8,P<0.001)。见表1。
2.2血清MASP2浓度与临床指标及牛津病理评分的关系 为了进一步研究血清MASP2在IgAN的作用,本研究以对照组血清MASP2浓度(P<0.05,非正态分布)的P5值(224.22 ng/ml)和P95值(2 540.50 ng/ml)为界,将病例组分为低浓度组(<224.22 ng/ml)、中等浓度组(224.22,2 540.50 ng/ml)以及高浓度组(>2 540.50 ng/ml)进行组内比较。研究发现与中等浓度组相比,低浓度组肉眼血尿发生率更高(χ2=9.892,P=0.002),而高浓度组的24小时尿蛋白量更多(Z=-2.64,P=0.008),见表2,新月体评分更高(χ2=5.165,P=0.023),见表3。其他临床指标(见表2)和牛津评分M,E,S,T,C(表3)在三组间差异无统计学意义。
2.3血清MASP3浓度与临床指标关系及牛津病理评分的关系 绘制散点图发现血清MASP3浓度与各临床指标无明显线性趋势。对照组MASP3浓度为非正态分布,且本研究发现病例组浓度较对照组高,所以以对照组P95值(2 512.83 ng/ml)为界,将病例组分为高浓度组(>2 512.83 ng/ml)和低中量浓度组(≤2 512.83 ng/ml)进行亚组分析,发现与低中量浓度组相比,高浓度组有更严重的蛋白尿(Z=-4.526,P<0.001),且系膜增生比例、毛细血管内增生比例、肾小管萎缩/间质纤维化比例、细胞/纤维细胞性新月体比例较高(χ2=8.955,P=0.003;χ2=4.484,P=0.034;χ2=9.853,P=0.002;χ2=9.516,P=0.002),其他临床指标以及牛津评分E在两组间没有统计学差异。见表4、5。
2.4血清MASP2、MASP3浓度与肾组织上IgA、C3荧光强度的关系 IgA荧光强度弱阳性组血清MASP2浓度高于强阳性组(Z=-2.546,P=0.011),而两组间血清MASP3浓度差异无统计学意义(P>0.05),见表6。其中有7例标本荧光组织无球,未行C3染色,其余136例患者中不同C3荧光强度血清MASP2、MASP3浓度间均无统计学差异(P>0.05),见表7。
表1 两组血清MASP2、MASP3水平比较
Tab.1 Comparison of serum MASP2 and MASP3 levels between two groups

GroupsnSerumMASP2(ng/ml)SerumMASP3(ng/ml)IgANgroup1431274.8(662.55,2312.75)885.5(251.26,2189.48)Controlgroup601299.7(726.98,1997.31)317.09(46.43,798.58)Z-0.347-3.8P0.7290.000
表2 血清MASP2不同浓度组间IgAN患者临床指标的比较
Tab.2 Comparison of clinical indicators of IgAN patients with different concentrations of serum MASP2

ClinicalindicatorsLowgroup(n=16)Moderategroup(n=99)Highgroup(n=28)P(a)P(b)Grosshematuria[n(%)]9(56.25)17(17.18)8(28.57)0.0020.18Proteinuria(g)1.3±0.71.7(0.8,3.3)2.4(1.8,4.9)0.0770.008Serumcreatinine(μmol/L)67(57,125)79(60,113)93(60,166)0.8080.426
Note:P(a)indicates the difference between the low concentration group and the moderate concentration group;P(b)indicates the difference between the high concentration group and the moderate concentration group.
表3 血清MASP2不同浓度组间IgAN患者牛津病理评分比较[n(%)]
Tab.3 Comparison of Oxford pathological scores in IgAN patients with different concentrations of serum MASP2[n(%)]

pathologicalscoresLowgroup(n=16)Moderategroup(n=99)Highgroup(n=28)χ2(a)χ2(b)P(a)P(b)MM012(75.0)62(62.6)20(71.4)0.9190.7390.3380.390M14(25.0)37(37.4)8(28.6)EE012(75.0)61(61.6)16(57.1)1.0640.1830.3020.669E14(25.0)38(38.4)12(42.9)SS09(56.3)60(60.6)12(42.9)S17(43.7)39(39.4)16(57.1)0.1092.8010.7410.094TT011(68.8)69(69.7)19(67.9)T1+T25(31.2)30(30.3)9(32.1)0.0000.0351.0000.852CC012(75.0)69(69.7)13(46.4)0.0195.1650.8920.023C1+C24(25.0)30(30.3)15(53.6)
Note:χ2(a),P(a)indicates the difference between the low concentration group and the moderate concentration group;χ2(b),P(b)indicates the difference between the high concentration group and the medium concentration group.
表4 血清MASP3不同浓度组间IgAN患者临床指标的比较
Tab.4 Comparison of clinical indicators of IgAN patients with different concentration of serum MASP3

ClinicalindicatorsHighgroup(n=27)Lowandmoderategroup(n=116)StatisticsPGrosshematuria[n(%)]9(33.34)25(21.55)χ2=1.6770.195Proteinuria(g)3.27(2.27,5.4)1.56(0.76,2.54)Z=-4.5260.000Serumcreatinine(μmol/L)86.0(73.0,103.0)74.5(58.3,118.0)Z=-1.1870.235
表5 血清MASP3不同浓度组间IgAN患者牛津病理评分比较[n(%)]
Tab.5 Comparison of Oxford pathological scores in IgAN patients with different concentrations of serum MASP3[n(%)]

PathologicalscoresHighgroup(n=27)Lowandmoderategroup(n=116)χ2PM M012(44.4)86(74.1)8.9550.003 M115(55.6)30(25.9)E E012(44.4)77(66.4)4.4840.034 E115(55.6)39(33.6)S S08(29.6)46(39.7)0.9370.333 S119(70.4)70(60.3)T T011(40.7)84(72.4)9.8530.002 T1+T216(59.3)32(27.6)C C06(22.2)64(55.2)9.5160.002 C1+C221(77.8)52(44.8)
表6 不同IgA荧光强度血清MASP2、MASP3浓度比较
Tab.6 Comparison of serum MASP2 and MASP3 concentrations between different IgA fluorescence intensity groups

IgAfluorescenceintensitygroupsnSerumMASP2(ng/ml)SerumMASP3(ng/ml)Weaklypositivegroup1011483.5(772.2,2421.5)1018.5(338.0,2336.0)Stronglypositivegroup42943.3(229.2,1900.7)700.1(215.9,1760.7)Z-2.546-1.427P0.0110.154
表7 不同C3荧光强度血清MASP2、MASP3浓度比较
Tab.7 Comparison of serum MASP2 and MASP3 concentrations in different C3 fluorescence intensity groups

C3fluorescenceintensitygroupsnSerumMASP2(ng/ml)SerumMASP3(ng/ml)Negativegroup301371.7(740.9,2400.2)484.6(124.0,2015.9)Weaklypositivegroup941197.8(656.2,2233.9)1119.7(338.0,2384.1)Stronglypositivegroup121135.3(863.8,2287.8)978.2(316.6,1497.1)χ20.5022.920P0.7780.232

图1 IgAN患者不同MASP2浓度组Kaplan-Meier生存曲线图Fig.1 Kaplan-Meier survival curve of different MASP2 concentration groups in IgAN patients
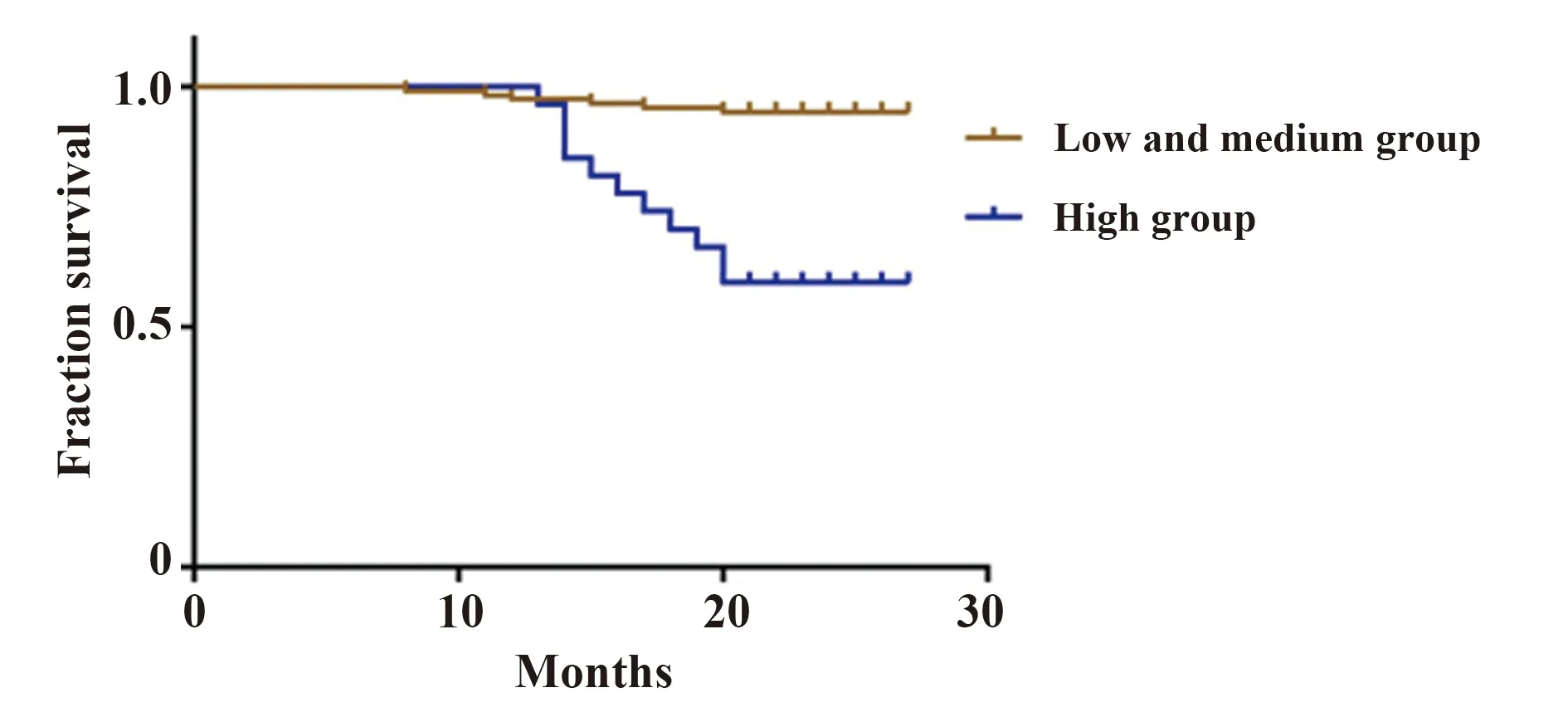
图2 IgAN患者不同MASP3浓度组Kaplan-Meier生存曲线图Fig.2 Kaplan-Meier survival curve of different MASP3 concentration groups in IgAN patients
2.5预后分析 随访过程中共失访26例。Kaplan-Meier生存曲线分析显示,血清低浓度MASP2(<224.22 ng/ml)和高浓度MASP2(>2 540.50 ng/ml)组患者肾脏生存率明显低于中等浓度MASP2(224.22,2 540.50 ng/ml)组(P<0.05),见图1。血清高浓度MASP3(>2 512.83 ng/ml)患者肾脏生存率明显低于低中量浓度组(P<0.05),见图2。
3 讨论
IgAN是导致我国终末期肾脏病常见的原发性肾小球肾炎,发病机制目前尚不完全明确,既往很多研究证实旁路途径参与IgAN的进展[13,14]。但近年来越来越多的研究发现甘露糖结合凝集素途径也参与IgAN的进展[15,16],北京大学第一医院的朱厉等发现在IgAN患者人群中,MBL缺乏的个体前驱感染和肉眼血尿发生率显著增高,且长期预后更差[17]。除此之外,他们还发现MBL水平与IgAN预后并非线性关联,而呈类似于U型的曲线关系,除MBL缺乏患者预后差外,高MBL水平的患者预后也较差,推测可能由于病情较重的IgAN患者体内存在炎症活化状态,诱导急性时相蛋白MBL高表达,疾病进展更迅速。这提示MBL途径可能在IgAN中具有多重作用机制。
MBL是在病原微生物感染早期,肝脏分泌的一种急性炎症蛋白。MASP2作为MBL途径活化的主要酶,它是否同MBL一样在IgAN的发展中发挥双重作用,在本研究中我们发现血清低浓度MASP2的IgAN患者肉眼血尿发生率更高,而血清高浓度MASP2的IgAN患者有更严重的蛋白尿和更高的新月体评分,并且预后分析发现低浓度以及高浓度MASP2组有更低的肾脏生存率,这与朱厉等的发现有相似之处。过高或过低的MASP2水平都不利于免疫系统的正常运行:一方面,MASP2缺乏常伴随慢性感染和炎症以及免疫力低下;另一方面,MASP2水平过高易发生炎症疾病。MASP2对不同疾病及同一疾病不同阶段影响不尽相同,与疾病发生发展互为因果,互相影响[18]。发作性肉眼血尿是IgAN中典型的临床表现,常发生在上呼吸道感染后数小时或1~2日后出现。文献报道,MASP2 血清中蛋白含量高低的变化受到基因突变的影响,从而可以引发多种疾病[19]。由此我们推测在部分IgAN患者中可能存在由于遗传因素引起的MASP2缺乏,导致患者免疫力低下,反复感染,故而反复发生肉眼血尿,引起肾脏病反复活动,进而导致肾脏不良预后。通过测定患者中MASP2的基因型可能能进一步被证实,由于条件所限,我们暂未测定患者的基因型。南方医科大学的陈政良等研究发现上呼吸道感染组MASP2水平显著高于对照组, 且血清MASP2浓度与血CRP值呈正相关,推测MASP2蛋白可能也是一种急性期蛋白[20]。多项研究显示IgAN患者有肾脏炎症反应参与,因此活动性肾小球肾炎可能是这些患者MASP2作为一种急性期蛋白过量产生的原因之一,其作为MBL途径活化的关键酶,过量的MASP2又促进了MBL途径的过度活化,从而引发了严重的蛋白尿,进一步导致了肾脏不良预后。然而IgAN激活的MBL途径是否直接影响血清中MASP2浓度尚不清楚,具体机制尚需更多的研究证实。我们在本研究中也发现了高浓度MASP2的IgAN有较高的新月体比例,至于过量的MASP2如何引起肾脏的病理损害既往未见相关报道,其机制尚需进一步研究。
IgAN免疫病理显示IgA为主的免疫复合物在肾小球系膜区沉积,并常伴有C3沉积。已有研究发现在IgAN患者中,沉积在肾小球系膜细胞的MBL通过CRD与IgA1结构中的Fc段结合,再与MASP结合形成MBL-MASPs,激活MBL途径[7]。在本研究中我们发现IgA荧光强度强阳性组血清MASP2浓度低于弱阳性组,推测可能是MASP2与IgA共沉积消耗所造成,这可能为MASP2在IgAN作用机制的研究中提供一条新的思路,其具体机制需要更深入的研究。近年来研究显示MASP3参与D因子的活化[8,9],且为生理状态下血液中D因子活化的关键酶[21],而D因子作为补体旁路途径的关键酶,可以裂解B因子,形成旁路途径中的C3转化酶,裂解C3为C3a和C3b,C3bBb再反过来促进C3分解,由此形成正反馈,最终造成对肾脏的损伤。因此我们可以推断,IgAN患者血清中高浓度的MASP3通过活化D因子,促进补体旁路途径的过度激活,进而损伤肾脏。然而IgAN激活的旁路途径是否直接影响MASP3水平尚不清楚,具体机制尚需更多的研究证实。本研究中发现血清高浓度MASP3的IgAN患者有更严重的蛋白尿和更低的肾脏生存率,且患者系膜增生比例、毛细血管内增生比例、肾小管萎缩/间质纤维化比例、细胞/纤维细胞性新月体比例较高均提示血清MASP3浓度有可能作为一种新型的生物标志物预测IgAN的严重程度,而这需要大样本资料以及长期随访来证实。本研究是单中心研究,且样本量较少可能使研究结果有一定的局限性,未来可以通过多中心、扩大样本量进一步研究MASP2、MASP3在IgAN发病中的作用,为IgAN的诊断、治疗提供更可靠的依据。
总之,本研究通过对MASP2、MASP3在IgAN中作用的研究,为未来IgAN的靶向治疗与无创性诊断开辟了新的思路。目前已有研究人员通过动物实验探索以MASP3为靶点在治疗旁路途径异常相关疾病中的作用[22],这也将为此类疾病提供新的治疗途径。IgAN患者预后差异较大,30%可在确诊后20年内发展为终末期肾脏病,或由持续性无症状血尿迅速进展为终末期肾脏病[23]。肾活检组织病理为IgAN诊断的金标准,但其为有创检查,不宜反复进行。目前IgAN预后评估的方法主要包括临床指标(基线蛋白尿、肾小球滤过率等)、病理分型(牛津病理评分)以及生物标志物(尿液IL-6等)[24],未来MASP2、MASP3可能作为新型的生物标志物,为IgAN的诊断、治疗以及预后提供可靠依据。