羟氯喹抑制系统性红斑狼疮Th17细胞的分化研究
2020-02-20李凤菊郭学军濮阳市油田总医院风湿免疫科濮阳457001
李凤菊 郭学军 (濮阳市油田总医院风湿免疫科,濮阳 457001)
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种累及多脏器、多系统损害的,严重影响人类正常生活的,呈多种免疫异常的复杂自身免疫性疾病,临床主要特征为全身多器官组织如肾脏、皮肤、血管及中枢神经系统等部位的免疫复合物沉积和炎症/坏死反应[1-4]。其发病机制是遗传因素与环境因素等共同作用导致的患者免疫平衡紊乱。多项研究表明,异常B细胞失调产生大量自身抗体,T细胞的表达和功能异常以及异常T细胞分泌的细胞因子参与系统性红斑狼疮的发病。
Th17细胞是一种以白细胞介素IL-17的分泌为特征的效应性CD4+T细胞亚群,它具有与传统的T细胞亚群Th1和Th2细胞不同的功能特征[5]。近年研究发现,Th17细胞可能参与了系统性红斑狼疮等自身免疫性疾病的免疫功能异常,但在SLE中作用的具体机制仍不完全明了。研究表明,SLE患者外周血中Th17细胞增加,且Th17细胞可能参与SLE患者的肾炎、血管炎、中枢神经系统感染以及自身抗体的产生[6]。目前,Th17细胞及其相关细胞因子的研究表明,其对SLE的靶向治疗有很大的应用前景[7]。
羟氯喹(hydroxychloroquine,HCQ)是一种常用的治疗或预防疟疾的药物,同时,它也是一种抗风湿性药物,可以减轻风湿性关节炎、盘状红斑狼疮或SLE症状[8,9]。因此,羟氯喹在临床得到了广泛的应用,已成为治疗SLE的必备药物。研究表明,羟氯喹可以抑制IL-6、IL-1β和肿瘤坏死因子(tumor necrosis factor,TNF)-α等促炎细胞因子的生产[10]。然而,目前羟氯喹对SLE患者以及体外分化的Th17细胞和Treg细胞的影响机制尚不明确。本文旨在研究羟氯喹对SLE患者Th17细胞分化的影响。
1 资料与方法
1.1资料 选取2017年9月至2018年9月30例SLE患者均符合1982年美国风湿病学会(ARA)修订的SLE诊断标准。其中男性5人,女性25人,年龄16~50岁(平均年龄35.4岁),病程1~70个月(平均病程18.1个月)。征得他们的同意后,我们采取两组治疗方案。一组治疗方案用药为强的松,另一组治疗方案用药为强的松+羟氯喹。在治疗前后,分别采用ELISA试剂盒检测IL-17的浓度,通过流式细胞仪检测SLE患者的Th17水平。同时在治疗后对他们进行动态随访。
另外选择了20例年龄、性别构成与上述病例相匹配的健康志愿者作为健康对照组。患者和健康志愿者基本信息见表1。
1.2方法
1.2.1体外分离、培养T细胞以及刺激分化Th17细胞 体外实验,我们从健康志愿者血液体外培养分化出Th17细胞。从健康志愿者中静脉采血2 ml,肝素抗凝,淋巴细胞分离液分离外周血单核细胞(PBMC),用10%的胎牛血清1640培养液调整细胞浓度为2×106ml-1,从外周血单核细胞中纯化出T细胞,具体如下:PBS清洗后加入混合抗体(抗-CD14、CD56、CD19、CD8、CD235a),4℃孵育10 min,加入包被有人抗鼠IgG Ab的Depletion Dynabeads,除去PBMC中非CD4+T细胞,在上清中加入抗CD25 Dynabeads 4℃孵育25 min,将CD4细胞分选成CD25+Tregs细胞和CD25-Treps细胞,流式细胞仪鉴定分离细胞纯度。将细胞悬液加入24孔细胞培养板,每孔1 ml,分别加入包含CD3/CD28抗体-磁珠(5 μl/ml)、IL-1β(50 ng/ml)、转化生长因子(TGF)-β(1 ng/ml)、IL-6 (30 ng/ml)、IL-23(5 ng/ml)、IL-4抗体(5 ng/ml)、IL-12抗体(5 ng/ml)、IL-2抗体(20 U/ml)的RPMI1640培养液,于37℃、5%CO2细胞培养箱中培养6 d,刺激分化出Th17细胞。其中,所有细胞因子和抗体均来自Peprotech。
表1 患者和志愿者基本信息表[n(%)]
Tab.1 Information of patients and volunteers[n(%)]

InformationPatientswithSLE(n=30)Control(n=20)Averageage(year)35.432.8Agerange16-20yearsold2(6.7%)1(5%)21-30yearsold7(23.3%)4(20%)31-40yearsold13(43.3%)10(50%)41-50yearsold6(20%)4(20%)51-60yearsold2(6.7%)1(5%)GenderMale5(16.7%)3(15%)Female25(83.3%)17(85%)Pathogenesis1-6months5(16.7%)None7-12months6(20%)None13-24months12(40%)None25-36months4(13.3%)None≥37months3(10%)None
培养液分为两组,一组作为正常对照组,另一组加入20 μmol/L的HCQ[11],用于分析羟氯喹对Th17细胞分化的影响。
1.2.2流式细胞分析法检测PBMC中Th17细胞的表达 我们分离出SLE患者的外周血单核细胞,在含50 ng/ml佛波酯(PMA)、750 ng/ml离子霉素的培养液中,于37℃、5%CO2细胞培养箱中培养1 h后加入20 μg/ml莫能霉素混匀后继续培养5 h。用PE-Cy5/CD3抗体和FITC/CD8抗体染色15 min,再用PE/IL-17抗体进行胞内染色。最后,以CD3+CD8-设门,用流式细胞仪分析Th17细胞。
在体外实验中,我们从原始T细胞刺激分化出Th17后,用含/不含羟氯喹的培养液培养6 d,然后用FITC/CD4抗体和PE/IL-17抗体进行染色,用流式细胞仪从CD4+T细胞中筛选出IL-17+细胞。此外,我们用荧光素CFSE标记原始T细胞,然后在有/没有羟氯喹的Th17细胞培养条件下培养6 d,通过流式细胞术分析检测CFSE+细胞的比例。
1.2.3ELISA检测IL-17的浓度 ELISA试剂盒购自eBioscience公司。收集SLE患者及健康对照组的血清,用ELISA试剂盒检测IL-17浓度。此外,分离出的T细胞在有/没有羟氯喹的Th17细胞培养条件下培养6 d后,用ELISA检测上清中IL-17的浓度。
1.2.4PCR基因表达分析 使用Trizol试剂(购自Invitrogen)从SLE患者和健康对照组的PBMC中纯化总RNA,采用PrimeScript RT Master Mix (Perfect Real Time)试剂盒合成cDNA,加入SYBR Premix EX Taq RT-PCR Master Mix (TaKaRa)后,用Bio-Rad iCycler 7500光学系统测定mRNA表达。以β-actin为内参采用2-ΔΔCt法计算变异倍数。使用的引物对如下:Hum β-actin(F:ATC ATG TTT GAG ACC TTC AAC A;R:CAT CTC TTG CTC GAA GTC CA);Hum IL-17A(F:AAA GTG GCC CGG ATG TGA GA;R:GAC ATT GTG CCC TGC CCT TCT);ROR-γt(F:TGA GAA GGA CAG GGA GCC AA;R:CCA CAG ATT TTG CAA GGG ATC A);FOXP3(F:GAA ACA GCA CAT TCC CAG AGT TC;R:ATG GCC CAG CGG ATG AG),引物均购自瑞博。
2 结果
2.1HCQ抑制SLE患者Th17细胞分化和IL-17产生 ELISA结果显示,HCQ与强的松联合治疗与单纯强的松治疗相比,前者抑制了IL-17的产生(图1A)。同样,RT-PCR结果显示,联合治疗后的SLE患者PBMC中IL-17 mRNA表达也比单纯强的松治疗的结果有所降低(图1B)。此外,我们还对FOXP3的表达进行了评估,因为它是Treg细胞分化过程中的关键转录因子[12]。我们发现HCQ和强的松联合治疗与单纯强的松治疗相比,并不能有效提高FOXP3基因的表达(图1C)。
26例SLE患者在HCQ治疗后的动态随访中,流式细胞术分析显示,HCQ +强的松治疗4周后,Th17细胞百分比受到了抑制(图2A),但是,HCQ+强的松治疗后Treg细胞的百分比却增加(图2B)。ELISA检测结果显示,HCQ+强的松联合治疗4周后,SLE患者血清中IL-17的产生降低(图2C),FOXP3 mRNA基因表达增加(图2D)。这些数据表明,HCQ联合治疗可以抑制SLE患者Th17细胞的扩增和IL-17的产生。
2.2HCQ抑制体外Th17细胞分化和IL-17的产生 从健康志愿者的外周血单核细胞中分离纯化出人T细胞,在有/没有HCQ的Th17细胞培养基中培养。流式细胞术分析表明,HCQ抑制了CD4+IL-17+Th17细胞的分化(图3A)。此外,我们发现HCQ可以抑制IL-17的产生和基因表达(图3B和3C)。同时,RORγt是Th17细胞分化的关键转录因子,结果表明HCQ也抑制了RORγt的产生(图3D)。此外,HCQ阻止CD4+IL-17+Th17细胞扩张的能力随时间变化(图3E)。同时,HCQ还可以抑制CFSE标记的Th17细胞的增殖(图4A、B)。这些数据均表明,HCQ可以抑制体外Th17细胞的分化和IL-17的产生。

图3 流式细胞术检测CD4+IL-17+Th17细胞百分比(n=3)Fig.3 HCQ inhibits Th17 cell differentiation and IL-17 production in vitro(n=3)Note: A.The percentage of CD4+IL-17+Th17 cells was analyzed by flow cytometry (n=3);B.The concentration of IL-17 in supernatants was analyzed by ELISA (n=3);C.Expression of IL-17 mRNA was analyzed by RT-PCR (n=3);D.Naive CD4+T cells were cultured for 12 days in conditions designed to induce Th17 differentiation,with or without 20 μmol/L HCQ;the gene expression of retinoic acid receptor related orphan receptor gamma t (RORγt) was analyzed by RT-PCR;E.The number of CD4+IL-17+cells could be induced in a time-dependent manner,and 20 μmol/L HCQ could time-dependently inhibit CD4+IL-17+cell proliferation (n=3).
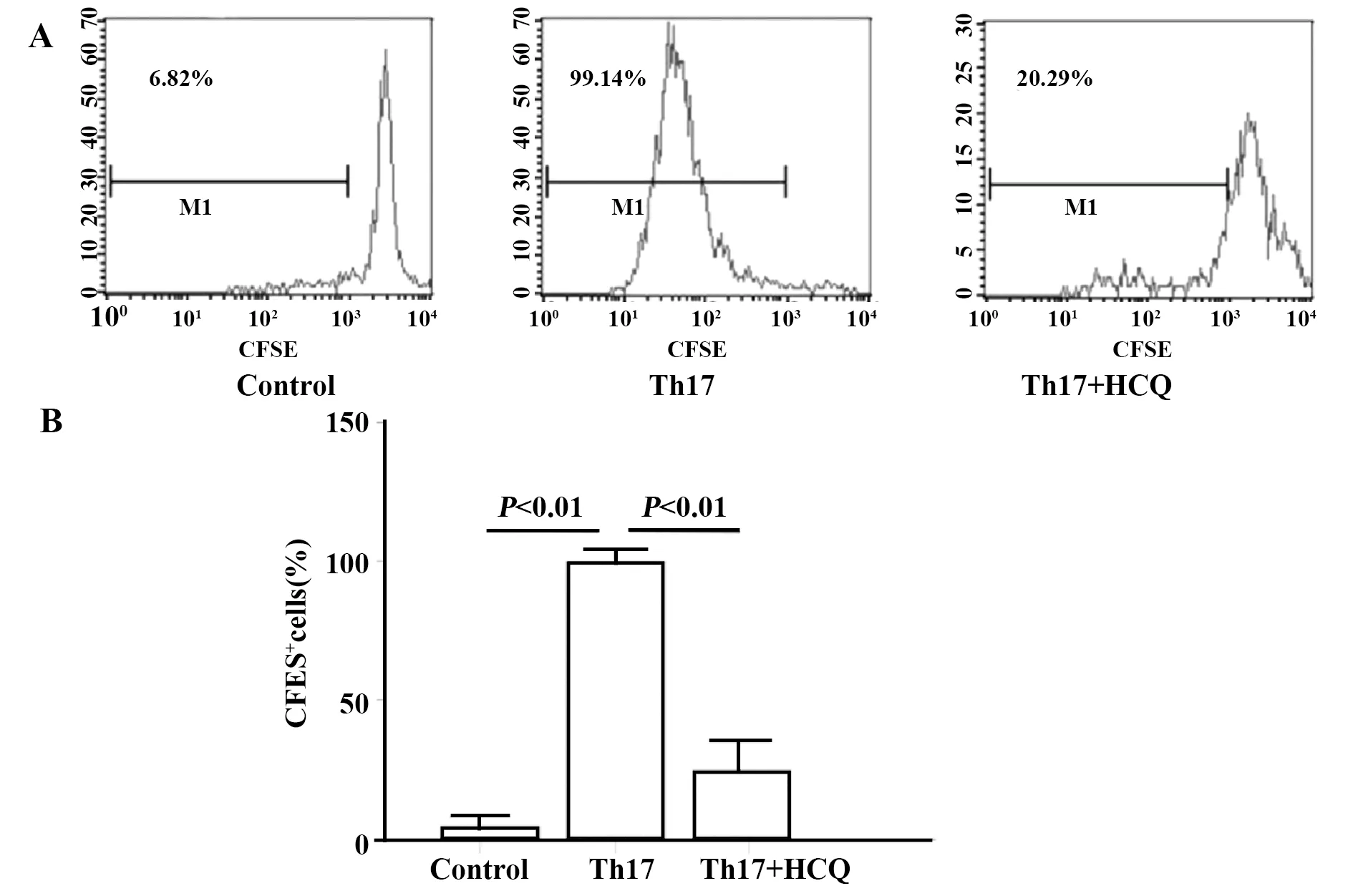
图4 CFSE+Th17细胞的含量Fig.4 Content of CFSE+Th17 cellsNote: A.Sorted naive CD4+T cells were labeled with CFSE and cultured for 6 days in conditions designed to induce Th17 cell differentiation,with or without 20 μmol/L HCQ.CFSE+Th17 cells were analyzed by flow cytometry;B.The percentage of CFSE+among CD4+cells.
3 讨论
Th17细胞是Th细胞的促炎亚群,在自身免疫疾病的发病机制中起着关键作用[13]。Th17细胞强有力的促炎活性可能导致SLE的许多病理特征,如诱导血管炎症、白细胞募集、B细胞激活和自身抗体的产生[14]。多项研究表明,在SLE患者外周血中Th17细胞和IL-17都增加了,且在这些患者的皮肤病变、肺和肾脏中也发现了Th17细胞的增长[15]。因此,我们推测抑制Th17细胞或对抗IL-17可能是治疗SLE的有效治疗方法。本实验我们发现,HCQ和强的松联合治疗与单独使用强的松治疗相比,前者抑制了SLE患者Th17细胞分化和IL-17的产生,同时我们发现在HCQ处理数周后Th17细胞和IL-17的产生也受到了抑制。此外,我们的体外研究进一步证实HCQ抑制了Th17细胞分化、细胞数量增殖和IL-17的产生。综上,HCQ可抑制Th17细胞,减轻后续炎症反应是SLE治疗的强效药。
Treg细胞可以调节效应T细胞的功能,从而维持免疫稳态[16]。众所周知,在SLE患者发病时,循环Treg细胞的数量会减少,并且Treg细胞的免疫抑制功能受损[17]。我们的研究表明,经过强的松和HCQ联合治疗后,体内Treg细胞百分比和FOXP3基因表达均上升,这表明HCQ有可能促进了Treg细胞的分化。但是,强的松和强的松加HCQ治疗的平行对照实验却没有发现FOXP3表达的显著差异,我们推测Treg细胞和FOXP3基因在体内表达上升可能是由于强的松的作用。