淫羊藿苷抑制β-catenin和NF-κB p65的活性对小鼠胰腺癌皮下移植瘤生长和运动的调节①
2020-02-20代云龙吴礼国章志军黄俊伟温江区人民医院肝胆外科温江611130
代云龙 吴礼国 章志军 欧 扬 黄俊伟 彭 兵 (温江区人民医院肝胆外科,温江 611130)
胰腺癌是消化道类肿瘤中恶性程度极高的一种,其解剖位置的特殊性导致大部分胰腺癌患者确诊时已为晚期,手术切除率低,对抗癌药物的敏感性也低,因此其预后极差,病死率在所有肿瘤中居第4位[1,2]。Wnt/β-catenin信号通路在胚胎发育过程中发挥着重要的作用,异常高表达会诱导肿瘤发生,目前研究表明,在胰腺癌肿瘤细胞中Wnt/β-catenin信号通路激活后,能够促进其增殖、侵袭、转移并抑制细胞凋亡[3,4]。核因子κB(nuclear factor kappa B,NF-κB)通常以同源或异源二聚体形式存在于细胞的胞质中,p65作为其活性部分,可通过调控细胞凋亡等基因表达水平来参与到肿瘤的发生、发展进程中[5]。淫羊藿苷是从传统中药淫羊藿中分离出来的黄酮类化合物,具有广泛的生物学效应,包括抗炎,抗抑郁,改善男性性功能,保护心血管,增强骨愈合和神经保护作用[6],此外,淫羊藿苷已被证明在各种人类癌细胞中发挥体外抗增殖作用,例如结肠癌、乳腺癌、胃癌等[7-9],但淫羊藿苷体内抗癌活性的相关研究较少。本研究旨在通过建立裸鼠移植瘤模型,并给予不同剂量淫羊藿苷及阿霉素腹腔注射,检测瘤体中癌细胞生长、运动及Wnt/β-catenin、NF-κB信号通路关键蛋白的表达情况,为胰腺癌的治疗提供新思路。
1 材料与方法
1.1材料
1.1.1实验动物来源 清洁级雌性BALB/c小鼠125只,4~5周龄,平均体重(16.37±1.07)g,购自北京阜康生物科技股份有限公司[生产许可证号:SCXK(京)2014-0009],所有BALB/c裸鼠均饲养在中国医学科学院医学实验动物研究所屏障环境动物房[SYXK(京)2015-0035]。
1.1.2主要试剂及仪器 人胰腺癌SW1990细胞株(上海细胞研究所,本实验室自行传代培养);淫羊藿苷(中国药品生物制品检定所,纯度99.9%);阿霉素(美国Sigma公司);胎牛血清(FBS)、RPMI-1640培养基(Gibco公司);Ki67、VEGF、Caspase-3、MMP-9引物(上海生工生物工程技术服务有限公司合成);总RNA提取试剂盒、反转录试剂盒及荧光定量PCR试剂盒(赛默飞世尔科技公司);全蛋白提取、BCA蛋白含量检测试剂盒(南京凯基生物有限公司);兔抗小鼠Ki67、VEGF、β-catenin、p65、p-p65、GAPDH多克隆抗体(美国Abcam公司);TDL-4台式离心机(上海安亭科学仪器厂);IX51倒置显微镜(日本OLYMPUS公司);Image Master VDS凝胶自动成像仪(瑞典Pharmacia公司)。
1.2方法
1.2.1细胞培养 人胰腺癌SW1990细胞株在含10%胎牛血清、100 U/ml青霉素或链霉素的RPMI1640培养液培养,在37℃、5%CO2培养箱中培养至对数期,用生理盐水进行漂洗后,0.25%胰蛋白酶消化液处理2 min后弃除胰蛋白酶,再加入完全培养基洗脱细胞,制成细胞悬液。
1.2.2移植瘤模型制备及处理 将1.2.1中制备好的细胞悬液浓度调整为1×108ml-1后注射于裸鼠右腋下,肿瘤直径大于5 mm时则成为移植瘤标准,将制备成功的裸鼠随机等分为对照组、低、中、高剂量淫羊藿苷组、阿霉素组,每组25只,其中对照组在肿瘤周围皮下注射盐水,低、中、高剂量淫羊藿苷组于腹腔注射10、20、40 mg/kg的淫羊藿苷溶液,1周连续注射5次,连续3周,阿霉素组于腹腔注射5 mg/kg 的阿霉素溶液,每周第1天和第4天注射,连续3周,注射后继续培养3 d后处死裸鼠,分离肿瘤并测定肿瘤质量及体积,并将一部分肿瘤组织置于4%甲醛溶液中固定,用于癌细胞凋亡观察以及免疫组化观察,另一部分肿瘤组织置于-80℃存储,用于qRT-PCR与Western blot检测。各组裸鼠试验期间均在培育室饲养,温度20~25℃,湿度保持在50%~55%,进行人工光照(12 h/昼、12 h/夜),裸鼠全天自由饮水与饮食。
1.2.3肿瘤大小、体积及小鼠存活率检测 将1.2.2中分离得到的肿瘤组织用游标卡尺测量其长径(a)和短径(b),并根据公式:肿瘤体积(V)=a×b2/2计算肿瘤体积;记录各组小鼠存活情况。
1.2.4TUNEL染色观测瘤组织癌细胞凋亡情况 取1.2.2中各组裸鼠移植瘤组织进行常规石蜡包埋,根据免疫组织化学试剂盒中说明书进行操作,并在显微镜下观察并采集图像。随机选取5个视野,记录200个细胞中阳性细胞数,细胞凋亡情况运用末端标记技术TUNEL法检测且采用TUNEL指数表示。细胞核呈现为棕黄色者视为凋亡细胞。
1.2.5免疫组化观察瘤组织中Ki67、VEGF蛋白阳性表达率 取1.2.2中各组裸鼠移植瘤组织进行常规石蜡包埋切片后,脱水、PBS溶液漂洗、3% H2O2与甲醇混合液浸泡10 min,超纯水漂洗、抗原修复、PBS漂洗5 min、加入一抗37℃反应2 h、PBS漂洗5 min、加入二抗37℃反应40 min、PBS漂洗5 min、DAB室温显色20~30 min,镜检观察有棕黄色颗粒出现时则采用自来水终止。再用苏木素复染30 s、自来水漂洗、中性树胶封片,光镜下观察细胞样本中Ki67、VEGF的阳性表达细胞,其细胞浆表现为棕黄色颗粒。每张片子400×视野10个,统计阳性细胞数目,以计算阳性细胞率,阳性细胞率(%)=阳性细胞数目/总细胞计数×100%。
1.2.6qRT-PCR检测瘤组织中Ki67、VEGF、Caspase-3、MMP-9相对表达水平 按照总RNA提取试剂盒说明书上操作步骤提取各组小鼠瘤组织中的总RNA,提取后用紫外分光光度计检验,OD值(A260/A280)=1.8~2.0,并用凝胶电泳检测RNA的完整性。按照反转录试剂盒说明书进行cDNA的合成。反转录体系(10 μl):2×miRNA反应混合液5 μl,0.1 % BSA 1 μl,miRNA PrimeScript-RT酶混合物 1 μl,总RNA 0.5 μl,去RNA酶ddH2O 2.5 μl。反应条件设置:37℃ 60 min,85℃ 5 s,4℃ 30 min。PCR体系10 μl:SYBR-Prmix Ex Tap II(2×)5 μl,上游引物0.4 μl,下游引物0.4 μl,ROX Reference DyeⅡ(50×)0.2 μl,cDNA 1 μl,ddH2O 3 μl。详细操作见试剂盒说明书。PCR反应参数设置:50℃激活聚合酶5 min,95℃预变性30 s,95℃变性5 s,60℃退火和延伸34 s,反应进行40个循环。溶解曲线绘制:95℃ 15 s,60℃ 60 s,85℃ 15 s,60℃ 15 s。每个样孔设置3个复孔。用2-ΔΔCt法计算mRNA的表达量。
1.2.7Western blot检测瘤组织中β-catenin、p65、p-p65表达水平 将1.2.2中提取的瘤组织用BCA法提取总蛋白后,利用Bradford调整各组蛋白浓度一致,经SDS-PAGE凝胶电泳、电转膜至甲醛预处理过的PVDF膜,密封2 h,加入兔抗鼠β-catenin、p65、p-p65、GAPDH(1∶1 000)一抗4℃孵育过夜,TBST漂洗40 min,加入HRP标记的二抗(1∶500)孵育1 h,TBST漂洗40 min,ECL发光液将PVD膜显色,暗室曝光到X线片上,采用Imaging System软件分析各组条带灰度值,以目标蛋白与内参积分吸光度值比值表示蛋白的相对表达水平。

2 结果
2.1淫羊藿苷对小鼠移植瘤重量、体积及存活率的影响 与对照组相比,中、高剂量淫羊藿苷及阿霉素干预后,瘤体重量及体积均显著降低见图1、表1,25 d 存活率显著升高见图2、表1,差异均有统计学意义(P<0.05)。
2.2淫羊藿苷对瘤体癌细胞凋亡的影响 TUNEL结果显示:与对照组相比,中、高剂量淫羊藿苷及阿霉素处理后癌细胞凋亡率显著升高(P<0.05)。见图3、表2。
2.3淫羊藿苷对瘤组织中Ki67、VEGF蛋白阳性表达率的影响 免疫组化结果显示:与对照组相比,中、高剂量淫羊藿苷及阿霉素处理后癌组织中Ki67、VEGF蛋白的阳性表达率显著降低(P<0.05)。见图4、表3。
2.4淫羊藿苷对瘤组织中Ki67、VEGF、Caspase-3、MMP-9相对表达水平的影响 qRT-PCR结果显示:与对照组相比,中、高剂量淫羊藿苷及阿霉素处理后癌组织中Ki67、VEGF、MMP-9相对表达水平显著降低(P<0.05),Caspase-3相对表达水平显著升高(P<0.05)。见表4。

图1 各组裸鼠瘤体情况比较
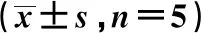
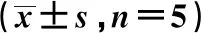
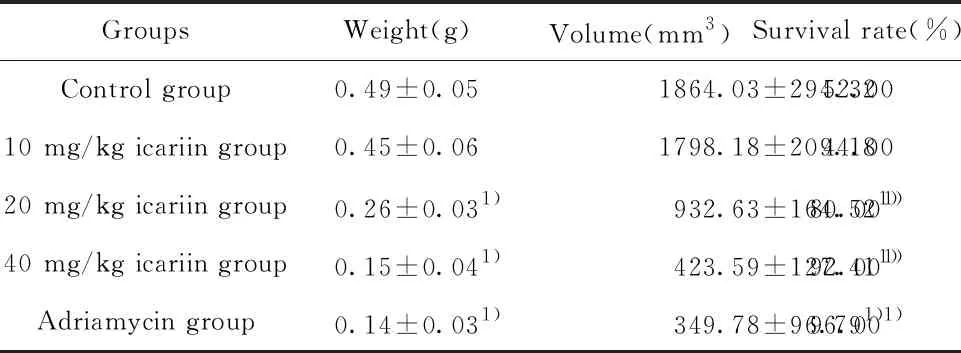
GroupsWeight(g)Volume(mm3)Survival rate(%)Control group0.49±0.051864.03±294.3252.0010 mg/kg icariin group0.45±0.061798.18±209.1844.0020 mg/kg icariin group0.26±0.031)932.63±164.521)80.001)40 mg/kg icariin group0.15±0.041)423.59±127.411)92.001)Adriamycin group0.14±0.031)349.78±96.791)96.001)
Note:Compared with control group,1)P<0.05.
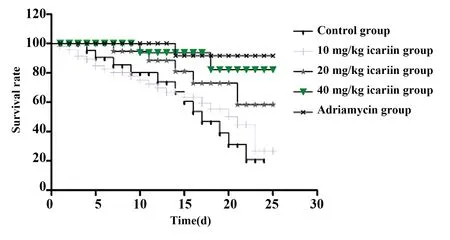
图2 各组裸鼠25 d存活率比较

GroupsApoptotic rate(%)Control group5.12±1.5310 mg/kg icariin group5.24±1.2720 mg/kg icariin group28.35±4.811)40 mg/kg icariin group46.57±6.211)Adriamycin group48.25±7.421)
Note:Compared with control group,1)P<0.05.
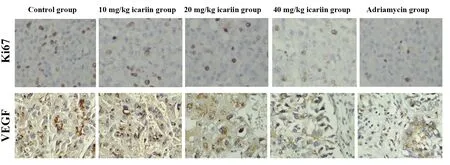
图4 各组裸鼠瘤组织的免疫组化结果(×400)
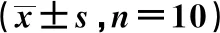
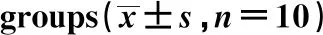

GroupsKi67 positiveexpression rate(%)VEGF positiveexpression rate(%)Control group30.48±8.5361.25±18.5310 mg/kg icariin group25.24±1.2758.21±16.2720 mg/kg icariin group8.55±2.621)37.65±12.511)40 mg/kg icariin group3.52±1.171)22.34±10.171)Adriamycin group2.12±0.481)20.08±8.251)
Note:Compared with control group,1)P<0.05.
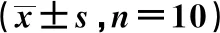
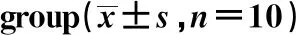
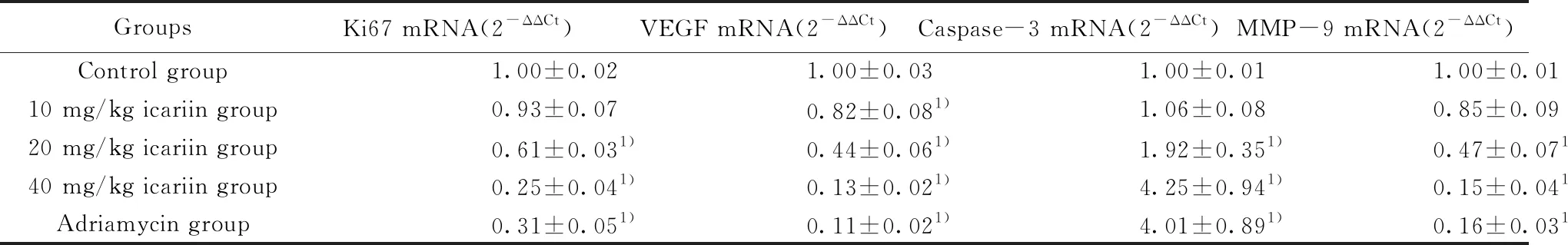
GroupsKi67 mRNA(2-ΔΔCt)VEGF mRNA(2-ΔΔCt)Caspase-3 mRNA(2-ΔΔCt)MMP-9 mRNA(2-ΔΔCt)Control group1.00±0.021.00±0.031.00±0.011.00±0.0110 mg/kg icariin group0.93±0.070.82±0.081)1.06±0.080.85±0.0920 mg/kg icariin group0.61±0.031)0.44±0.061)1.92±0.351)0.47±0.071)40 mg/kg icariin group0.25±0.041)0.13±0.021)4.25±0.941)0.15±0.041)Adriamycin group0.31±0.051)0.11±0.021)4.01±0.891)0.16±0.031)
Note:Compared with control group,1)P<0.05.
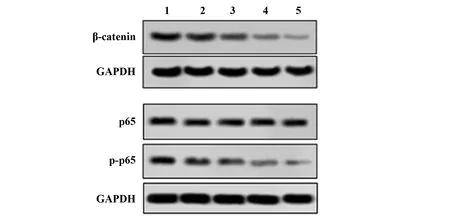
图5 各组裸鼠瘤组织中β-catenin、p65、p-p65蛋白表达图谱
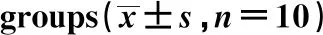
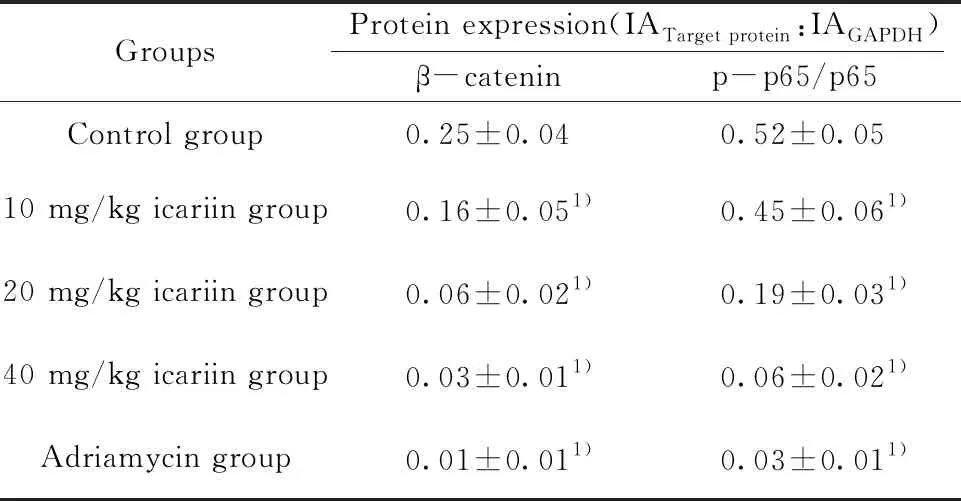
GroupsProtein expression(IATarget protein:IAGAPDH)β-cateninp-p65/p65Control group0.25±0.040.52±0.0510 mg/kg icariin group0.16±0.051)0.45±0.061)20 mg/kg icariin group0.06±0.021)0.19±0.031)40 mg/kg icariin group0.03±0.011)0.06±0.021)Adriamycin group0.01±0.011)0.03±0.011)
Note:Compared with control group,1)P<0.05.
2.5淫羊藿苷对瘤组织中β-catenin、p65、p-p65表达水平的影响 Western blot结果显示:与对照组相比,不同剂量淫羊藿苷及阿霉素处理后癌组织中β-catenin蛋白表达水平及p65蛋白磷酸化水平均显著降低(P<0.05)。见图5、表5。
3 讨论
淫羊藿又称为“仙灵脾”,最早记载于《神农本草经》,具有补肝肾、强筋骨、祛风湿的功效,目前从淫羊藿中分离出的单体化合物的种类已超过260种,大部分为黄酮类化合物,其中淫羊藿苷含量最高[10]。现代药理研究结果表明,淫羊藿苷具有促神经突触生长、抗神经元损伤、促进骨代谢、抗炎、抗氧化应激、抗肿瘤等多种活性[11]。体外抗肿瘤活性实验发现,淫羊藿苷可以通过降低内质网应激相关分子表达,促进凋亡相关蛋白表达来降低人食管癌细胞增殖黏附能力[12];在卵巢癌中可以通过下调促癌基因RNA-21表达,促进抗癌基因PTEN、RECK蛋白表达抑制细胞增殖,加速细胞死亡[13]。本次研究通过注射人胰腺癌SW1990细胞株建立裸鼠移植瘤模型,并通过腹腔注射不同剂量淫羊藿苷来观察其体内抗肿瘤活性,结果显示,20 mg/kg和40 mg/kg剂量的淫羊藿苷处理后,移植瘤的重量及体积显著降低,且小鼠存活率显著升高,但10 mg/kg剂量的淫羊藿苷处理后,瘤体质量、体积及存活率与对照组相比没有明显差异,表明在体内淫羊藿苷同样具有抗肿瘤活性,且抗肿瘤活性具有浓度依赖性。同时本研究还利用TUNEL染色观察了瘤组织中癌细胞凋亡情况,结果显示20 mg/kg和40 mg/kg剂量的淫羊藿苷处理后,瘤组织中癌细胞凋亡率显著升高,表明淫羊藿苷可能是通过促进癌细胞凋亡来抑制肿瘤生长的,Wang等[14]研究发现在黑色素瘤小鼠模型中,淫羊藿苷主要通过调控细胞周期蛋白及凋亡相关蛋白来发挥抗肿瘤作用,与本研究结果相似。
Ki67作为一种存在于增殖细胞核中的非组蛋白性核蛋白,与细胞周期高度相关,并且其在胰腺癌组织中的表达程度显著高于正常胰腺组织[15];VEGF则能够增加血管的通透性,有利于肿瘤细胞浸入血管进而向淋巴及远处细胞侵袭转移[16],并且VEGF还可以诱导MMP的产生,而MMP又能够促进癌细胞对周围组织的浸润[17]。本研究利用免疫组化检测了瘤组织中Ki67和VEGF蛋白的阳性表达率,结果显示20 mg/kg和40 mg/kg剂量的淫羊藿苷处理后,瘤组织中Ki67和VEGF蛋白的阳性表达率均显著降低,表明淫羊藿苷抗肿瘤活性除了通过促进细胞凋亡实现外,还与抑制细胞增殖及其侵袭转移能力有关。利用qRT-PCR对瘤组织中细胞生长和运动基因进行分析发现,凋亡执行蛋白基因Caspase-3[18]相对表达量显著升高,上皮间质转化关键蛋白基因MMP-9的相对表达量降低,进一步证实了淫羊藿苷能够抑制肿瘤细胞生长及运动[19]。
Wnt/β-catenin作为生物体内的一条高度保守的信号通路,在胚胎发育及维持细胞内稳态等生理活动中发挥着重要的作用。经典的Wnt/β-catenin通路,主要通过β-catenin来传递信号,从而启动下游靶基因表达,β-catenin在肿瘤发展进程中发挥着两重功效,既可以通过与细胞膜上的E-cadherin结合,调控肿瘤细胞的侵袭转移,又可以作为Wnt/β-catenin的重要信号传递子,其浓度决定着Wnt/β-catenin通路是激活还是抑制[20,21]。NF-κB信号通路主要负责连接氧化应激和细胞凋亡过程,当机体出现氧化应激反应的时候,NF-κB会被激活进入细胞核中,通过与细胞凋亡基因c-myc等下游作用元件结合,促进细胞凋亡相关基因表达从而诱导细胞凋亡[22]。本研究结果发现,不同剂量淫羊藿苷处理后β-catenin蛋白表达以及NF-κB p65蛋白的磷酸化水平均显著降低,表明淫羊藿苷可能通过抑制Wnt/β-catenin和NF-κB信号通路活性,来调控肿瘤生长运动。
综上所述,淫羊藿苷可能通过抑制β-catenin和NF-κB p65的活性下调增殖及运动相关基因表达,上调凋亡相关基因表达从而调节小鼠胰腺癌皮下移植瘤的生长和运动。淫羊藿苷作为天然抗肿瘤药物,具有很好的临床使用价值,但胰腺癌的发生发展还受其他信号通路调控,还需要继续深入研究。