汉黄芩素对LPS-ATP诱导的巨噬细胞氧化应激的抑制作用①
2020-02-20周思瑶游雷鸣张海丽赵梦繁苏日娜
周思瑶 游雷鸣 张海丽 赵梦繁 苏日娜 刘 慧 郝 钰
(北京中医药大学生命科学学院免疫与微生物学系,北京 100029)
汉黄芩素是从中药黄芩、半枝莲等植物中分离得到的一种重要的黄酮类化合物。现代药理研究发现,汉黄芩素具有明显抗炎作用[1]。且相关研究表明,汉黄芩素可通过抑制NF-κB和MAPK信号通路抑制LPS诱导的大鼠背根神经节神经元炎症反应[2]。汉黄芩素能通过抗炎及抗氧化作用来减轻糖尿病性心肌病[3]。且汉黄芩素还可通过抑制氧化应激诱导的MAPK和NF-κB途径来减轻大鼠体内镉诱导的肾毒性[4]。还有文献表明,汉黄芩素可通过激活Nrf2/HO-1-SOD2-NQO-1-GCLC信号转导轴来抑制IL-1β刺激引起的MAPK信号通路活化,从而抑制炎症反应[5]。我们从大量参考文献中得出,汉黄芩素具有明显的抗氧化应激及抗炎作用。
我们课题组已有前期研究证明,汉黄芩素能抑制 LPS-ATP 联合刺激巨噬细胞炎症反应的发生,与 LPS 和 ATP 联合刺激组相比,汉黄芩素干预组能明显降低胞内 IL-1β、IL-18、IL-6、TNF-α、NLRP3和 Caspase-1 的 mRNA 水平,减少NF-κB核转位,并能下调胞外TNF-α和胞内ROS水平[6]。ROS是氧化应激的重要产物,大量的ROS又可以激活巨噬细胞的核转录因子 NF-κB使其发生核转位,诱导炎症反应[7]。由此,我们认为汉黄芩素可能是通过降低胞内的ROS水平,减少NF-κB核转位,抑制NF-κB介导的炎症基因转录继而减轻巨噬细胞的炎症反应。那么,是什么机制使胞内ROS水平降低的?是汉黄芩素直接减少ROS产生和释放还是通过激活抗氧化信号通路降解过多的ROS?Nrf2信号通路是细胞内氧化应激最重要的防御系统之一,当细胞发生氧化应激,Nrf2 信号通路首先被激活,进而引发抗氧化物及相关酶类的大量表达,以抵御氧化应激引发的细胞损伤,减少ROS产生[8]。为此,本研究以脂多糖和三磷酸腺苷联合刺激小鼠巨噬细胞为炎症模型,从抗氧化的角度探究汉黄芩素抑制巨噬细胞炎症反应的作用机制,并探究汉黄芩素对Nrf2信号通路的影响。
1 材料与方法
1.1实验材料 小鼠巨噬细胞系RAW264.7(ATCC:TIB-71),由北京中医药大学免疫与微生物学系实验室保存。汉黄芩素购自中国药品生物制品检定所,反转录试剂盒、ATP购自TaKaRa公司,RNA提取试剂TRIZOL购自Invitrogen公司,SYBGreen荧光定量PCR试剂盒购自ToYoBo公司,LPS购自Sigma公司,SOD、MDA检测试剂盒购自凯基生物公司,胎牛血清购自HyClone公司,Anti-Nrf2抗体、山羊抗兔IgG购自Abcam公司,4%组织细胞固定液购自索莱宝公司,山羊血清购自中杉金桥公司,NO试剂盒购自南京建成生物工程研究所。引物采用Primer5.0设计,由生工生物工程(上海)股份有限公司合成(表1)。
1.2实验方法
1.2.1细胞培养 RAW264.7细胞用含 10%胎牛血清的 DMEM 高糖培养基在37℃、5%CO2的无菌培养箱中培养。镜下观察细胞密度达80%左右予以传代。
1.2.2检测试剂盒测定巨噬细胞SOD、MDA、NO的分泌水平 将对数生长期的巨噬细胞RAW264.7接种到6孔板中(1×106个细胞/孔),设对照组(正常培养不予以刺激)、模型组(先加LPS刺激4 h后再加ATP刺激30 min,LPS和ATP终浓度均为 1 μg/ml)和汉黄芩素(56 μmol/L、28 μmol/L、14 μmol/L)干预组(加入LPS的同时加入汉黄芩素,4 h后加ATP刺激30 min),每组4个复孔。取培养皿中的上清,按照SOD、MDA、NO检测试剂盒说明书,分别对各组细胞上清中的SOD、MDA、NO水平进行检测。
1.2.3免疫荧光法检测巨噬细胞Nrf2核转位 将巨噬细胞RAW264.7制成细胞浓度为1×104个/ml的细胞悬液,接种1 ml到20 mm激光共聚焦培养皿中。设对照组、模型组、汉黄芩素干预组,各组处理方式同方法1.2.2。待细胞生长至50%~60%,吸净培养基,用PBS清洗细胞(3次,3 min/次)。每皿加2 ml 4%多聚甲醛溶液,室温固定细胞15 min,用PBS清洗细胞(3次,3 min/次)。接着,用0.1%Triton X-100处理细胞15 min(室温透化),PBS清洗细胞(3次,5 min/次),然后用山羊血清封闭细胞1 h(每皿1 ml),吸净封闭液,加入兔抗Nrf2抗体工作液(山羊血清1∶500稀释),37℃孵育2 h。PBS洗细胞(3次,5 min/次),加入羊抗兔IgG的二抗工作液(山羊血清1∶500稀释),37℃孵育1 h。PBS洗细胞(3次,5 min/次)。加入DAPI对细胞核染色(蓝色),室温避光孵育5 min。PBS洗细胞(3次,5 min/次),在激光共聚焦显微镜下观察Nrf2(红色)的定位情况。
1.2.4RT-qPCR检测巨噬细胞Nrf2和抗氧化酶mRNA水平 将巨噬细胞RAW264.7接种到6孔板中(2×106个细胞/孔),设对照组、模型组、汉黄芩素(56 μmol/L、28 μmol/L、14 μmol/L)干预组,每组3个复孔,各组处理方法与1.2.2相同。弃去各孔培养基后用PBS清洗各孔细胞,加入TRIZOL试剂裂解细胞(500 μl/孔),参照说明书的操作要求分别提取各孔细胞的总RNA。参照反转录试剂盒操作说明,各取1 μg RNA配制10 μl反转录体系合成相应的cDNA,得到的cDNA用DEPC水做10倍稀释后备用。取1 μl稀释后的cDNA作为模板,以小鼠GAPDH基因作为内参,加入相应的引物(表1),利用实时荧光定量PCR(qPCR)法检测各组样品中相应基因的mRNA水平。定量分析基因包括Nrf2、HO-1、SOD、GPx、CAT以及NQO-1,qPCR数据采用2-ΔΔCt法进行处理和分析。
表1 设计并合成的引物
Tab.1 Primers designed and synthesized in this study

PrimersSequence(5'to 3')qR_Nrf2-FTCTGAGCCAGGACTACGACGqR_Nrf2-R GAGGTGGTGGTGTCTCTGCqR_HO-1-FACAGGTTGACAAGAAGAGGCTAAqR_HO-1-RAACAGGAAGCTGAGAGTGAGGqR_SOD-FGCCCGCTAAGTGCTGAGTCqR_SOD-RAGCCCCAGAAGGATAACGGAqR_GPx-FAGGGTAGAGGCCGGATAAGGqR_GPx-RCGAGCAGCACACATACTGGAqR_CAT-FCTGAGAGAGGGTACACGCAqR_CAT-RGAGCCTGACTCTCCAGTGACqR_NQO-1-FGAGAGGATGGGAGGTACTCGqR_NQO-1-RAATATCTGGGCTCAGGCGTC

2 结果
2.1汉黄芩素干预能明显降低LPS和ATP联合刺激的巨噬细胞MDA、NO分泌水平 模型组(LPS-ATP联合刺激)与对照组相比,巨噬细胞分泌的NO、MDA显著增多;与模型组相比,汉黄芩素干预组能够明显降低巨噬细胞NO、MDA的分泌水平(表2)。
2.2汉黄芩素能促进LPS和ATP联合刺激的巨噬细胞Nrf2 mRNA表达及胞内Nrf2的核转位 荧光定量PCR结果显示,与对照组相比,模型组(LPS-ATP联合刺激)巨噬细胞中的Nrf2 mRNA水平显著升高;与模型组相比,汉黄芩素低剂量干预组(14 μmol/L)巨噬细胞中的Nrf2 mRNA水平明显升高(图1A)。免疫荧光法观察巨噬细胞内Nrf2核转位发现,对照组巨噬细胞内Nrf2几乎不表达,模型组Nrf2明显表达,但多在胞浆内,汉黄芩素干预组巨噬细胞内Nrf2明显表达,且细胞核内的Nrf2表达量较模型组明显增多(图1B、C)。
2.3汉黄芩素能够上调LPS和ATP联合刺激的巨噬细胞抗氧化酶HO-1、SOD、GPx、CAT以及NQO-1的mRNA水平 荧光定量PCR结果显示,与对照组相比,模型组巨噬细胞中抗氧化酶HO-1、SOD、GPx、CAT、NQO-1的mRNA水平显著降低。在LPS-ATP联合刺激时加入汉黄芩素干预,细胞中这些抗氧化酶的mRNA水平显著升高(图2)。
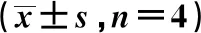

GroupsMDA(nmol/ml)NO(μmol/L)Control group0.34±0.0327.84±0.55Model group1.14±0.071)44.51±2.081)Low dose wogonin(14 μmol/L)0.88±0.112)23.87±1.522)Middle dose wogonin( 28 μmol/L)0.75±0.092)40.30±0.92High dose wogonin(56 μmol/L)0.67±0.062)30.12±1.172)
Note:Compared to Control group,1)P<0.01;compared to Model group,2)P<0.01.
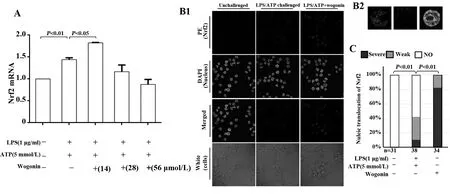
图1 汉黄芩素对LPS和ATP刺激的巨噬细胞(RAW264.7)Nrf2 mRNA水平及Nrf2核转位的影响

图2 汉黄芩素对LPS和ATP联合刺激的RAW264.7细胞抗氧化酶mRNA水平的影响
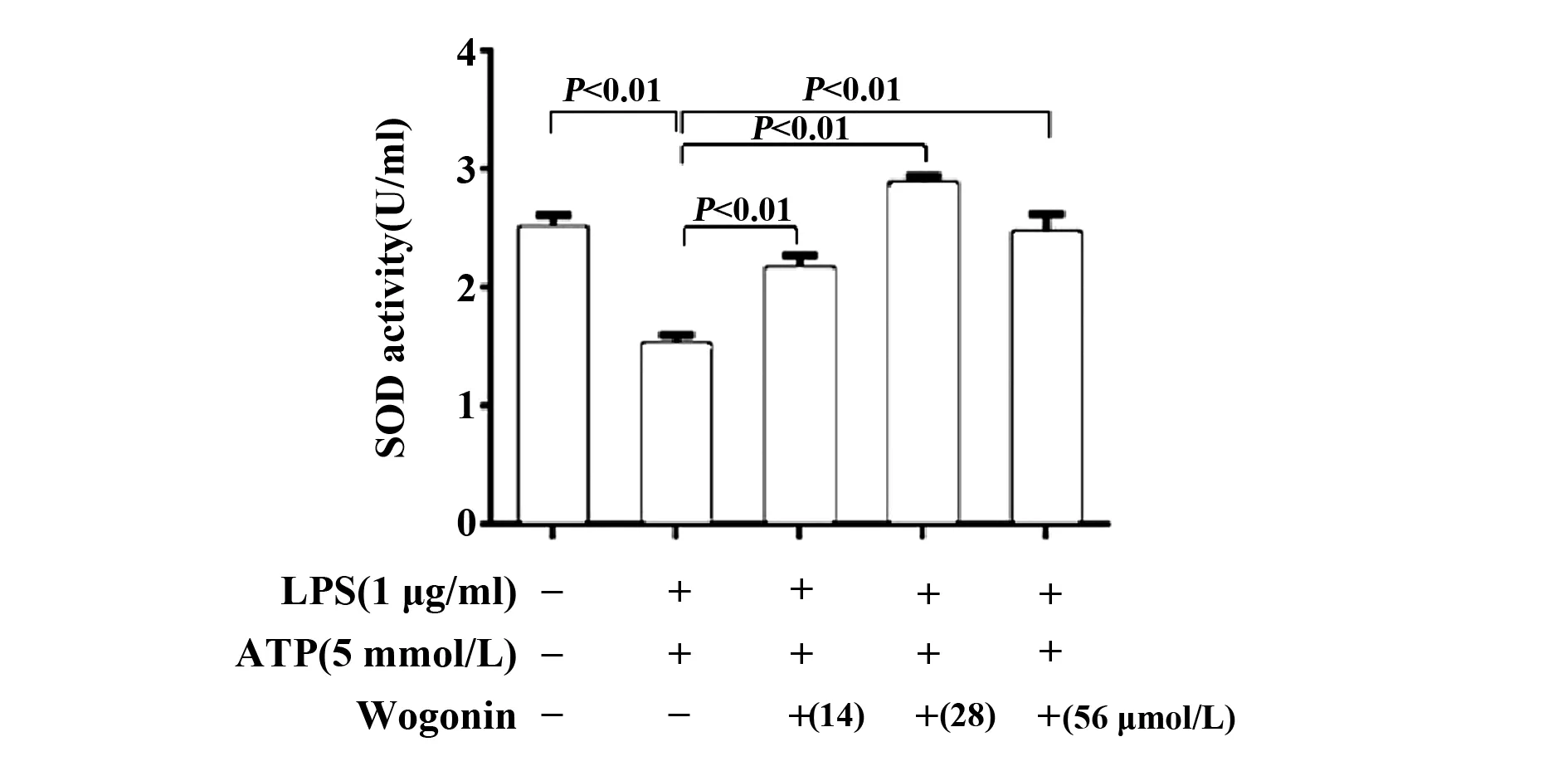
图3 汉黄芩素对LPS和ATP联合刺激的RAW264.7细胞SOD活性的影响
2.4汉黄芩素能明显提高LPS和ATP联合刺激的巨噬细胞SOD活性 模型组(LPS-ATP联合刺激)与对照组相比,SOD活性显著降低;与模型组相比,汉黄芩素干预组能显著逆转SOD活性被抑制的情况(图3)。
3 讨论
炎症是机体对各种致炎因素引起组织损害而产生的一种基本病理过程,也是许多疾病的重要发生机制。适当的炎症反应作为机体的一种自我保护机制是有益的,但过度炎症反应则会造成组织器官严重的病理损伤。我们课题组的前期研究表明,汉黄芩素能显著抑制LPS和ATP联合诱导的巨噬细胞RAW264.7的炎症反应,能明显降低胞内IL-1β、IL-18、IL-6、TNF-α、NLRP3和Caspase-1的mRNA水平,减少NF-κB核转位,并能下调胞外TNF-α和胞内ROS水平[6]。ROS又称活性氧,其产生与炎症密切相关。有研究表明,ROS可以激活巨噬细胞的核转录因子NF-κB核转位,诱导炎症反应[7]。还有研究表明,细胞应激后ROS浓度增加导致硫氧还蛋白(TXNIP也称为VDUP1)从氧化硫氧还蛋白-1(Trx-1)中解离,TXNIP随后与NLRP3相结合并激活NLRP3炎性小体[9]。这些都说明汉黄芩素对巨噬细胞炎症的抑制作用可能与其下调胞内ROS水平有关,那么汉黄芩素又是通过什么机制下调胞内ROS水平的呢?众所周知,ROS是氧化应激的重要产物,而氧化应激的发生是由于机体或细胞遭受内源性或外源性的有害物质刺激后,产生大量的自由基,释放出过多的活性氧簇(ROS)、活性氮簇(RNS)等氧化物质,而机体或细胞本身的抗氧化能力下降,机体的氧化反应大大超出抗氧化的清除能力,导致大量积累的 ROS等[11]氧化物不能被清除,从而诱导细胞损伤,并促进炎症反应发生[10]。反过来,炎症细胞在炎症部位释放出许多活性物质,也会导致氧化应激加剧。薛嘉虹等[11]研究表明,炎症因子 TNF-α 可增强 NADPH 氧化酶的表达,并抑制抗氧化酶SOD的表达,导致氧化应激反应的发生,而抑制 TNF-α 的表达,可有效地抑制氧化应激反应。由此可见,氧化应激和炎症是密切相关的病理生理过程,常相伴而生。据此,本研究以LPS和ATP联合刺激的RAW264.7小鼠巨噬细胞为炎症细胞模型,从抗氧化应激的角度探究汉黄芩素下调ROS水平的作用机制,从而证明汉黄芩素能否通过抑制氧化应激下调ROS水平,进而抑制NF-κB核转位,减少NLRP3活化,最终抑制炎症反应的发生。
NO是活性氮簇(RNS)中的一种,是氧化应激的重要产物,其分泌水平能反映氧化应激的程度。氧化应激生成过多的ROS会引起细胞发生过氧化脂质反应,使细胞膜受到损伤,破坏细胞的功能和结构,而丙二醇(MDA)作为过氧化脂质产生的终末产物是公认的氧化应激标志物。本实验结果发现,与对照组相比,模型组巨噬细胞NO、MDA的分泌水平显著提高,而汉黄芩素干预组相对于模型组其细胞NO、MDA的分泌水平显著降低,说明炎症反应能伴随氧化应激的发生,汉黄芩素能抑制氧化应激的发生。
Nrf2信号通路是细胞内氧化应激最重要的防御系统之一,当细胞发生氧化应激,Nrf2 信号通路首先被激活,Nrf2因子核转位与抗氧化反应元件(anti-oxidant response element,ARE)上的DNA 基序(GCTGAGTCA)识别并结合,启动抗氧化基因的转录,进而引发抗氧化物及相关酶类的大量表达,包括 NADPH、 NQO-1、 HO-1、 SOD、 GPx 和 GST 等,以抵御氧化应激引发的细胞损伤[7]。本实验结果发现,与模型组相比,汉黄芩素干预组能显著提高巨噬细胞内Nrf2 mRNA水平,促进Nrf2的核转位,并能显著上调抗氧化酶HO-1、SOD、GPx、CAT、NQO-1的mRNA水平,增加SOD活性,说明汉黄芩素可激活转录因子Nrf2进行核转位,启动抗氧化酶基因的转录,促进抗氧化酶蛋白的表达,从而发挥抗氧化作用。
综上所述,LPS与ATP联合刺激巨噬细胞能够引起细胞的氧化应激,汉黄芩素可能通过激活Nrf2核转位,启动抗氧化酶基因的转录,诱导抗氧化酶的表达,清除过量的自由基,包括ROS、NO等,继而抑制NF-κB的核转位,减少NLRP3炎性体活化,从而发挥抑制炎症反应的作用。本研究在一定程度上丰富了汉黄芩素抗炎抗氧化的作用机制,然而,其抗氧化的具体分子机制,如汉黄芩素是如何激活Nrf2核转位的,对Nrf2-ARE信号通路上的关键信号分子有何影响仍有待进一步的研究。