吉非替尼联合苦参碱对人结肠癌细胞的抑制作用①
2020-02-20时军利李炳庆承德医学院附属医院消化内科承德067000
时军利 王 磊 李 萍 李炳庆 (承德医学院附属医院消化内科,承德 067000)
结肠癌发病率居全球常见癌症的第三位,且发病率有逐年增高的趋势,其致死率高,在美国2017年就报告了新发病例135 430例,病死例数约为50 260例,我国2015年报告了350 000例新发病例和190 000例死亡病例[1]。目前对于结肠癌的治疗主要是手术和化疗,前者主要应用于早期未发生转移的病例,虽然化疗可以为根治术后的患者或者符合手术条件的患者带来临床获益,但因化疗副作用及化疗耐受等因素,大部分患者并不能从中获益[2]。故而,对于新的副作用小及安全有效的治疗方案仍为研究的前沿热点。
吉非替尼(GEF)是可逆性小分子酪氨酸激酶抑制剂,可以竞争性地结合表皮生长因子受体(EGFR)酪氨酸激酶催化区域的Mg-ATP结合位点,从而起到抑制EGFR自身磷酸化的作用,并由此阻断其下游信号分子的传导,最终达到抑制肿瘤的作用[3]。吉非替尼在多种肿瘤中均有抑癌作用,如非小细胞肺癌、结肠癌、乳腺癌及卵巢癌等[4],因为这些肿瘤中均有EGFR的异常活化,从而通过下游通路激活肿瘤细胞的增殖、抗凋亡、侵袭和转移等功能[5]。但是,随着吉非替尼的疗程增加,患者逐渐出现对药物的抵抗性,这可能是因为结肠癌患者中缺乏具有活性的突变型EGFR[6],所以需要进一步进行吉非替尼联合其他药物治疗结肠癌患者的研究,这可以使患者从中获益,尤其是那些已经对吉非替尼产生耐药性的患者,这显得尤为重要。
作为中医文化的起源地,中药是我国乃至全球的宝贵财富,诸多中药或者其提取物在抑癌治疗上显示了显著的优势。苦参碱是豆科槐属植物苦参的主要有效成分之一,有报道指出其具有调节血脂、增强免疫力、抗炎等功效,并不断有研究证明其在诸多肿瘤上具有抗肿瘤作用,如宫颈癌和子宫内膜癌、肺癌、乳腺癌、非小细胞肺癌及结肠癌等[7-11]。但是苦参碱联合吉非替尼在结肠癌细胞的体内、体外及临床研究尚无报道,本研究旨在探究这两种药物是否起到协同或者相加的作用,从而为临床治疗结肠癌患者提供新的治疗思路。
1 材料与方法
1.1材料 细胞培养基1640和高糖DMEM购自美国Coring公司(1640批号10-040-CVR,DMEM批号10-013-CVR);青链霉素双抗购自北京雷根生物技术公司(货号CA0075);胎牛血清购自 Gibco 公司(货号10099-141);培养皿、培养瓶、培养板、各种型号的枪头、Transwell小室等常用耗材均购自北京普京康利有限公司,甲醇、分离胶、浓缩胶、TBST等化学试剂购自北京普利莱试剂公司;Vemintin(货号D21H3)、SNAIL(货号C15D3)、Cyclin D1 抗体(货号92G2)、P-mTOR抗体(货号D9C2)、mTOR抗体(货号7C10)、Caspase-3抗体(货号9662S)和 Bax抗体(货号D2E11)均购自美国CST公司; ECLPlμs化学发光试剂盒、HRP辣根过氧化物酶标记山羊抗兔IgG二抗及HRP辣根过氧化物酶标记山羊抗鼠IgG二抗及细胞周期和凋亡检测试剂盒(C1052)均购自上海碧云天生物技术公司;PVDF(IPVH00010)转印膜购自密理博(Millipore)公司;亚甲基蓝溶液购自北京中生瑞泰科技公司;BCA蛋白定量试剂盒购自北京普利莱试剂公司;二甲基亚砜(DMSO)购自南京凯基生物技术发展公司;用DMSO制备储存浓度为5 mmol/L的吉非替尼(上海Selleck-Biotool公司)溶液;用1640或者DMEM配制储存浓度为200 mg/ml的苦参碱(MA,Sigma公司)溶液。
1.2方法
1.2.1细胞培养 人结肠癌细胞系:HCT116(细胞系从北京协和细胞库购买)接种于含10%胎牛血清(Gibco,USA)和1%青链霉素的 RPMI1640(Coring,USA)培养液,于37℃ 5%CO2的培养箱中培养;SW480和SW620(细胞系从北京协和细胞库购买)用含10%胎牛血清(Gibco,USA)和1%青链霉素的 DMEM(Coring,USA),于37℃ 5%CO2的培养箱中培养。
1.2.2CCK8细胞增殖实验 利用96孔细胞培养板进行相关操作,将3种人结肠癌细胞系按照5 000个/孔细胞量进行均匀铺板后,在37℃ 5%CO2恒温培养过夜,待细胞贴壁完全后,用含0 μmol/L GEF+0 mg MA、16 mg/ml MA[12]、10 μmol/L GEF[13]、16 mg/ml MA+10 μmol/L GEF的血清培养液进行换液培养,并于换液后的0 h、24 h、48 h、96 h后弃去培养液,代之以无血清培养基100 μl/孔,并加入CCK8试剂10 μl,于培养箱继续培养2 h后用酶标仪进行测量OD值,并记录数据。每个细胞系每组设置5块板6个复孔,每天用一块。
1.2.3细胞创伤愈合实验 将3种细胞系以一定密度接种到6孔细胞培养板中,生长24~48 h后,待细胞密度应达到70%~80%后,用200 μl枪头轻轻地在细胞间进行划痕,划痕纵穿整个培养孔,之后用培养基轻轻洗板2次,将脱落细胞洗去,随后用含0 μmol/L GEF+0 mg MA、16 mg/ml MA、10 μmol/L GEF、16 mg/ml MA+10 μmol/L GEF的无血清培养液进行培养,并于 48 h后,用电子显微镜下拍照采图,并用Image J软件进行测量并计算。
1.2.4克隆形成实验 在含有4 ml培养基的6孔板中接种5×103个细胞,待细胞贴壁完全之后,用16 mg/ml MA、10 μmol/L GEF、16 mg/ml MA+10 μmol/L GEF的血清培养液进行换液培养14 d,无药物组则不加任何药物处理,中间视细胞状态随时更换新鲜的含药培养基。14 d后待克隆团形成之后用10%甲醛固定细胞,1%亚甲基蓝染色,流水冲洗干净晾干后在显微镜下计数克隆数(克隆数>50个细胞的视为克隆团)并记录数据。
1.2.5细胞周期实验 将3种细胞系以一定密度接种到60 mm细胞培养板中过夜培养,随后将培养基更换为含0 μmol/L GEF+0 mg MA、16 mg/ml MA、10 μmol/L GEF、16 mg/ml MA+10 μmol/L GEF的血清培养液进行培养,24 h后用胰酶收集细胞,固定于4℃过夜后,按照周期检测试剂盒说明书进行PI细胞染色,随后用流式细胞仪进行检测。
1.2.6细胞凋亡实验 将3种细胞系以一定密度接种到60 mm细胞培养板中过夜培养,随后将培养基更换为含0 μmol/L GEF+0 mg MA、16 mg/ml MA、10 μmol/L GEF、16 mg/ml MA+10 μmol/L GEF的血清培养液进行培养,24 h后用胰酶收集细胞于离心管中,加入Binding buffer与FITC标记的Annexin-V 室温避光30 min,再加入PI避光孵育5 min,随后用流式细胞仪进行检测。
1.2.7Western blot Western blot方法检测Caspase-3、Bax、Vemintin、SNAIL、Cyclin D1、P-AMPK、AMPK、P-mTOR和mTOR等蛋白的表达水平。细胞经过不同组别的药物处理24 h后,用含蛋白酶抑制剂的RIPA buffer裂解液,进行蛋白质的裂解及收集,用BCA蛋白定量剂盒对所提取的蛋白质的浓度进行测定。各组取30 μg蛋白总量进行上样,经SDS-PAGE凝胶电泳将其分离后,经电转(半干转或者湿转)操作将蛋白从凝胶转移至聚偏二氟PVDF上,随后进行封闭(室温摇晃1~2 h),一抗4℃过夜孵育,二抗常温孵育2 h后,根据ECL化学发光试剂盒说明书在化学发光检测仪(上海天能)中对PVDF膜上的蛋白印迹进行曝光显色,并进行拍照保存图片。

2 结果
2.1联合用药对人结肠癌细胞系的增殖抑制作用 单一使用MA或者GEF均可以显著抑制人结肠癌细胞系的增殖能力(P<0.05),二者联用之后,对增殖能力的抑制作用较单一用药组更为显著,且表现出时间依赖性,差异具有统计学意义(P<0.05),说明联合用药可以显著抑制人结肠癌细胞系的增殖。见图1及表1~3。
2.2联合用药对人结肠癌细胞系克隆形成的影响 与空白组比较,单用MA或者单用GEF组,人结肠癌细胞系的克隆形成能力显著降低,差异有统计学意义(P<0.05);与单用GEF或者MA组比较联合组人结肠癌细胞系克隆形成能力下降得更为明显(P<0.05)。见图2、表4。
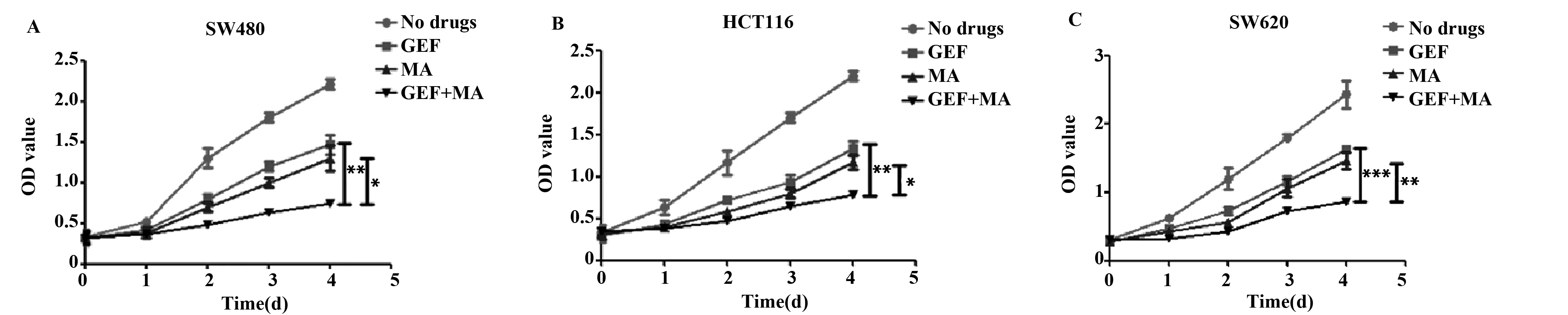
图1 经过各组药物处理之后的人结肠癌细胞系增殖能力变化
2.3联合用药对人结肠癌细胞系周期的影响 与空白组比较,单用MA或单用GEF,均可以诱导人结肠癌细胞系的细胞周期不同程度阻滞在G0/G1期;二者联合应用后细胞G0/G1期阻滞更为显著;见图3、表5。

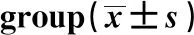
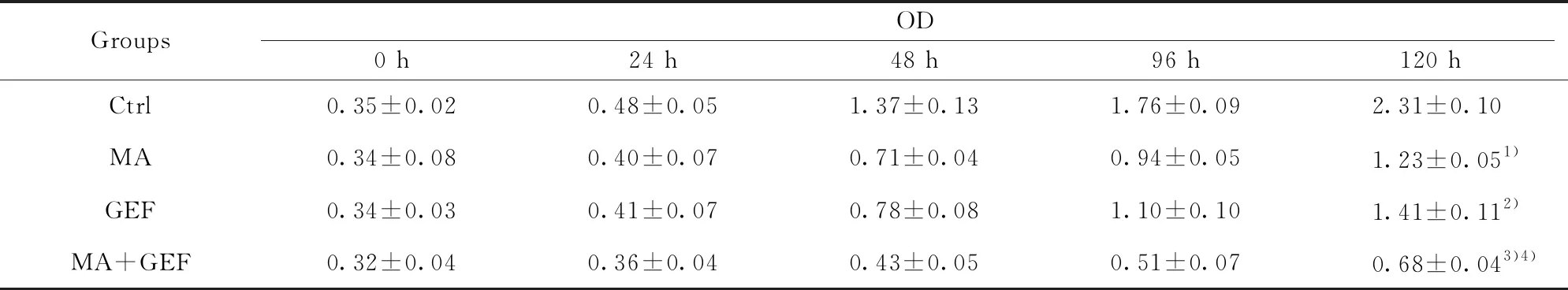
GroupsOD0 h24 h48 h96 h120 hCtrl0.35±0.020.48±0.051.37±0.131.76±0.092.31±0.10MA0.34±0.080.40±0.070.71±0.040.94±0.051.23±0.051)GEF0.34±0.030.41±0.070.78±0.081.10±0.101.41±0.112)MA+GEF0.32±0.040.36±0.040.43±0.050.51±0.070.68±0.043)4)
Note:MA vs Ctrl,1)P<0.001;GEF vs Ctrl,2)P<0.001;MA+GEF vs GEF,3)P<0.01;MA+GEF vs MA,4)P<0.05.

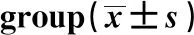

GroupsOD0 h24 h48 h96 h120 hCtrl0.33±0.150.63±0.151.17±0.251.70±0.102.20±0.10MA0.30±0.130.40±0.050.58±0.070.80±0.101.16±0.151)GEF0.31±0.110.43±0.070.71±0.080.93±0.151.13±0.152)MA+GEF0.34±0.010.38±0.020.47±0.020.65±0.050.78±0.073)4)
Note:MA vs Ctrl,1)P<0.001;GEF vs Ctrl,2)P<0.001;MA+GEF vs GEF,3)P<0.01;MA+GEF vs MA,4)P<0.05.

GroupsOD0 h24 h48 h96 h120 hCtrl0.31±0.050.71±0.121.37±0.151.83±0.032.46±0.32MA0.31±0.140.45±0.080.63±0.170.86±0.111.46±0.101)GEF0.33±0.010.47±0.010.67±0.110.93±0.121.33±0.092)MA+GEF0.32±0.130.39±0.040.51±0.060.67±0.070.81±0.063)4)
Note:MA vs Ctrl,1)P<0.001;GEF vs Ctrl,2)P<0.001;MA+GEF vs GEF,3)P<0.01;MA+GEF vs MA,4)P<0.05.
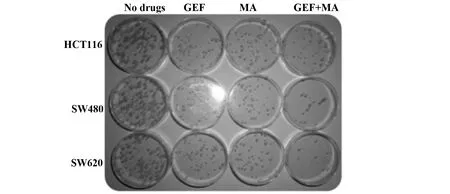
图2 经过各组药物处理之后的人结肠癌细胞系HCT116,SW480和SW620的克隆形成能力变化


GroupsClone formation number(individual)HCT116SW480SW620Ctrl185±17166±13153±12MA50±61) 52±91) 57±111)GEF46±32)41±42)38±22)MA+GEF 22±33)4) 12±43)4) 8±23)4)
Note:MA vs Ctrl,1)P<0.001;GEF vs Ctrl,2)P<0.001;MA+GEF vs GEF,3)P<0.01;MA+GEF vs MA,4)P<0.05.
2.4联合用药抑制人结肠癌细胞系的迁移能力 与空白对照组比较,单用MA或者单用GEF人结肠癌细胞系迁移能力显著降低(P<0.05);而二者联用与单一用药组比较细胞的迁移能力显著降低(P<0.05),见图4、表6。
2.5联合用药对人结肠癌细胞系的凋亡影响 与空白对照组,单用MA或者单用GEF处理后,人结肠癌细胞系的凋亡比例显著增加(P<0.05);联合使用MA+GEF组,细胞凋亡比例明显高于单一用药组,差异具有统计学意义(P<0.05),见图5、表7。
2.6联合用药对人结肠癌细胞系转移相关蛋白及增殖相关蛋白的表达的影响 与空白组及单用MA或者单用GEF组比较,联合使用MA+GEF组的人结肠癌细胞HCT116的Vemintin、SNAIL、Cyclin D1的蛋白水平显著下降,而Caspase-3、Bax的表达则明显上升,差异具有统计学意义(P<0.05),见图6、表8。

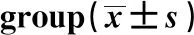
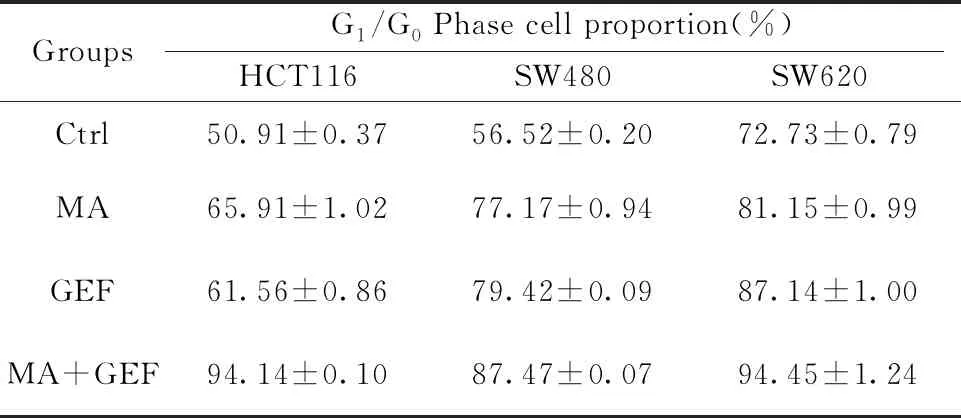
GroupsG1/G0 Phase cell proportion(%)HCT116SW480SW620Ctrl50.91±0.3756.52±0.2072.73±0.79MA65.91±1.0277.17±0.9481.15±0.99GEF61.56±0.8679.42±0.0987.14±1.00MA+GEF94.14±0.1087.47±0.0794.45±1.24
Note:MA alone or GEF alone can increase the proportion of cells in the G0/G1phase of human colon cancer cell line,especially after combined administration.
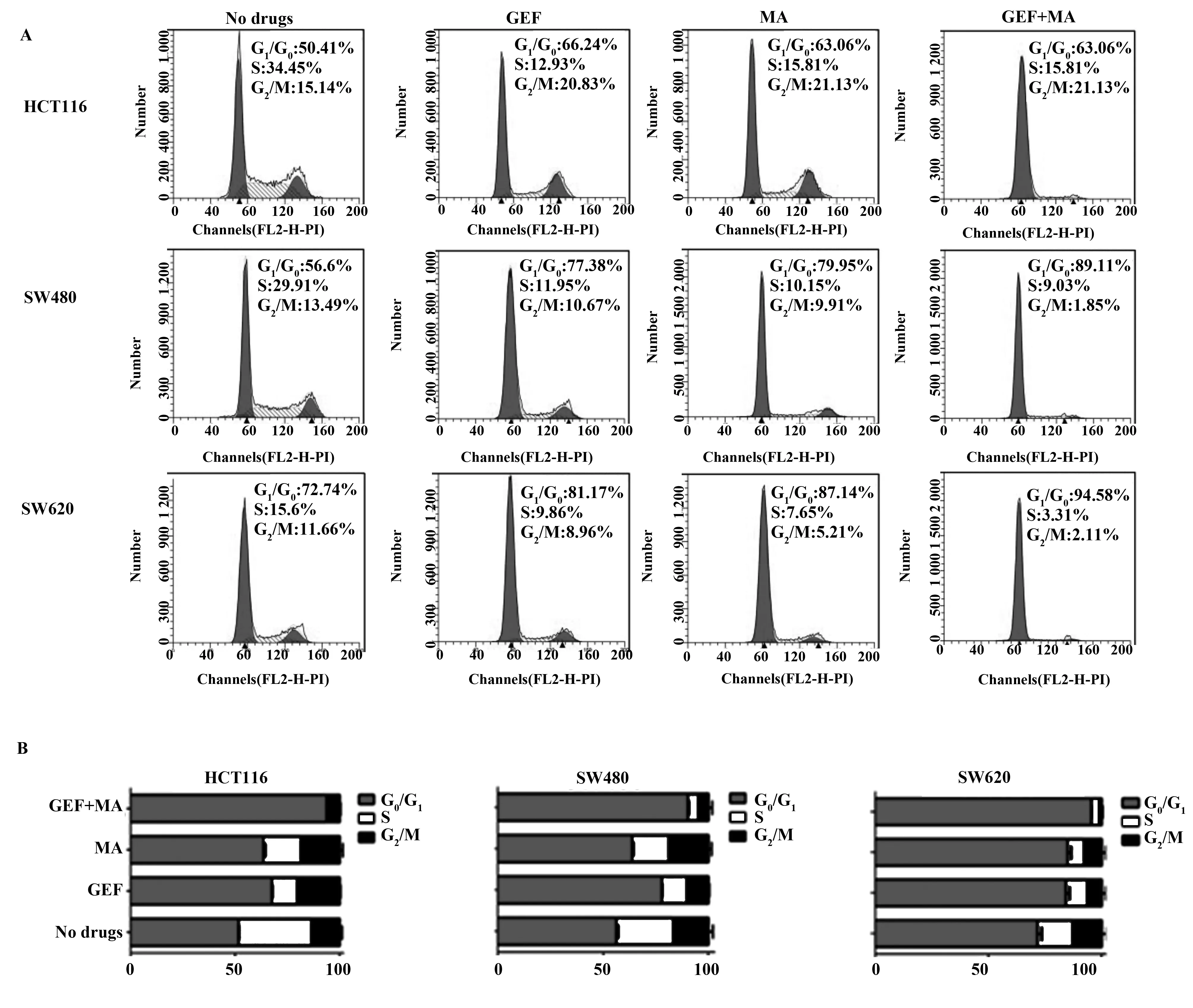
图3 经过各组药物处理之后的人结肠癌细胞系HCT116,SW480和SW620的周期分布变化
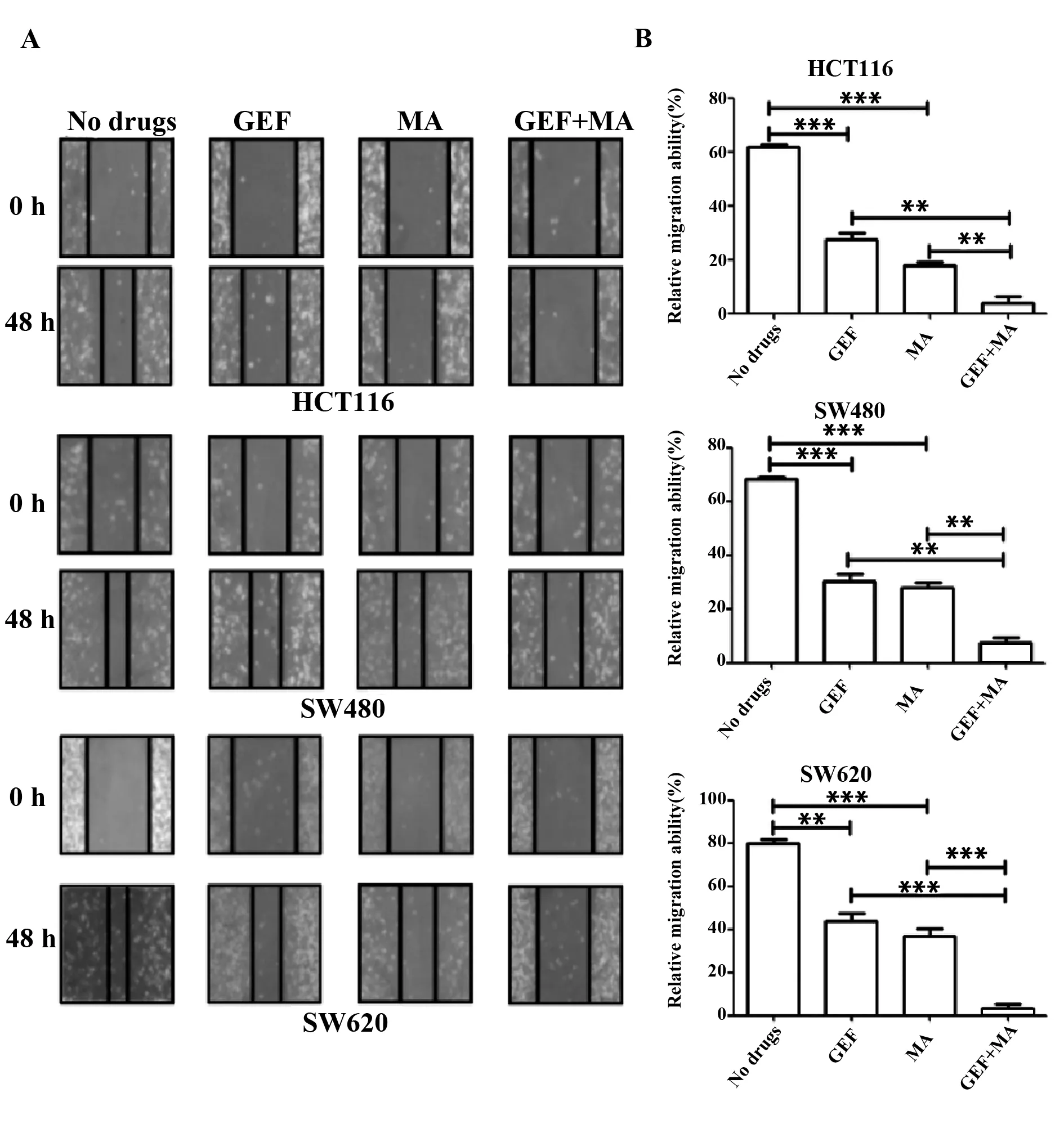
图4 经过各组药物处理之后的人结肠癌细胞系HCT116、SW480和SW620的细胞迁移能力变化
2.7联合用药对人结肠癌细胞系中AMPK信号通路的影响 MA组、GEF组及联合用药组中的HCT116细胞内P-AMPK的蛋白水平显著高于无药物组,而P-mTOR的蛋白表达量则明显减少,差异具有统计学意义(P<0.05),见图7、表9。

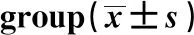
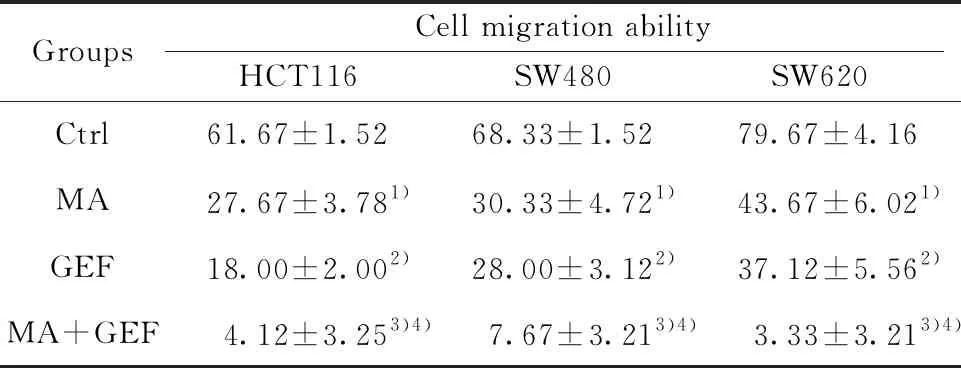
GroupsCell migration abilityHCT116SW480SW620Ctrl61.67±1.5268.33±1.5279.67±4.16MA27.67±3.781)30.33±4.721)43.67±6.021)GEF18.00±2.002)28.00±3.122)37.12±5.562)MA+GEF4.12±3.253)4)7.67±3.213)4)3.33±3.213)4)
Note:MA vs Ctrl,1)P<0.001;GEF vs Ctrl,2)P<0.001;MA+GEF vs GEF,3)P<0.01;MA+GEF vs MA,4)P<0.05.
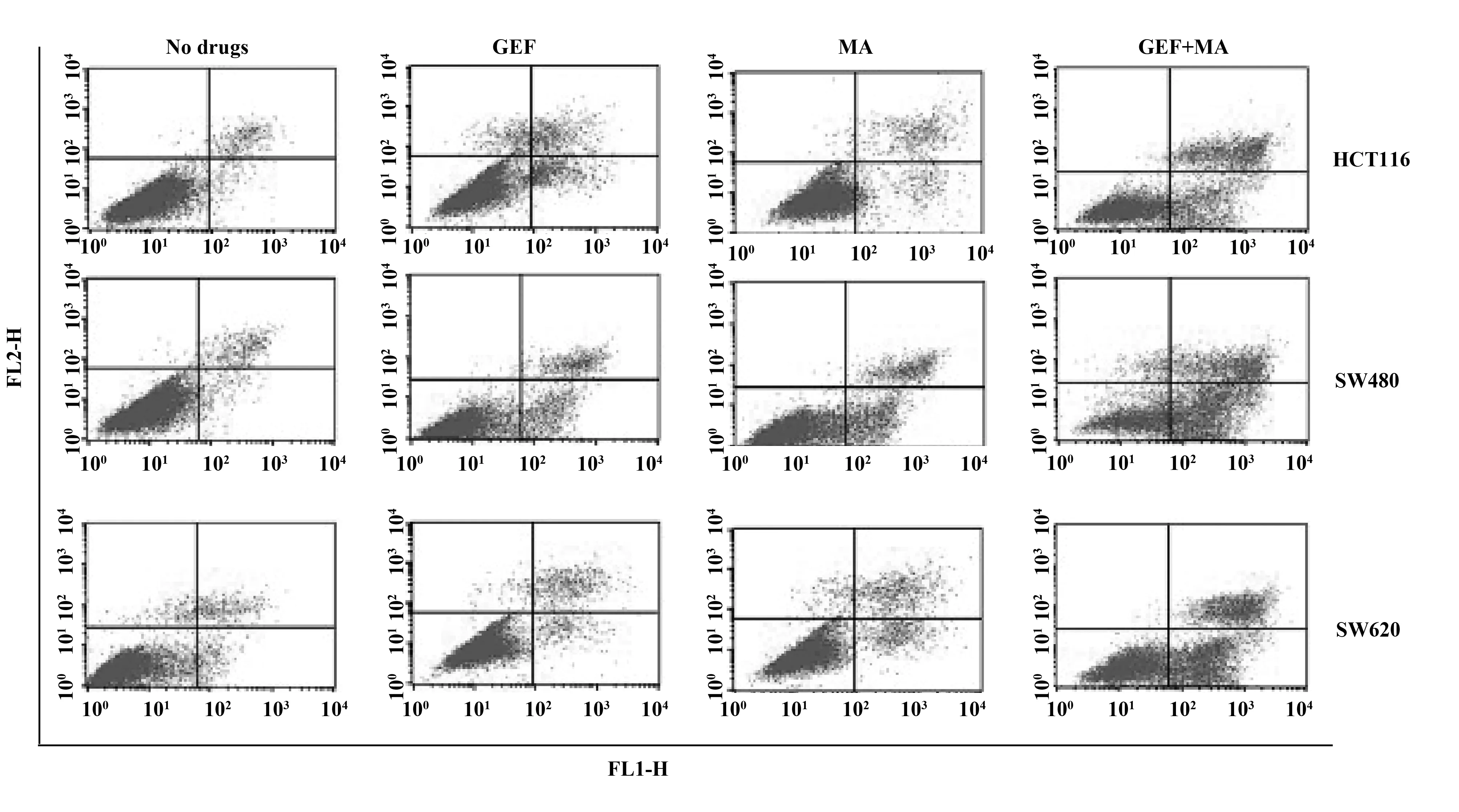
图5 各组药物对人结肠癌细胞系HCT116、SW480和SW620的凋亡比例的影响
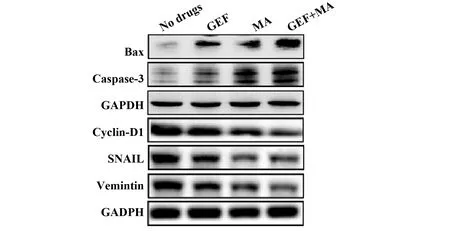
图6 各组药物对人结肠癌细胞系HCT116、SW480和SW620中Bax、Caspase-3、Cyclin-D1、SNAIL及Vemintin蛋白表达水平的影响
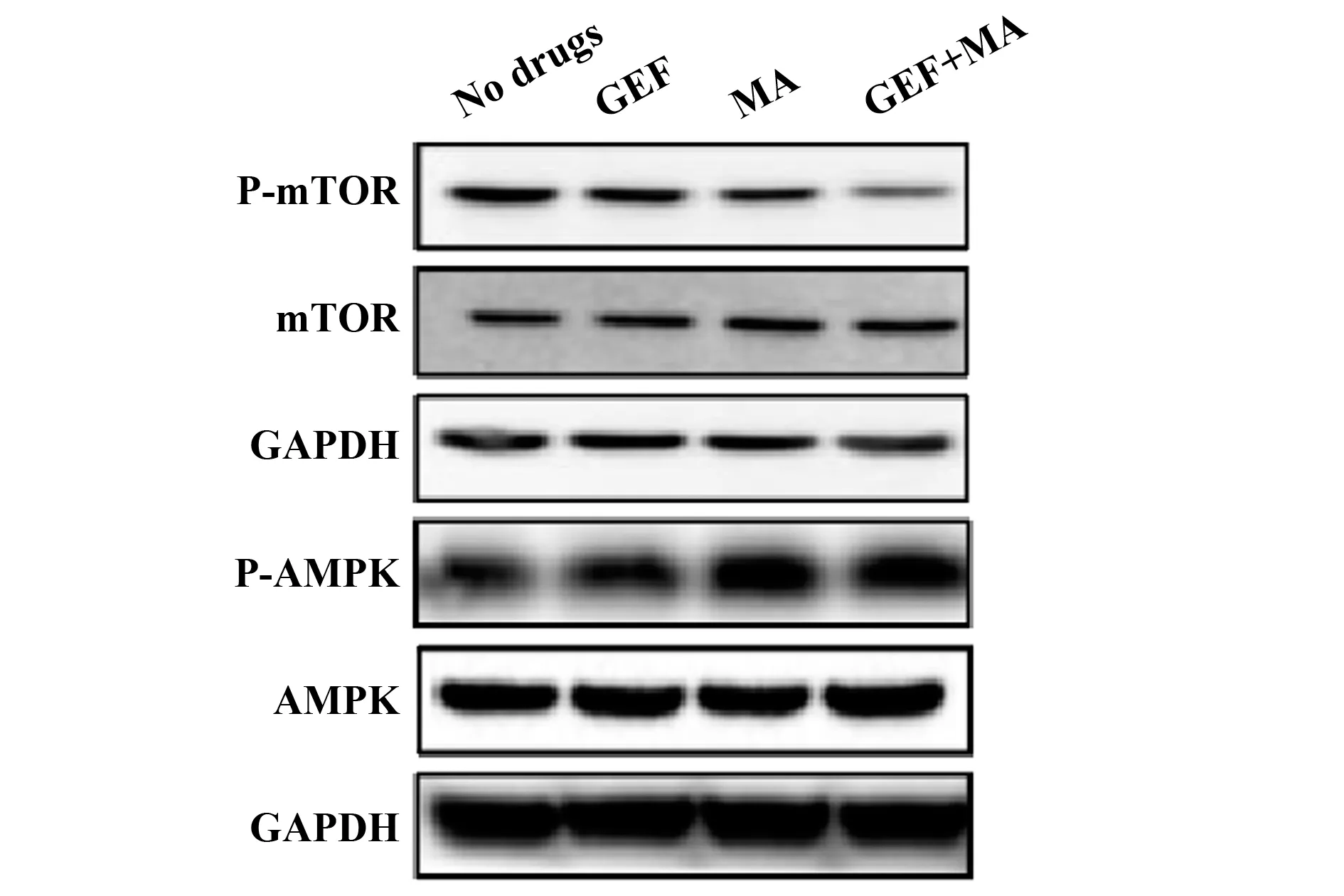
图7 各组人结肠癌细胞系HCT116中P-AMPK、AMPK、P-mTOR和mTOR的蛋白表达

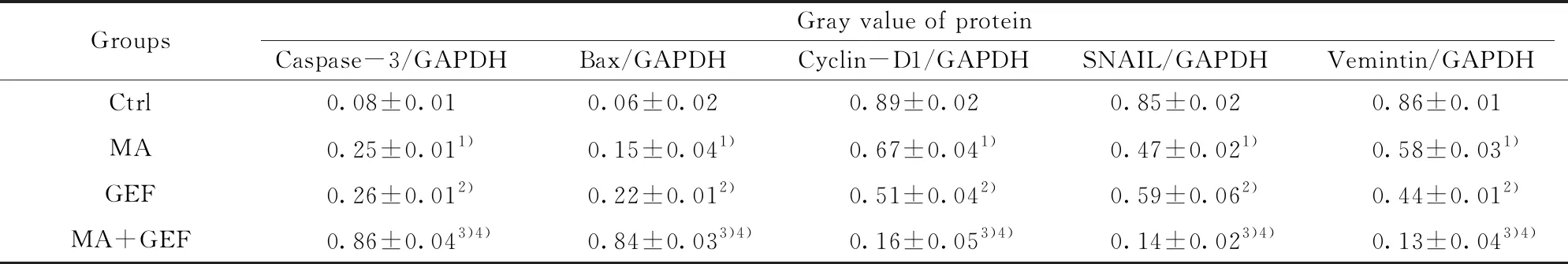
GroupsGray value of proteinCaspase-3/GAPDHBax/GAPDHCyclin-D1/GAPDHSNAIL/GAPDHVemintin/GAPDHCtrl0.08±0.010.06±0.020.89±0.020.85±0.020.86±0.01MA0.25±0.011)0.15±0.041)0.67±0.041)0.47±0.021)0.58±0.031)GEF0.26±0.012)0.22±0.012)0.51±0.042)0.59±0.062)0.44±0.012)MA+GEF0.86±0.043)4)0.84±0.033)4)0.16±0.053)4)0.14±0.023)4)0.13±0.043)4)
Note:MA vs Ctrl,1)P<0.001;GEF vs Ctrl,2)P<0.001;MA+GEF vs GEF,3)P<0.01;MA+GEF vs MA,4)P<0.05.

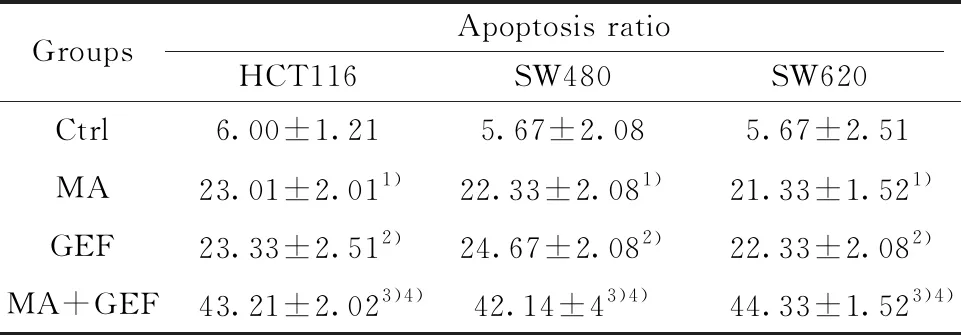
GroupsApoptosis ratioHCT116SW480SW620Ctrl6.00±1.215.67±2.085.67±2.51MA23.01±2.011)22.33±2.081)21.33±1.521)GEF23.33±2.512)24.67±2.082)22.33±2.082)MA+GEF43.21±2.023)4)42.14±43)4)44.33±1.523)4)
Note:MA vs Ctrl,1)P<0.001;GEF vs Ctrl,2)P<0.001;MA+GEF vs GEF,3)P<0.01;MA+GEF vs MA,4)P<0.05.
3 讨论
EGFR在诸多类型的肿瘤中均有异常表达,研究显示EGFR在结肠癌中处于高表达状态,且其高表达与不良的临床预后有着密切关系[14],这为结肠癌的分子靶向治疗提供了理论依据。吉非替尼是EGFR酪氨酸激酶抑制剂,不断有研究提出,吉非替尼在抑制结肠癌的进程中起重要作用[15],也能与其他化疗药物起到协同作用[16],但是也有文章指出患者在接受治疗的一段时间之后逐渐出现对吉非替尼的抵抗性[17,18],而且临床Ⅰ/Ⅱ期研究发现吉非替尼对于晚期结肠癌患者治疗效果欠佳[14],也不能增加其他化疗药物的疗效[15],甚至过度用药会导致许多副作用,如中性粒细胞减少、腹泻、恶心和呕吐等,使得很多患者无法耐受以至于中断治疗。多种药物联合应用已经成为临床上常见的治疗晚期结肠癌患者的共识,如何能最大限度抑制肿瘤的基础上同时提高用药的安全性及减少药物副作用成为临床上的一大难点。而中药因其温和的药性得以广泛应用于临床,很多传统中药相继被报道有抑癌作用。苦参碱是从苦参中提取出来的主要成分,其性寒味苦,有清热解毒的作用,有报道指出苦参碱能调控肿瘤细胞的周期分布从而抑制肿瘤细胞增殖[16],或者能增加化疗药物的疗效,从而减少化疗药物的用量及药物毒副作用[17]。近年来,很多文献报道苦参碱在体内体外均可以抑制结肠癌的肿瘤进程,其机制主要涉及细胞周期阻滞、转移和侵袭能力抑制等[18]。也有报道苦参碱可以协同多种化疗药物如紫杉醇[19]、奥沙利铂[20]、雷替曲塞[21]等,但苦参碱联合吉非替尼在结肠癌的治疗中却无报道。

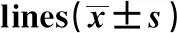

GroupGray value of proteinP-mTOR/GAPDHP-AMPK/GAPDHCtrl0.64±0.040.09±0.02MA0.37±0.041)0.21±0.011)GEF0.26±0.012)0.29±0.012)MA+GEF0.09±0.013)4)0.38±0.013)4)
Note:MA vs Ctrl,1)P<0.001;GEF vs Ctrl,2)P<0.001;MA+GEF vs GEF,3)P<0.01;MA+GEF vs MA,4)P<0.05.
本次研究发现,单用吉非替尼或者苦参碱均能在一定程度上抑制人结肠癌细胞系的增殖能力和克隆形成能力,但是二者联合应用则可以在更大程度上起到抑制作用,已有文献报道吉非替尼或者苦参碱的周期阻滞作用,我们的研究发现,二者联用后结肠癌细胞系发生显著的G0/G1期阻滞,导致肿瘤细胞的增殖受阻,这在克隆形成能力受阻中也可以得到验证,而相对于单用药物组,G0/G1期的周期蛋白Cyclin-D1的表达也在联用之后有更为显著的减少。此外,我们的研究发现,单用吉非替尼或者苦参碱可以一定程度抑制结肠癌细胞系的转移能力,但是二者联用后可以更大程度地抑制其转移能力;Vemintin和SNAIL的蛋白表达水平也在联用之后明显减少,意味着二者联用比单一用药可以更大程度减少结肠癌细胞中转移相关蛋白的表达,从而抑制癌细胞转移。吉非替尼或者苦参碱杀伤肿瘤细胞的作用主要包括诱导肿瘤细胞发生凋亡[8]。我们的研究发现,单用苦参碱或者吉非替尼确实能在一定程度上增加结肠癌细胞系的凋亡比例,但是二者联用后凋亡比例明显比单用药物组增加,相应的凋亡蛋白Caspase-3和Bax的表达也有明显增加,这提示我们,二药联用可能协同或者相加地抑制结肠癌的进程。中药苦参碱在临床治疗中副作用少,与吉非替尼联用可以减少吉非替尼的用药量,减少吉非替尼所致的肠道副作用,提高患者的生活质量。此外,研究中观察到单独用药组其P-AMPK的蛋白表达水平有一定程度的提高,二者联用之后,P-AMPK表达水平显著高于单药组,但其下游分子P-mTOR的蛋白表达水平则趋势相反,这意味着二药联用作用于结肠癌细胞之后可能激活P-AMPK通路,起到抑制结肠癌细胞的增殖、迁移能力,并诱导结肠癌细胞发生凋亡,最终达到抑制结肠癌进程的作用。
总而言之,苦参碱和吉非替尼联用可以显著抑制人结肠癌细胞系在体外的增殖和转移能力,并能诱导结肠癌细胞系发生凋亡,而起到抑制肿瘤进程的作用,此作用可能与药物联用之后激活AMPK信号通路有关。
