黄连解毒汤含药血清激活PPARγ诱导RAW264.7源性泡沫细胞向M2表型极化①
2020-02-20于红红赵立凤田维毅贵州中医药大学贵阳550002
盛 蒙 许 滔 于红红 赵立凤 俞 琦 田维毅 (贵州中医药大学,贵阳 550002)
动脉粥样硬化(atherosclerosis,AS)是动脉血管管壁的慢性炎症性疾病,动脉内脂质和纤维结缔组织积聚,伴有局部炎症反应;同时,也是心血管疾病的病理基础,可引起多种疾病,如冠心病,中风等[1]。随着心血管疾病的发病率逐年升高,死亡率也随之提高,AS防治问题显得至关重要。巨噬细胞作为一种固有免疫细胞,参与炎症反应的全过程,在AS形成的脂质期到发展为斑块,最后发展到斑块破裂,都有巨噬细胞的全程参与[2]。AS斑块中含有M1型和M2型两种表型巨噬细胞,M1型巨噬细胞在疾病的发展中表达多种促炎介质,比如:TNF-α、IL-1β、IL-6、IL-12等,起到促炎的作用;M2型在疾病的发展中主要分泌抗炎细胞因子,比如:转化生长因子β(TGF-β)、IL-1受体拮抗剂,并增加胶原的分泌,有利于维持斑块的稳定性,减少斑块破裂引发的心血管疾病[3]。而PPAR-γ活化在巨噬细胞极化的过程中发挥重要的作用,表现在调节巨噬细胞脂质代谢、抑制促炎基因和促进M2表型的转化[4]。
黄连解毒汤出自《外台秘要》,由黄连、黄柏、黄芩、栀子四味清热解毒类药物组成,具有清热解毒泻火之功效。现代药理研究发现黄连解毒汤具有抗炎、调脂、抗AS等药理作用,中药通过自身多靶点、多途径的优势防治AS[5]。黄连解毒汤是否能通过激活PPARγ,促进ox-LDL诱导的RAW264.7源性泡沫细胞向M2表型极化,成为一个新的防治AS的作用机制,值得探讨。
1 材料与方法
1.1材料
1.1.1动物及细胞 雄性SD大鼠30只,SPF级,体质量200~220 g,许可证号SCXK(湘)2014-0011,购于长沙天勤生物技术有限公司。动物实验由贵州医科大学伦理委员会批准进行,实验符合动物伦理委员会规定,伦理委员会编号NO1503018。RAW264.7巨噬细胞购于上海中乔新舟有限公司,干细胞库标号为ZQ 0098。
1.1.2药物及试剂 黄连解毒汤按《外台秘要》原方比例配伍(黄连9 g,黄柏6 g,黄芩6 g,栀子9 g),饮片购自北京同仁堂贵阳店,并经贵州中医药大学药学院王祥培教授鉴定为正品。按常规方法水煎煮制备水煎液,并将其加热浓缩至含生药量浓度为1 g/ml,4℃保存备用。DMEM培养液(美国Hyclone公司,批号LOT NO:319005121);胎牛血清(浙江天杭生物科技有限公司,批号:18050302);Accutase细胞消化液(美国eBioscience公司,批号00-4555)台盼蓝染色液(北京索莱宝科技有限公司Lot No:20151026);CCK-8检测试剂(东仁化学科技上海有限公司,批号Lot:NN710);小鼠IL-1β、IL-10 ELISA试剂盒[爱必信(上海)生物科技有限公司,批号分别为abs520001,abs520005];小鼠TNF-α、TGF-β ELISA试剂盒(伊莱瑞特,批号分别为 E-EL-M0049c,E-EL-0162c)。BCA蛋白定量试剂盒(江苏凯基生物技术股份有限公司 批号:20180629);抗体PPARγ、Arg-1(武汉三鹰生物技术有限公司,批号分别为:16001-1-AP,16643-1-AP);油红O染色试剂盒(北京索莱宝科技有限公司,货号:G1262);ox-LDL(Yiyuan Biotechnology Lot No:2019-04-10);IL-4(美国PeproTech公司 Lot:#021749);GW9662(MCE公司,Cat No:HY-16578);CD206抗体(英国Abcam 公司 LOT:GR322075-6)。
1.1.3仪器 CLASS100型CO2培养箱,MK3型酶标仪(美国Thermo公司),NU-440-400E生物安全柜(美国Nuair公司);3-18K型低温离心机(德国Sigma公司);Bio-Rad蛋白凝胶电泳仪、Bio-Rad凝胶成像系统(美国Bio-Rad公司);流式细胞仪(BD公司)。
1.2方法
1.2.1黄连解毒汤含药血清制备 取30只SD大鼠随机分为3组,分别为黄连解毒汤高、低剂量组及正常组。将大鼠适应性喂养3 d,参照大鼠与人等剂量换算公式,以标准质量/人的体重×6.3为标准,作为高剂量,稀释1倍为低剂量,黄连解毒汤高、低剂量分别按6.3、3.15 g/(kg·d)灌胃,给药体积为1 ml/100 g。正常组每天等剂量生理盐水灌胃,每天灌胃1次,连续7 d。末次给药2 h后股动脉取血,收集于离心管中,室温静置4 h,3 000 r/min离心10 min,制备各组血清,56℃水浴锅灭活补体,0.22 μm 微孔滤膜过滤,分装保存于-80℃备用。
1.2.2RAW264.7巨噬细胞的培养 将RAW264.7细胞复苏后,用含有10%的胎牛血清的DMEM高糖培养基培养,置于37℃ 5%CO2培养箱中恒温孵育。细胞聚合度达80%~90%用胰酶消化液按1∶3进行传代,取对数生长期的细胞用于后续实验。
1.2.3细胞分组及干预 将RAW264.7细胞随机分为6组,分别为正常血清组、模型组、黄连解毒汤高剂量组、黄连解毒汤低剂量组、黄连解毒汤高剂量含药血清+PPARγ抑制剂(GW9662)、黄连解毒汤低剂量含药血清+PPARγ抑制剂(GW9662)。除正常组外,其余各组均用ox-LDL建立泡沫细胞模型。当RAW264.7细胞汇合度达到80%左右时,在每孔中加入80 mg/L的ox-LDL于培养箱中孵育3 h,光学显微镜下观察细胞形态。
1.2.4油红O染色鉴定泡沫细胞 用10%胎牛血清的DMEM完全培养基调整细胞浓度为5×105个/ml,种于24孔板中,每孔500 μl细胞悬液,实验分为3组,即3 h、12 h造模后泡沫细胞组,正常组,置于37℃、5%CO2恒温箱中分别孵育3 h、12 h。取出后,PBS冲洗3次,加入固定液固定30 min;清洗2次后,60%异丙醇浸洗5 min;加入配置好的染色液,浸染15 min,水洗2~5次;加入苏木素染液,复染核1~2 min,洗去染料;在光学显微镜下观察细胞泡沫化程度并拍照。
1.2.5CCK-8检测泡沫细胞增殖情况 取生长至满足条件的细胞(聚合度到80%),胰蛋白酶消化并离心后,用含10%胎牛血清的DMEM培养基调整细胞浓度为8×103个/ml,按照正常血清组、黄连解毒汤含药血清高剂量组分别加入5%、10%、20%、30%、40%、50%质量分数的正常血清和含药血清于96孔板中,每孔100 μl细胞悬液,全部加样均设6个复孔。置于5%CO2培养箱中孵育24 h后,每孔加入10 μl CCK-8试剂,用酶标仪检测450 nm光密度值时各组吸光度A。
1.2.6流式细胞术检测CD206阳性细胞数量 实验分组参照1.2.3,细胞用胰酶消化液消化后,预冷的PBS冲洗3次,调整细胞至1×106个/100 μl于Ep管中。加入CD206抗体,4℃避光孵育30 min,1 ml PBS冲洗1次流式细胞仪检测,以Flowjo分析结果。
1.2.7ELISA法检测细胞上清液中IL-1β、TNF-α、IL-10、TGF-β的含量 将各组RAW264.7细胞以6×106个/ml密度接种于96孔板中,每孔加入100 μl细胞悬液,泡沫细胞诱导模型成功后,正常组及模型组按20%浓度正常血清孵育24 h;黄连解毒汤高、低、高+GW9662、低+GW9662剂量组分别加入含药血清孵育24 h。收集各组细胞上清,备测。按照ELISA试剂盒说明书操作,检测细胞上清中IL-1β、TNF-α、IL-10、TGF-β各自的表达。
1.2.8蛋白免疫印迹法(Western blot)检测PPARγ、Arg-1蛋白的表达 按照1.2.3的细胞培养方法,24 h后分别收集各组细胞,在细胞沉淀中加入含1%PMSF的细胞裂解液裂解细胞蛋白,收集上清,取4 μl稀释后样品用BCA蛋白定量法测定蛋白浓度,得出标准品和样品吸光值,绘制标准曲线,计算蛋白样品原浓度,配平后加入上样缓冲液,100℃灭活10 min,并放置于-80℃保存备用。SDS-PAGE凝胶进行电泳,分离后将胶上的蛋白转至PVDF膜上。5%脱脂奶粉封闭液室温封闭1 h,加入目的蛋白对应的特异性抗体β-actin(1∶500),PPARγ(1∶1 000),Arg-1(1∶1 000),4℃过夜,摇床洗膜5 min/次,共3次,加入相应的二抗(1∶5 000)室温避光孵育 1 h。洗涤后,配置化学发光液,显影,曝光采图保存,Image J软件分析目的蛋白条带的灰度值。

2 结果
2.1油红O染色鉴定泡沫细胞 未经ox-LDL诱导的RAW264.7巨噬细胞内无明显标记红色脂滴的泡沫细胞;经ox-LDL诱导3 h的巨噬细胞细胞质内可见部分红色脂滴泡沫细胞;经ox-LDL诱导12 h后,细胞质内可见明显红色脂滴呈现泡沫细胞形态。见图1。
2.2对RAW264.7源性泡沫细胞增殖的影响 正常血清组随血清浓度的增加未出现明显差异。与正常血清组比较,黄连解毒汤含药血清高剂量组在浓度5%、10%、20%、30%时,其泡沫细胞增殖差异无统计学意义(表1,P<0.05)。根据实验结果,可以选择30%浓度以下的含药血清进行后续实验,文献常用含药血清浓度为20%,因此,后续实验均采用20%的血清浓度,完成相关指标检测。
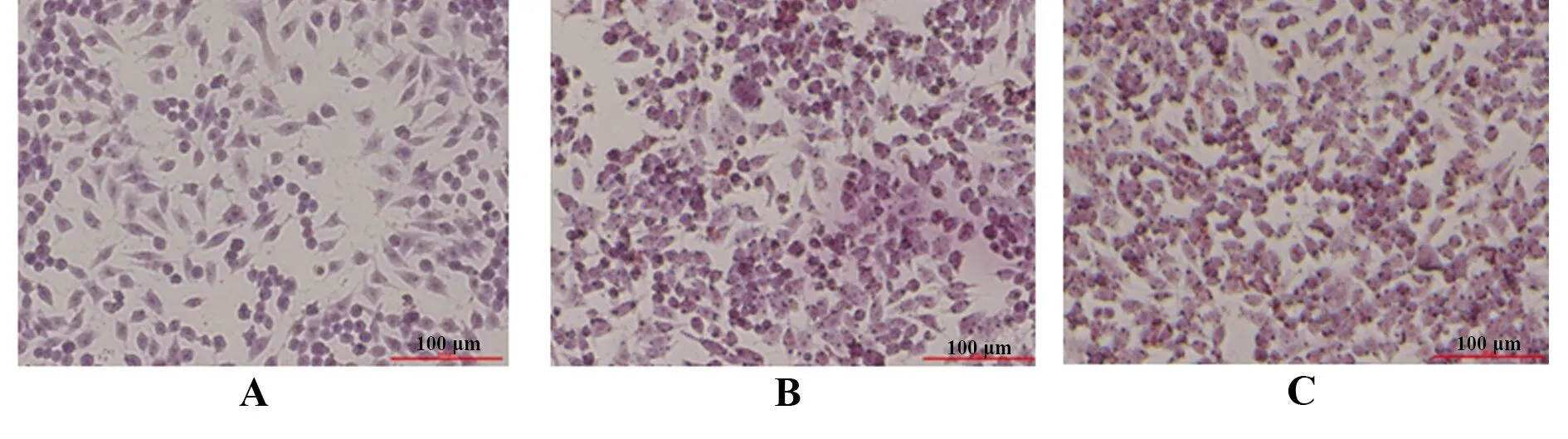
图1 RAW264.7巨噬细胞和泡沫细胞形态(油红O,×200)
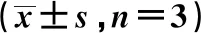
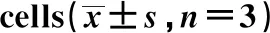

GroupsDose(g/kg)5%10%20%30%40%50%Normal-0.83±0.460.83±0.460.78±0.890.82±0.200.79±0.050.76±0.04HLJDT6.31.68±0.091.68±0.091.61±0.071.69±0.031.3±0.041)1.27±0.111)
Note:Compared with the normal group,1)P<0.05;HLJDT.Huanglianjiedu Decoction.
2.3对CD206阳性细胞的数量的诱导 流式细胞术检测结果显示:用IL-4诱导RAW264.7巨噬细胞,作为对照组;与模型组相比,黄连解毒汤含药血清高、低剂量组干预后能使CD206阳性细胞数量增高。见图2、3。
2.4对泡沫细胞IL-1β、TNF-α、IL-10、TGF-β含量的影响 与正常组比较,模型组用ox-LDL诱导RAW264.7源性泡沫细胞后IL-1β、TNF-α的表达水平显著升高(P<0.01);IL-10、TGF-β的表达水平显著下降(P<0.01)。与模型组比较,黄连解毒汤含药血清高、低剂量组干预后能使IL-1β、TNF-α的表达下调(P<0.05,P<0.01);IL-10、TGF-β的表达增强(P<0.05,P<0.01)。见表2。
2.5对泡沫细胞PPARγ、Arg-1蛋白表达的影响 与正常组相比,模型组用ox-LDL刺激RAW264.7巨噬细胞后, PPARγ、 Arg- 1的蛋白表达水平显著下降(P<0.01);与模型组相比,黄连解毒汤各剂量含药血清干预后能明显升高PPARγ、Arg-1的蛋白表达水平(P<0.05,P<0.01)。见图4,表3。
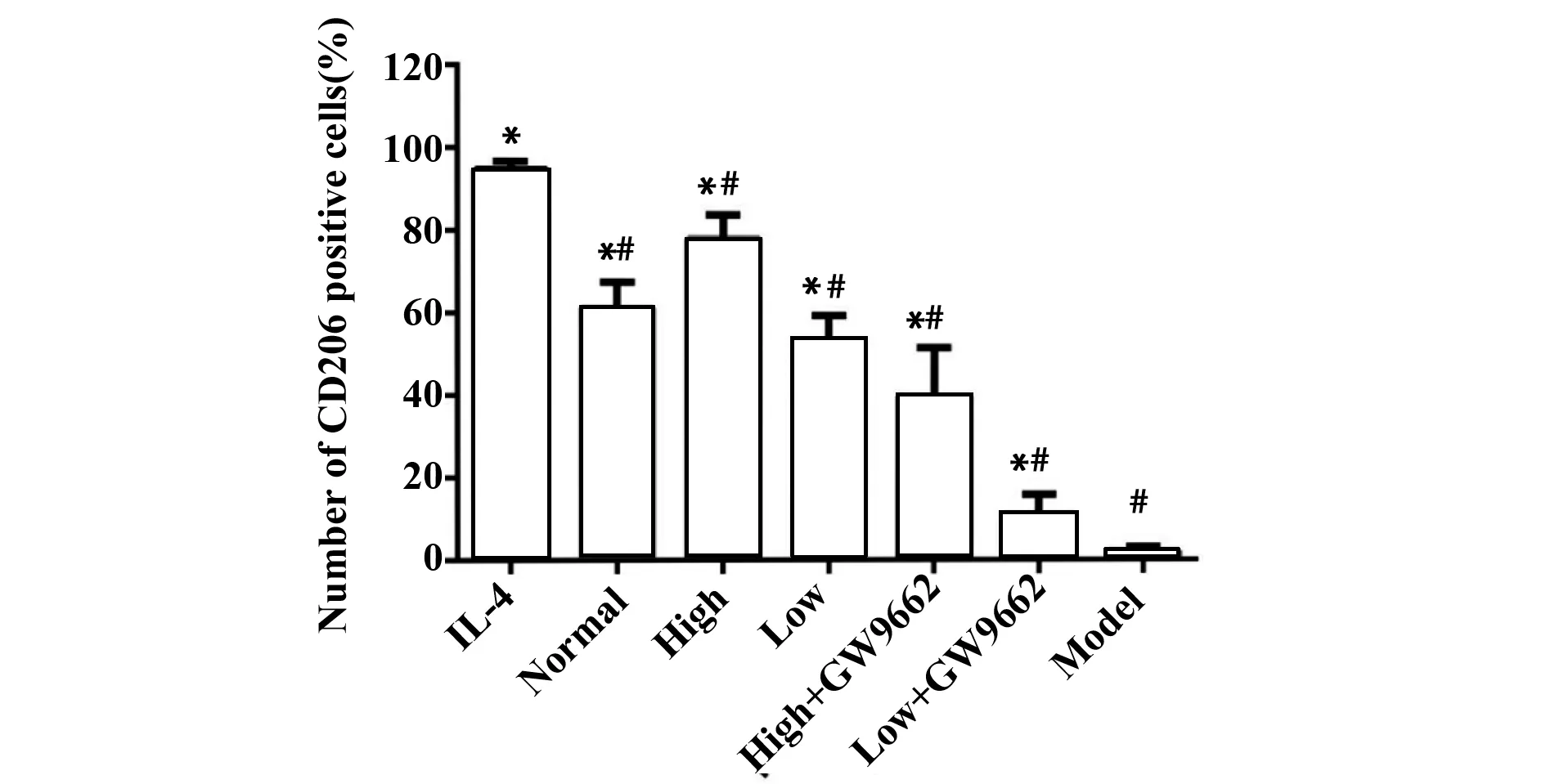
图3 不同浓度黄连解毒汤含药血清对CD206阳性细胞数量的影响
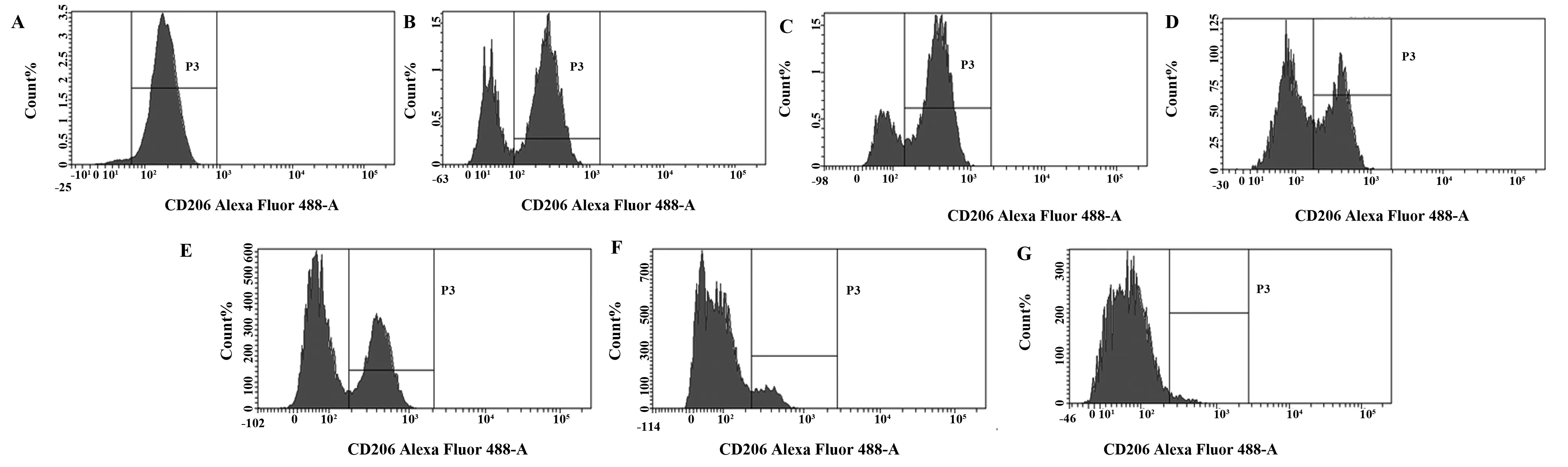
图2 不同浓度黄连解毒汤含药血清对CD206阳性细胞数量的流式细胞图
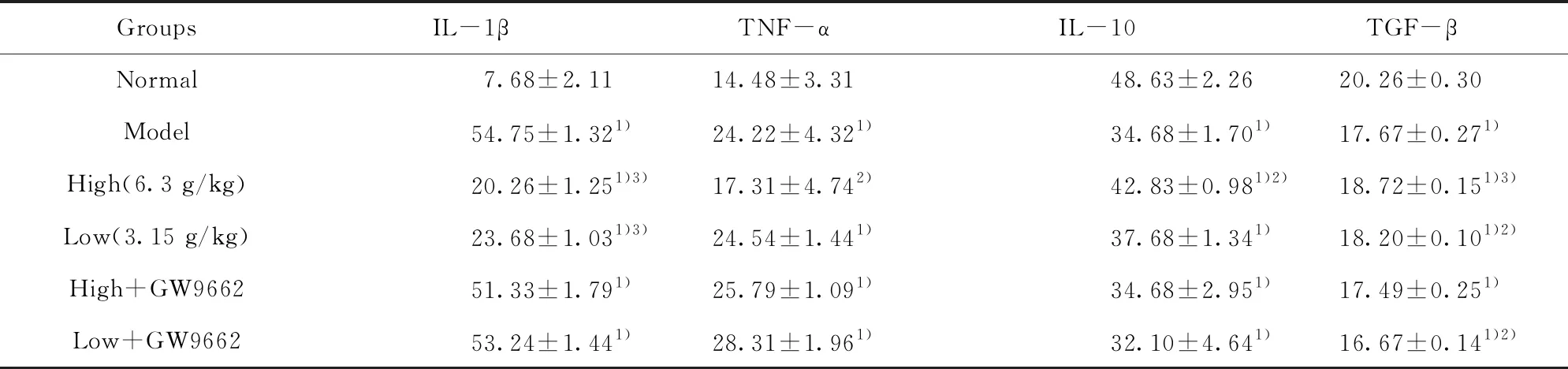
GroupsIL-1βTNF-αIL-10TGF-βNormal7.68±2.1114.48±3.3148.63±2.2620.26±0.30Model54.75±1.321)24.22±4.321)34.68±1.701)17.67±0.271)High(6.3 g/kg)20.26±1.251)3)17.31±4.742)42.83±0.981)2)18.72±0.151)3)Low(3.15 g/kg)23.68±1.031)3)24.54±1.441)37.68±1.341)18.20±0.101)2)High+GW966251.33±1.791)25.79±1.091)34.68±2.951)17.49±0.251)Low+GW966253.24±1.441)28.31±1.961)32.10±4.641)16.67±0.141)2)
Note:Compared with the normal group,1)P<0.01;compared with the model group,2)P<0.05,3)P<0.01.
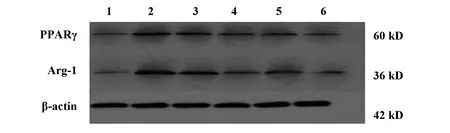
图4 泡沫细胞PPARγ、Arg-1蛋白表达电泳
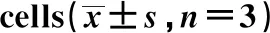
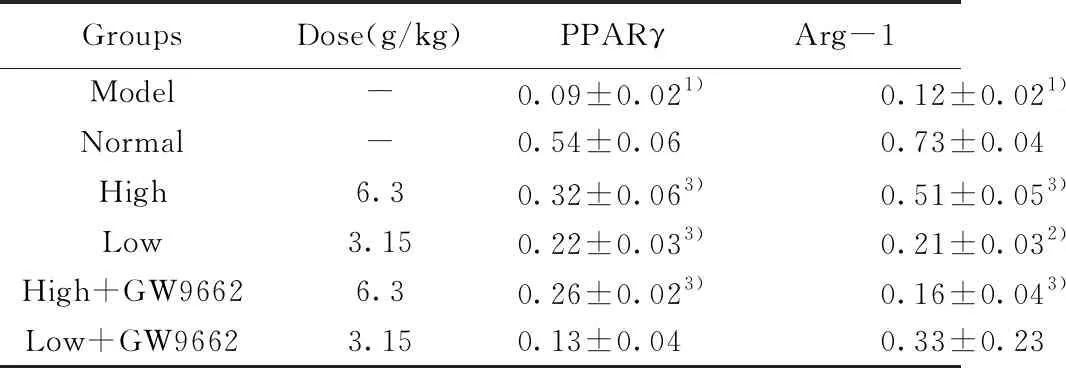
GroupsDose(g/kg)PPARγArg-1Model-0.09±0.021)0.12±0.021)Normal-0.54±0.060.73±0.04High6.30.32±0.063)0.51±0.053)Low3.150.22±0.033)0.21±0.032)High+GW96626.30.26±0.023)0.16±0.043)Low+GW96623.150.13±0.040.33±0.23
Note:Compared with the normal group,1)P<0.01;compared with the model group,2)P<0.05,3)P<0.01.
3 讨论
在AS的形成与发展的过程中,低密度脂蛋白进入动脉血管壁之间,完成胆固醇堆积,使得血管内膜的内皮细胞分泌激素促进单核细胞分化为巨噬细胞吞噬胆固醇及脂肪,产生泡沫细胞。巨噬细胞参与了AS发展的全过程。因此,炎症与动脉粥样硬化之前存在一定的联系,控制炎症有助于靶向治疗动脉粥样硬化[6]。PPARs是一种脂质活化的转录因子,它能够调节脂质和脂蛋白代谢[7]。作为它的亚型,PPAR-γ可通过抑制活化单核细胞产生的炎症因子TNF-α、IL-6等,减少单核细胞趋化蛋白的转录,从而减少单核细胞的聚集,有利于抑制AS的炎症反应。其中包括抑制TNF-α表达,抑制TNF-α诱导的VCAM-1和MCP-1的表达[8]。
相关研究发现,在AS的斑块形成中巨噬细胞存在两种表型,分别为M1型、M2型。M1型巨噬细胞在疾病的发展中表达多种促炎介质,不利于斑块的稳定,而M2型巨噬细胞在疾病的发展中主要分泌抗炎细胞因子,在斑块的稳定区域和未病变的区域表达丰富[9]。而PPARγ在调节巨噬细胞脂质代谢、抑制促炎基因和促进M2型巨噬细胞的极化起到重要的作用。实验结果证明,PPARγ被抑制可能对M2型巨噬细胞的极化产生负面影响,PPARγ的表达或者活性激活为巨噬细胞调节炎性的细胞因子提供了一种有效的手段[10]。
本研究结果表明,黄连解毒汤能抑制ox-LDL诱导的巨噬细胞源性泡沫细胞的炎症因子IL-1β、TNF-α的表达,并能上调含药血清各组剂量IL-10、TGF-β的表达。结合相关文献,黄连解毒汤可以抑制ox-LDL诱导的巨噬细胞源性泡沫细胞IL-1β的表达[11,12]。IL-1β、TNF-α均是M1表型巨噬细胞的标志物,说明黄连解毒汤能够抑制炎症,而CD206、Arg-1、IL-10、TGF-β均是M2表型巨噬细胞的标志物[13],在采用黄连解毒含药血清干预后,均能上调表达,PPARγ的表达量上调;黄连解毒汤含药血清中加入抑制剂GW9662后,CD206、Arg-1、IL-10、TGF-β、PPARγ表达量都较单纯的含药血清组下降,说明黄连解毒汤能够通过活化PPARγ来促进巨噬细胞向M2表型转化。
综上所述,巨噬细胞具有异质性,在体内可能因为复杂的微环境而表现出独特的表型与功能。而我们可以通过中药的调控,改善人体的微环境,通过黄连解毒汤活化PPARγ这个关键蛋白,使得巨噬细胞向M2表型分化而发挥抗炎的作用,减轻M1表型巨噬细胞的致炎反应[14,15]。本研究证明黄连解毒汤可通过活化PPARγ促进ox-LDL诱导的RAW264.7源性泡沫细胞向M2表型极化,为黄连解毒汤的抗AS机制研究在细胞水平上提供新的理论依据;为通过中药作用于PPARγ诱导巨噬细胞极化发挥抗炎作用,找出基于PPARγ防治AS的机制,可能会成为治疗AS的新靶点。