参苓白术散通过TLR4/NF-κB 通路对溃疡性结肠炎小鼠的抑制作用研究①
2020-02-20葛雨竹李姿慧颜贵明马克龙汪天明汪长中
孙 娟 葛雨竹 李姿慧 颜贵明 马克龙 邵 菁 汪天明 汪长中
(安徽中医药大学,合肥 230012)
溃疡性结肠炎(ulcerative colitis,UC) 是发生在结肠黏膜以及黏膜下层的一种慢性炎症性肠病,临床上以体重减轻、腹痛、腹泻和黏液脓血便为主要症状或体征,少数患者在UC基础上还可能进一步发生恶性变。UC病因复杂,一般认为与感染、环境暴露、遗传等多因素相关,但无论何种病因,发病机制均涉及免疫调节失常[1]。近年来,肠道菌群紊乱在UC致病过程中的作用受到高度关注[2]。肠道具有丰富的微生态,细菌表面相关分子模式(pathogen associated molecular patterns,PAMPs)与肠组织免疫细胞的TLRs等模式识别受体(PRR)相互作用,通过一定的信号转导,激活炎症因子表达,导致肠组织免疫炎症性损伤。TLR4是TLRs家族中的重要成员,通过识别相应的PAMP,激活转录因子NF-κB,引发下游TNF-α等炎症因子的大量释放,造成肠组织损伤。鉴于TLR4/NF-κB通路的异常活化是导致UC肠组织持续炎症的重要诱因,故该通路被认为是治疗UC的重要靶标[3,4]。
UC在中医上属于“痢疾”、“泄泻”、“腹痛”等范畴,其病机涉及脾气虚弱、运化失调,故治法常采用健脾益气、渗湿止泻。参苓白术散出自《太平惠民合剂局方》,由人参、茯苓、白术、山药、莲子肉、薏苡仁、 白扁豆、砂仁、桔梗、甘草十味中药组成,主治脾虚证。大量临床实践表明,参苓白术散治疗UC疗效显著,但其作用机制尚不清楚[5,6]。本研究拟从TLR4/NF-κB通路角度探讨参苓白术散治疗UC的作用机制。
1 材料与方法
1.1材料
1.1.1实验动物 SPF 级雄性健康昆明种小鼠,体质量(34±2)g,由常州卡文斯实验动物有限公司提供,生产许可证号:SCXK(苏)2016-0010。
1.1.2药品与试剂 参苓白术散购于山西华康药业股份有限公司,国药准字 Z14020346;美沙拉嗪购于上海爱的发制药有限公司,国药准字H20143164;DSS(美国MP Biomedicals公司,批号S0433);苏木素-伊红(HE)染色试剂盒(北京Leagene生物科技有限公司,编号DH0006);大便隐血检测试剂盒(安徽深蓝医疗科技股份有限公司,批号皖20152400174);小鼠 TNF-α、IL-10、MIF、EGF 定量酶联免疫吸附试剂测定(ELISA)试剂盒(泉州市睿信生物科技有限公司,批号06/2019);免疫组化试剂盒SABC即用型、DAB显色试剂盒(博士德生物科技有限公司,批号分别是14E14L24C2722、14A18B22);NF-κB、TLR4抗体(博士德生物科技有限公司,批号26j7543、16c5074)。
1.1.3仪器 BX51显微镜(日本奥林巴斯公司),H1-16KR型冷冻离心机(湖南可成仪器设备有限公司),Thermo Labserv K3型酶标仪(上海沃元科技有限公司),YD-6L生物组织冷冻包埋机、YD-315轮转式切片机、YD-AB摊烤片机(金华市益迪医疗设备有限公司)。
1.2方法
1.2.1分组及给药[6]60只小鼠随机分为空白组、模型组、美沙拉嗪组、参苓白术散低、中、高剂量组,每组10 只。除正常组外,小鼠饮用3%葡聚糖硫酸钠(DSS)溶液1周造成UC模型。造模成功后按体表面积法,参苓白术散高、中、低剂量组给予剂量分别是31.2、15.6、7.8 g/kg,空白组和模型组小鼠按 20 ml/kg给予生理盐水;美沙拉嗪组按0.40 g/kg 给予美沙拉嗪片剂水溶液;灌胃1次/d,共14 d。动物饲养期间自由饮食及饮水。
1.2.2标本采集 禁食24 h的小鼠经3.5% 水合氯醛麻醉后眼球取血,采血后处死动物并取整段结肠测量长度。在结肠病变处截取1~2 cm 投入4%多聚甲醛溶液固定,剩余结肠组织冻存管分装,-80℃冰箱保存。
1.2.3指标检测
1.2.3.1小鼠一般情况及DAI评分[6]治疗周期结束后,观察各组小鼠精神状态、活动、毛色光泽、腹泻、黏液便、血便等一般情况;对小鼠进行 DAI 评分,包括体质量、大便性状、隐血情况(隐血便试纸法),评分标准由体质量下降分数、大便性状分数、便血分数三部分组成,计算公式: DAI=(体质量下降分数+大便性状分数+便血分数)/3。
1.2.3.2结肠长度、质量 取材时准确测量结肠自然长度及称量质量。
1.2.3.3结肠组织病理学观察 结肠组织由多聚甲醛固定后酒精梯度脱水,二甲苯透明,石蜡包埋,包埋后中性树脂封片,在切片机上切成 4 μm厚度组织片,进行 HE 染色,光学显微镜下观察小鼠结肠形态和病理损伤。
1.2.3.4ELISA法检测血清中TNF-α、MIF、IL-10、EGF含量 取血后室温静置1 h,再于离心机上3 000 r/min离心10 min,取上清液。严格按照 ELISA 试剂盒说明书检测TNF-α、MIF、IL-10、EGF 水平。于酶标仪450 nm 波长下测定 OD值,计算样品浓度。
1.2.3.5免疫组化法观察结肠病理组织中NF-κB和TLR4的表达 取制好的蜡块,切4 μm厚的石蜡切片。切片常规脱蜡,梯度75%乙醇水化,PBS水洗后滴加内源性过氧化物酶阻断剂,柠檬酸盐缓冲液抗原热修复后,自然冷却,滴加5% 封闭液封闭20 min。每张切片滴加一抗NF-κB或TLR4,4℃孵育过夜,PBS缓冲液冲洗后滴加生物素化羊抗兔 IgG,37℃孵育30 min,PBS 缓冲液冲洗后滴加试剂SABC,37℃孵育30 min,PBS缓冲液冲洗。室温DAB显色,脱水,透明,中性树胶封片。显微镜观察结肠组织中 NF-κB 和 TLR4 的表达情况,并用 Image J软件计算平均光密度。

2 结果
2.1参苓白术散对UC小鼠一般情况及DAI评分的影响 与空白组相比,模型组小鼠出现活动减少、反应迟钝、竖毛、毛色失去光泽、大便稀、有血便及黏液便、大便潜血为阳性,体质量减轻。见图1。参苓白术散低、中、高剂量组小鼠的上述症状较模型组有不同程度减轻。与空白组相比,模型组小鼠DAI评分显著升高(P<0.01);给药第一周与模型组比较,各给药组均有不同程度减轻,DAI评分降低但无统计学差异;给药第二周与模型组比较,参苓白术散剂量中剂量组与美沙拉嗪组有统计学差异(P<0.05)。DAI 评分结果见表1 。
2.2参苓白术散对UC小鼠结肠长度和重量的影响 与空白组比较,模型组小鼠的结肠长度整体上缩短显著且单位结肠重量明显增高(P<0.01)。与模型组比较,参苓白术散低、中、高剂量组小鼠结肠长度改善趋势显著(P<0.01),单位结肠重量上,除低剂量组无明显差异,余下各组降低显著(P<0.01)。见图2。
2.3参苓白术散对UC小鼠结肠组织病理学的影响 与空白组比较,模型组结肠黏膜炎性细胞浸润明显,腺体排列损伤严重,层次不清,隐窝结构异常,不同程度出现隐窝分支及扭曲,隐窝数量减少,更有黏膜表面不平,杯状细胞减少; 参苓白术散低、中剂量治疗后,UC小鼠结肠黏膜病变有一定程度的改善,高剂量治疗和美沙拉嗪治疗后小鼠结肠黏膜病变改善更加明显。见图3。
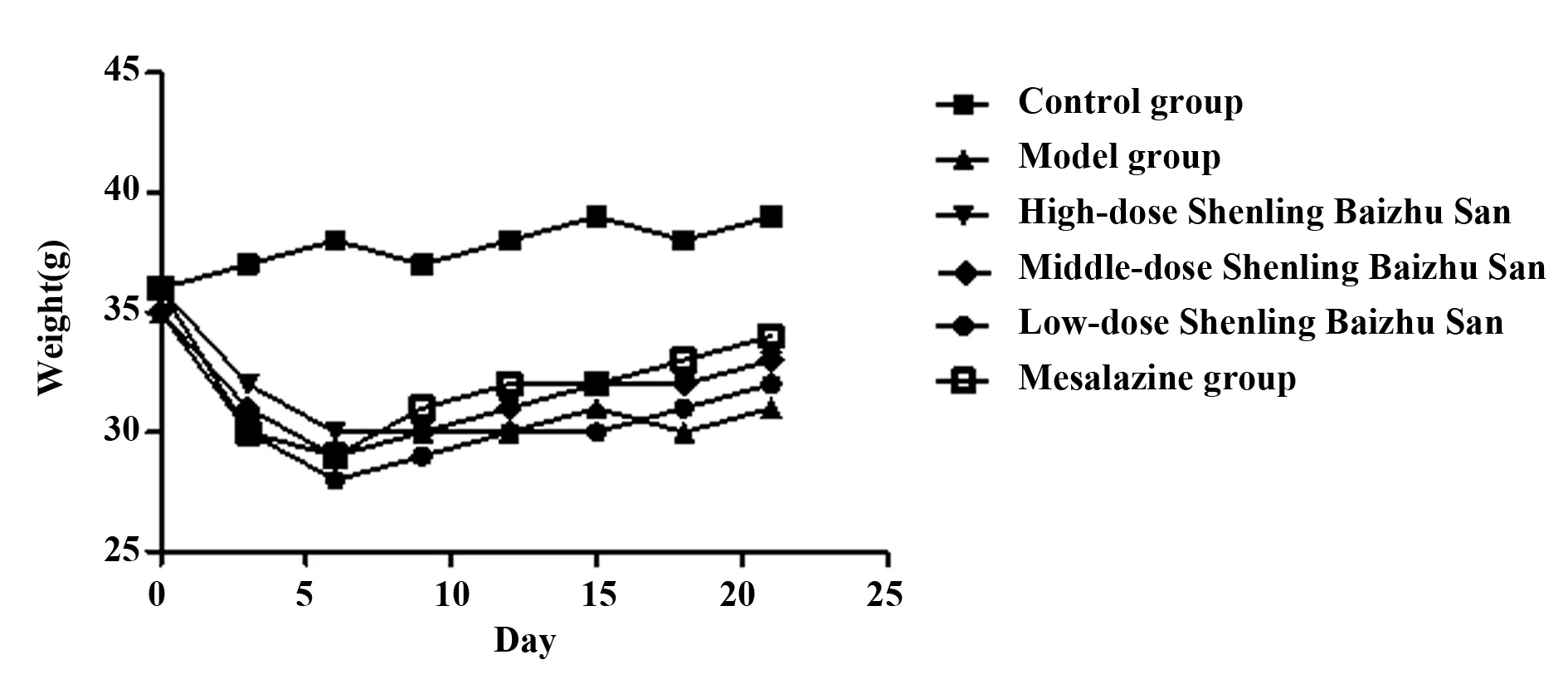
图1 各组小鼠体重变化
2.4参苓白术散对UC小鼠血清内 TNF-α、MIF、IL-10、EGF含量的影响 与空白组比较,模型组小鼠血清内TNF-α、MIF含量显著升高(P<0.01)。与模型组比较,参苓白术散中、高剂量组及美沙拉嗪组小鼠血清TNF-α 含量显著降低(P<0.01),其中参苓白术散低剂量组含量明显下降,参苓白术散低、中、高剂量组及美沙拉嗪组小鼠血清内MIF含量显著降低(P<0.01);与空白组比较,模型组小鼠血清内IL-10、EGF含量降低显著(P<0.01),与模型组比较,参苓白术散中、高剂量组及美沙拉嗪组小鼠血清IL-10含量上升显著(P<0.01),参苓白术散低、中、高剂量组及美沙拉嗪组小鼠血清EGF含量上升显著(P<0.01)。见图4 。
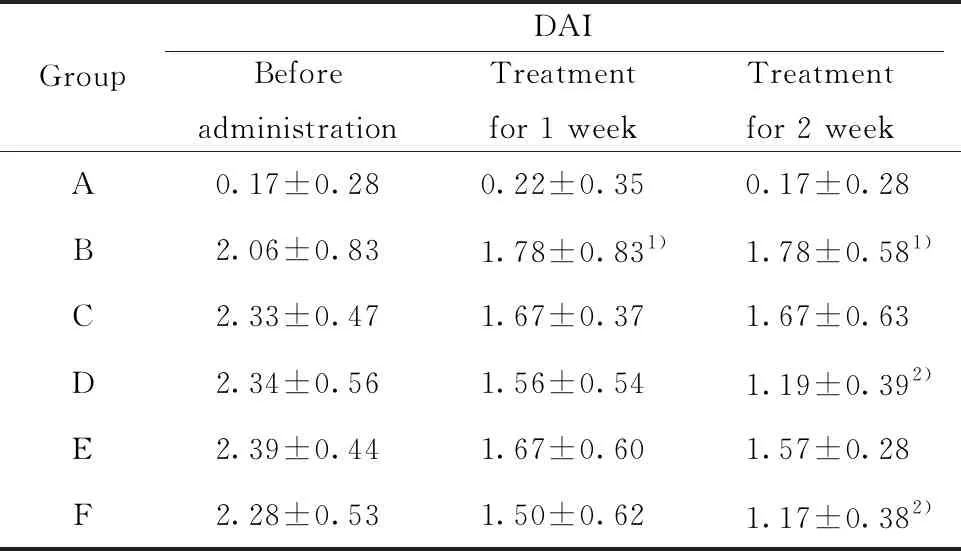
GroupDAIBeforeadministrationTreatmentfor 1 weekTreatmentfor 2 weekA0.17±0.280.22±0.350.17±0.28B2.06±0.831.78±0.831)1.78±0.581)C2.33±0.471.67±0.371.67±0.63D2.34±0.561.56±0.541.19±0.392)E2.39±0.441.67±0.601.57±0.28F2.28±0.531.50±0.621.17±0.382)
Note:A.Control group;B.Model group;C.High-dose Shenling Baizhu San;D.Middle-dose Shenling Baizhu San;E.Low-dose Shenling Baizhu San;F.Mesalazine group.Compared with the control group,1)P<0.01;compared with the model group,2)P<0.05.
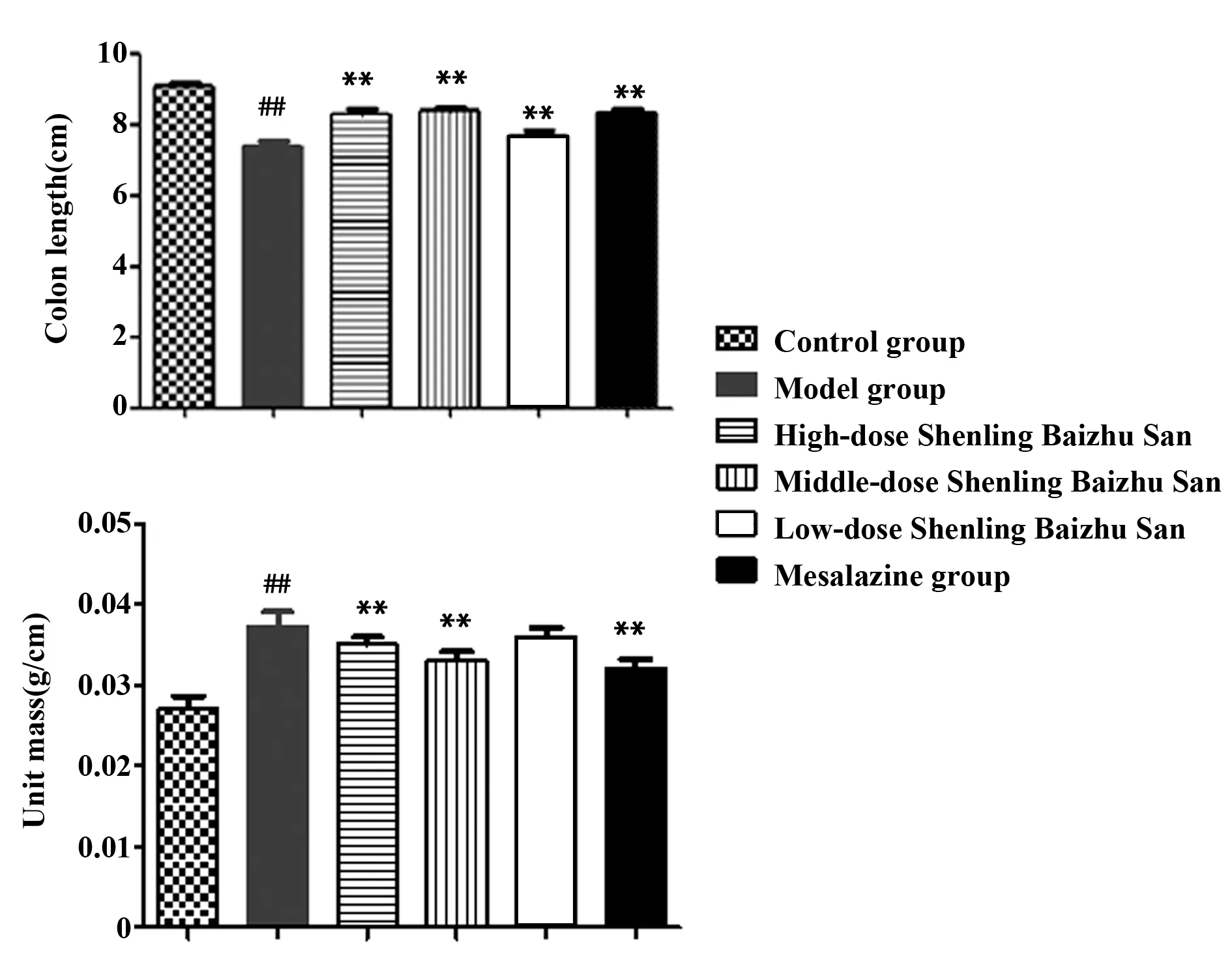
图2 各组小鼠结肠单位长度与重量
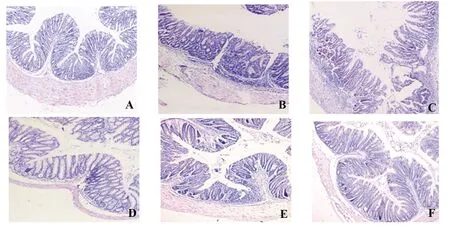
图3 各组小鼠结肠组织学变化(HE,×100)
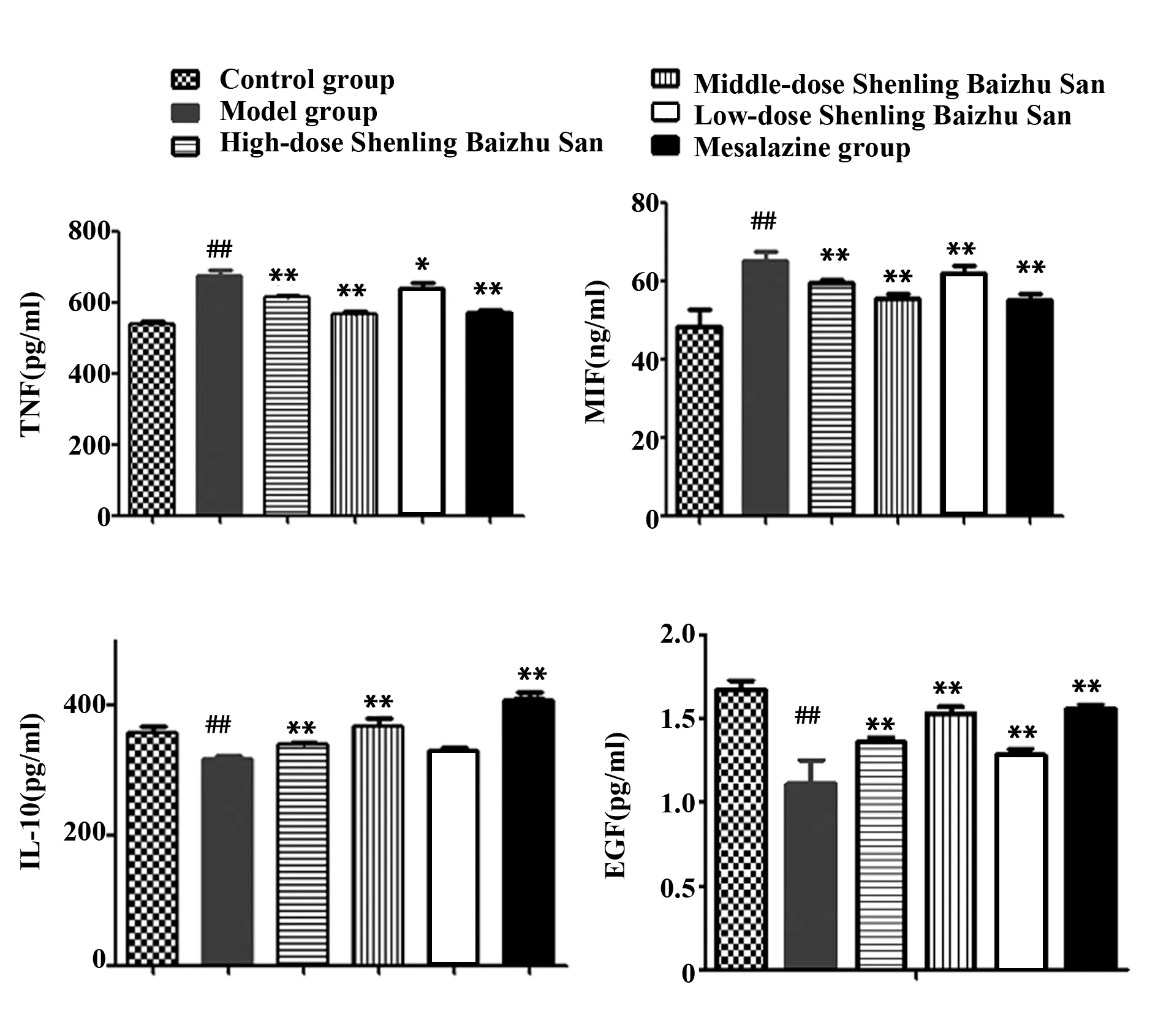
图4 各组小鼠血清中TNF-α、MIF、IL-10、EGF的水平
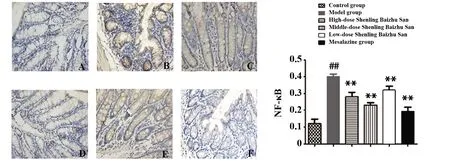
图5 各组小鼠结肠NF-κB表达(DAB,×400)
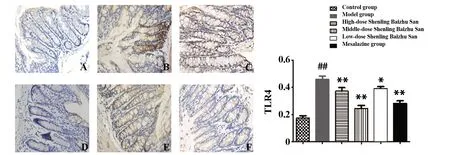
图6 各组小鼠结肠TLR4表达(DAB,×400)
2.5参苓白术散对UC小鼠结肠组织中NF-κB和TLR4表达的影响 与空白组相比,模型组胞质胞核可见棕黄色和褐色颗粒均有增加;与模型组相比,美沙拉嗪组和参苓白术散低、中、高剂量组胞质胞核内棕黄色和褐色颗粒均有明显减少;与模型组相比,美沙拉嗪组和参苓白术散低、中、高剂量组 NF-κB 表达明显减少(P<0.01);与模型组相比,美沙拉嗪组和参苓白术散中、高剂量组 TLR4 表达显著减少(P<0.01),参苓白术散低剂量组TLR4表达下调(P<0.05)。见图5、6。
3 讨论
溃疡性结肠炎(UC)在欧美发达地区发病率较高,在我国近年来发病率也呈逐年上升趋势。据报道,我国UC的患病率为11.6/10万[7]。目前,临床上治疗UC的药物较多,但均表现出明显的毒副作用,如5-氨基水杨酸可引起恶心、呕吐、再生障碍性贫血、轻度急性胰腺炎等,糖皮质激素可诱发股骨头坏死、骨质疏松、感染等,免疫抑制剂具有肝毒性、胃肠道毒性、血小板数量下降、诱发肿瘤等,新型生物制剂(英夫利西单克隆抗体等)可导致药物过敏、并发感染等[8]。而中药通过其对机体的综合调节,尤其是对免疫系统的调节作用,在治疗UC中发挥出独特的优势。
正常情况下,肠道微生态对机体发挥多种重要的生理调节作用,其中来自菌体的抗原对广泛分布于肠道的免疫细胞有一定的刺激作用,使后者产生一定种类和数量的细胞因子,包括促炎因子和抗炎因子,两类因子保持着动态平衡对于维持肠道甚至全身的稳态起着重要作用。 大量证据表明,UC 发病过程中,出现细胞因子平衡被打破的现象,通过调节使平衡恢复,将会使UC缓解或痊愈,因此,纠正失衡的细胞因子被认为是治疗UC的重要手段[9]。
由肠黏膜固有层单核细胞产生的肿瘤坏死因子(tumor necrosis factor,TNF)在UC患者以及UC模型小鼠中含量均显著升高。TNF通过结合相应的受体TNFR1和TNFR2,激活胞内NF-κB,诱导更多细胞因子的产生[10]。抗 TNF-α单抗(英夫利昔)于2005年经美国食品药品监督管理局(FDA)批准进入临床治疗溃疡性结肠炎,即充分显示了良好的临床有效性。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)由巨噬细胞及T细胞分泌,能够抑制巨噬细胞游走,促进巨噬细胞在炎症部位聚集,并进一步激活其他细胞因子的分泌,同时还能促进TLR4的表达[11]。研究发现,中药单体黄芩苷(Baicalin)能缓解大鼠UC,与其抑制MIF表达、下调巨噬细胞数量以及巨噬细胞相关细胞因子MCP-1、MIP-3α有关[12]。鉴于TNF与MIF在致UC过程中发挥重要作用,因此阻断TNF或MIF能改善UC患者或UC动物模型的症状,因此,TNF或MIF被认为是治疗UC的重要靶标。
IL-10是一种多源性细胞因子,在肠道主要由T细胞、B细胞和巨噬细胞等分泌,对TNF-α、IL-6和IL-1等其他促炎因子有抑制作用,是一种具有重要免疫调节功能的抗炎细胞因子。全基因组关联研究(GWAS)显示,IL-10或IL-10R等位基因突变与UC发生存在很强关联,提示IL-10在抗UC中的重要作用[13]。表皮生长因子(epidermal growth factor,EGF)可通过刺激细胞代谢和增生有助于溃疡部位损伤的修复,也是抗UC的重要因子[14]。
本实验结果显示,一定剂量的参苓白术散治疗能明显改善UC小鼠的精神状态、体质量、DAI评分及结肠组织学病变,抑制促炎因子TNF-α和MIF表达,同时上调抗炎因子IL-10与EGF的表达,表明参苓白术散可以通过纠正上述细胞因子失衡而发挥治疗UC的作用。
TLR4是TLRs家族中的重要成员,通过识别相应的PAMP,激活转录因子NF-κB。NF-κB被激活后,调控一系列免疫炎症反应相关的基因转录。研究表明,UC时NF-κB高度活化,并引发相关炎症因子的表达异常,导致促炎因子/抗炎因子平衡失调,从而引起肠道黏膜免疫炎症性损伤[15]。TLR4在正常人体肠道黏膜中少量表达,但在 UC 患者或UC模型小鼠的肠黏膜中往往大量表达[16]。本实验结果表明,在参苓白术散的干预下,TLR4与NF-κB出现明显的下调。因此,我们推测参苓白术散对上述细胞因子失衡的纠正可能与调整TLR4/NF-κB信号通路有关。
参苓白术散是复方中药,成分复杂,其确切的抗UC组分及详细的作用机制尚有待于进一步研究,这些问题的阐明将为其开发成为潜在的抗UC药物奠定坚实的基础。
