玻璃化法冻存组织样本的研究进展
2020-02-20彭宏威张姗姗周宗宁许紫琳钱开宇
彭宏威,张姗姗,周宗宁,陈 文,许紫琳,陈 杭,邹 聪,李 刚,胡 莹,钱开宇
生物样本尤其是组织样本在研究各类疾病中起着重要作用,随着精准医学的发展,组织样本的重要性更加凸显。为此,生物样本库的建设获得空前重视,组织样本低温冻存技术成为研究热点[1]。离体后的组织经过冻存后,其组织细胞能否依然保持良好的活性及功能,这对疾病的基础、临床和转化医学研究均具有重要的意义[2]。目前,组织的冻存主要有程序化法和玻璃化法2种方法。程序化法冻存存在耗时长、产生胞内冰晶和依赖仪器设备等明显的缺点;玻璃化法可以有效地避免冰晶的形成且操作简单,同时具有更佳的冻存效果,成为近年来冻存研究的热点[3]。
玻璃化法冻存是Rall和Fahy[4]在1985年首次使用的,他们采用混合多元保护剂的玻璃化溶液成功冻存了小鼠胚胎,此后这种方法被广泛应用到多种生物样本的冻存中[5]。由于组织由多种细胞构成,影响其玻璃化法冻存效果的因素更多,目前尚未形成统一规范的方法。作者对玻璃化法冻存原理、致细胞损伤机制、玻璃化法冻存效果的影响因素及其评价指标等进行综述,以期为玻璃化法冻存组织样本的标准化及后续研究提供参考。
1 玻璃化法冻存原理
玻璃化法冻存是组织在冻存过程中细胞内外的溶液直接变成介于液态和固态之间的“玻璃态”而得名的,它是利用高浓度渗透性的冻存液先置换出细胞内的自由水,再以极高的降温速率让组织迅速通过相变温度区,使胞内冰晶不能形成,从而避免了细胞损伤[6]。冻存液玻璃化的形成是本方法的关键,合适的降温速率和溶液浓度有助于细胞内溶液玻璃化的形成。由于溶液浓度越低,其形成玻璃化所需要的降温速率越高,但越高的降温速率越难实现,这就需要通过提高冻存液浓度来降低实现玻璃化所需要的降温速率。然而,过高的溶液浓度对细胞具有一定的毒性作用,因此,溶液浓度不宜太高,与降温速率相匹配即可[7]。据报道,冻存液浓度在40%~60%(w/w)时,较慢的降温速率便可使溶液实现玻璃化[8]。
2 玻璃化法冻存致细胞损伤机制
组织样本在冷冻降温过程中引起细胞损伤的原因有很多,目前国内外研究者公认的原因为“胞内冰晶”和“溶质损伤”[9]。胞内冰晶是指快速降温时,细胞内水分未来得及渗透到细胞外就形成了冰晶,胞内冰晶会损伤细胞器,造成细胞结构破坏[10],从而引起细胞的致命损伤;溶质损伤是指慢速降温时,细胞外的溶液先形成冰晶,此时细胞内外形成溶液渗透压差,细胞内水分外渗到细胞外,细胞内溶质浓度升高,细胞器及细胞内容物长时间处于高渗溶液中而引起的细胞损伤[11]。
3 玻璃化法冻存影响组织冻存的因素
玻璃化法冻存的组织前处理、低温冷冻和复温等基本步骤中均存在影响冻存效果的因素,众多研究者对组织块大小、冻存液的选择、冻存载体选用和复温方式等主要因素(表1)进行了研究。
3.1 组织块大小 为了提高冻存液的渗透效率,冻存前,组织需切分成适当形状及大小。鉴于冻存的组织复温后往往用做移植或培养,所以冻存的组织块越大,细胞数量越多,功能也越全,冻存意义就越大。但组织块越大,其内外渗透程度越不均衡,冻存时容易造成局部组织损伤坏死。目前极少有组织块大小对组织玻璃化冻存效果比较的研究报道,多数研究者将组织块切成横截面积为1 mm2或长度为1 mm的形态[12-14]。
3.2 冻存液 合适的冻存液在冻存组织时可增加细胞粘性,调控细胞渗透压,同时改变水分子的空间排列,在适宜的降温速率下可避免溶质损伤及冰晶损伤[15]。根据渗透性的不同,冻存液可分为渗透性冻存液和非渗透性冻存液2类。渗透性冻存液能穿透细胞膜,可以结合溶液中的水分子而弱化冰晶的形成;非渗透性冻存液不能穿透细胞膜,但可提高细胞外渗透压,使细胞内水分子渗出细胞外而降低胞内冰晶的形成。由于渗透性冻存液对细胞有毒性,非渗透性冻存液会导致细胞失水而皱缩,故2者的浓度、用量均不能太高,玻璃化法中常联合使用这2类冻存液。
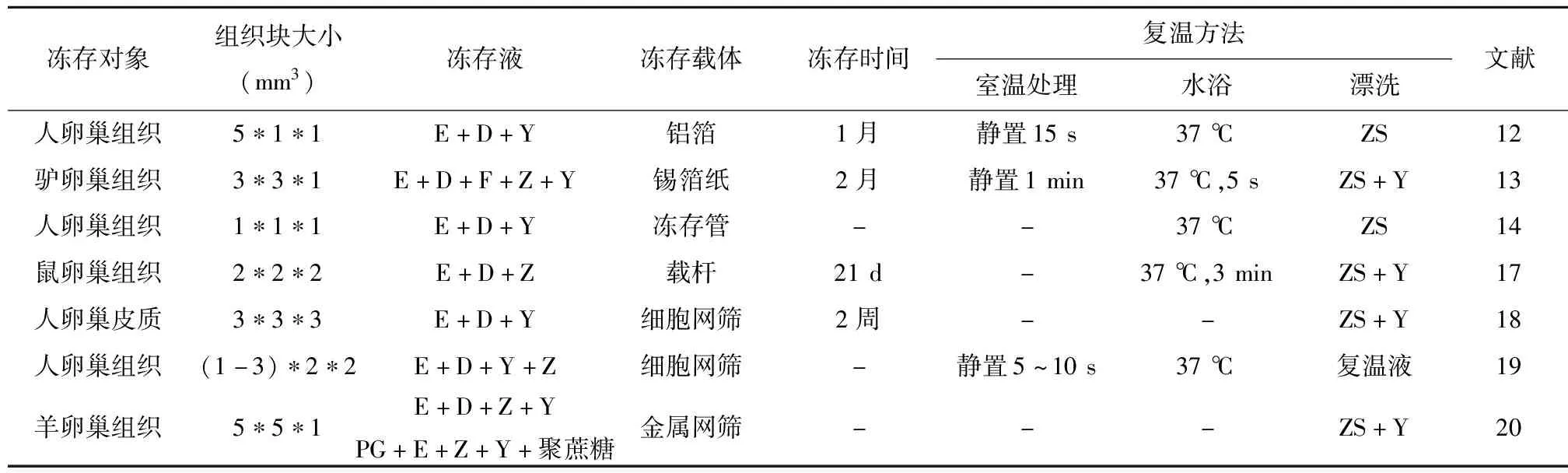
表1 影响组织冻存效果的因素
注:E为EG,乙二醇;D为DMSO,二甲基亚砜;F为FBS,胎牛血清;PG为没食子酸丙酯;Y为培养液;Z为蔗糖;ZS为蔗糖溶液
3.3 冻存载体 组织冻存时,玻璃化法冻存通常会采用一定手段来使组织获取最佳的传热速率,采用冻存载体来改善组织降温速率最为常见。王燕蓉等[16]分别采用罐口法和超速法2种方式的液氮蒸汽预冷用塑料麦管装载好的组织,再将其投入液氮中。有文献表明,载杆[17]、细胞网筛[18-19]和金属网筛[20]等不同类型的冻存载体在组织降温速率方面发挥着重要作用,其中金属固相表面载体[21]的效果更优。
3.4 复温方式 复温是组织冻存时物理状态变化的逆过程,随着温度逐渐接近冰点,细胞内也会有产生冰晶的趋势[15]。为了避免复温时胞内冰晶损伤细胞,目前常采用提高升温速率来使组织快速通过危险温度区域。组织细胞复温后有毒性的渗透性冻存液会残留,因此,复温液多数为低浓度冻存液或不含冻存液的培养液,且复温后要用不同浓度梯度的蔗糖溶液对组织进行多次漂洗[17-18,20]。
4 玻璃化法组织冻存效果的评价指标
玻璃化法冻存组织的效果可通过组织学形态、细胞凋亡、移植、细胞或组织培养等内容进行评价。组织学形态是评价组织冻存效果最基本的指标之一,经固定、切片及染色等过程处理后的新鲜及冻融组织,在显微镜或电镜下观察并对比其细胞比例和结构变化,例如用显微镜观察冻存前后卵泡分布比例及其结构变化,用透射电镜观察线粒体、内质网等亚细胞结构变化,可评估低温冷冻对卵巢组织细胞结构完整性的影响[22]。细胞凋亡是检测组织冻融后细胞存活率的重要指标,在评价组织冻存效果中也应用广泛。
除了形态及存活方面的变化,冻存组织的某些生物学功能也可能会发生变化。为了进一步评估冻融后组织的功能,培养(表2)和移植(表3)是使用最多的评估方法。通过细胞或组织的体外培养,可检测其在冻融后的生长发育能力;通过移植可评估冻融后的组织是否仍具有正常生物功能。以卵巢组织的冻存为例,可直接培养卵巢组织块[21,25],然后测定其组织学形态或培养液中雌二醇等激素含量来评估冻存的效果,也可通过机械分离或酶解分离出单个卵泡或卵子后[23,27],在培养液中培养一段时间后再测定培养液中的雌激素含量、细胞的活力及数目等指标来评估冻存的效果。卵巢组织的移植可分为异种移植[28]、自体原位移植[31]和自体异位移植[32],常通过评估移植后的组织学形态、卵泡数量及活力、雌激素含量,同时结合观察移植物的外观及其生长情况来评估冻存效果。

表2 组织复温后培养评估冻存效果
注:E为EG,乙二醇;D为DMSO,二甲基亚砜;F为FBS,胎牛血清;BSA为牛血清白蛋白;PROH为1,2-丙二醇;Y为培养液;Z为蔗糖;K为抗菌物质;ZS为蔗糖溶液
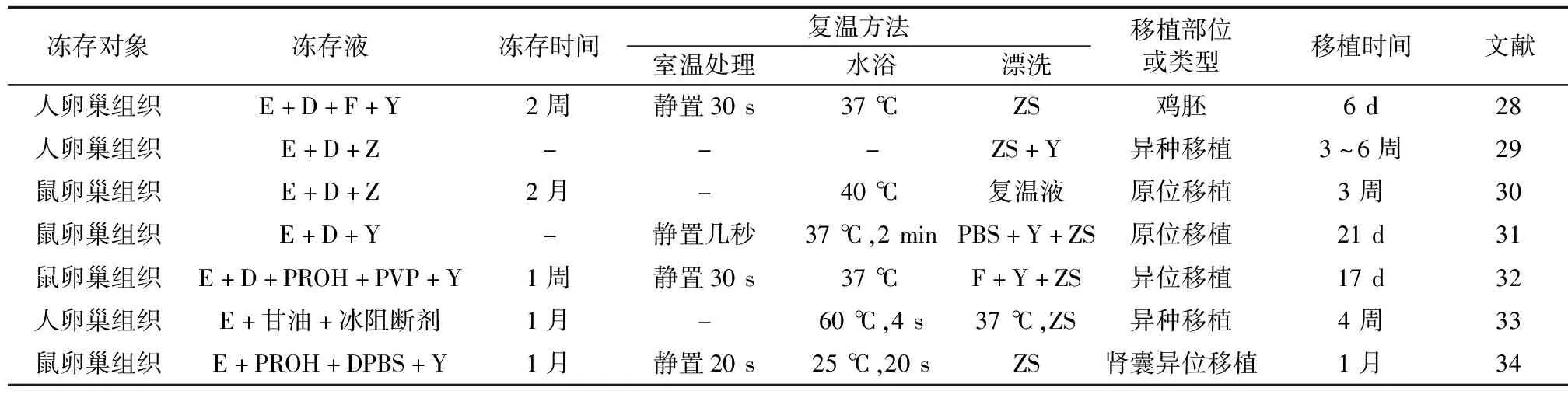
表3 组织复温后移植评估冻存效果
注:E为EG,乙二醇;D为DMSO,二甲基亚砜;F为FBS,胎牛血清;BSA为牛血清白蛋白;PROH为1,2-丙二醇;PVP为聚乙烯吡咯烷酮;DPBS为磷酸盐缓冲液;Y为培养液;Z为蔗糖;ZS为蔗糖溶液
5 存在问题及展望
玻璃化法冻存操作简单、费用低廉且效果良好,用于组织样本的低温冻存具有明显的优势,但目前仍有许多问题有待解决。玻璃化法冻存缺乏统一的冻存方案。由于影响组织冻存效果的因素众多,不同研究者各自的出发点不同,因此形成了多种不同的组织玻璃化冻存方案[13-14,17-18]。不仅冻存组织块大小的选取上[17-20]没有绝对统一的标准,不同方案的冻存液配方[23-27]、冻存载体[17-20]及复温方式[29-34]等关键因素更是差别巨大。玻璃化法冻存细胞损伤机制尚有不明之处。胞内冰晶与溶质损伤虽解释了细胞损伤的基本原因,但冻存液对细胞的毒性,冻存对细胞膜、细胞器及遗传物质等造成的损伤机制,胞内冰晶产生的原因等问题均没有理想的解释。
如何提高组织冻存的效果是评估玻璃化法的最终目标。最佳的冻存方法应对冻存液配方、冻存载体及复温等关键因素进行综合考虑,尽可能降低细胞损伤。冻存液的组合配方虽然较多,但没有指导性的方案,仍需要继续探索。近年来,有学者尝试新型材料的冻存载体用于组织冻存阶段的降温过程[15],尤其是固相表面载体,取得了较好的效果,随着新材料的发掘及技术的进步,也可能存在某种相对最佳的材质,能够使组织获得适宜的降温速率。
此外,组织冻存的研究目前主要集中在卵巢组织领域,且多数是为临床服务的。实际上,组织样本低温冻存的意义远不只是在临床上应用,在医学研究中也同样非常重要。因此,各类正常、癌及癌旁组织样本的低温冻存研究还需要更多研究者来不断探索。随着低温冷冻技术的不断发展,冻存液配方的改进,玻璃化法冻存组织样本的方案必将会逐步规范,并在各类样本低温冻存领域中愈加广泛的应用。
