10%中性缓冲福尔马林固定石蜡包埋DNA质量分析
2020-02-20房爱菊张晓莹管冰心戴宗燕周成军
房爱菊,张晓莹,管冰心,戴宗燕,周成军
福尔马林固定石蜡包埋组织是病理学研究中的重要资源。近年来,随着分子病理学技术的突飞猛进,如肿瘤相关基因的突变、靶向药物的分子检测等使得病理学科进入分子病理时代。肿瘤相关基因研究在现代肿瘤分子生物学研究中也越来越广泛,因此提取的DNA质量将直接影响实验的结果。长时间保存的石蜡组织提取的DNA质量能否满足分子生物学的需要,成为许多研究的焦点。我们通过比较储存10年以内的石蜡包埋组织提取的DNA浓度、纯度及片段长度,探讨经10%中性缓冲福尔马林固定的石蜡包埋组织DNA质量随着储存时间的延长产生的变化,从而为分子生物学实验对石蜡包埋组织的要求提供依据。
1 资料与方法
1.1 一般资料 选取44例淋巴结活检石蜡包埋组织(常温储存,2009年—2017年每年4例,2018年取3个月内标本及半年标本各4例)均来自山东大学第二附属医院病理科,采用10%中性缓冲福尔马林(购自济南百博生物技术股份有限公司)固定6~24 h后脱水包埋制成蜡块,蜡块组织直径均大于0.8 cm。常规消毒所用物品,8 μm厚连续切片5片放入1.5 mL离心管中备用。
1.2 仪器与试剂 低温高速离心机(德国艾本德公司,型号:Eppendorf 5810),紫外分光光度计(北京美林恒通仪器有限公司,型号:SMA4000),3500-DX测序仪(美国ABI公司);DNA提取试剂盒(德国凯杰公司,QIAamp DNA FFPE Tissue)、淋巴瘤基因重排试剂盒(美国Invivoscribe公司,IdentiCloneTM系列)。
1.3 DNA提取 石蜡组织先经二甲苯脱蜡(1.5 mL二甲苯,14 000 r/min离心5 min)2次,无水乙醇去除二甲苯(1.5 mL无水乙醇,14 000 r/min离心5 min)2次,晾干后备用。按试剂盒说明操作,提取蜡块组织DNA。
1.4 DNA质量检测
1.4.1 DNA浓度和纯度检测 按照微量分光光度计操作说明书操作,打开微量分光光度计,设置检测双链DNA的程序,吸取1 μL待测DNA进行检测,依次读取A260、A260/A280及双链DNA的浓度值。
1.4.2 DNA片段长度(完整性)分析 用淋巴瘤基因重排试剂盒中DNA片段长度分析试剂(标本内参分子量标准定位于管家基因的引物mix,Specimen Control Size ladder,SL,货号2-096-0021),通过对人类细胞的管家基因(TBXAS1、RAG1、PLZF、AF4)设计不同荧光标记的引物,可以进行100、200、300、400、600 bp长度的DNA片段扩增。按照试剂盒说明书配置PCR反应体系及编辑扩增程序,以试剂盒中阴性质控品(货号4-092-0010)做阳性对照,以去离子水做阴性对照。编辑样本运行ABI 3500DX毛细血管电泳程序,如果能看见400、600 bp的片段,说明DNA质量完整(因为PCR会优先扩增小片段,600 bp片段会很弱或将完全看不到),如果只出现100、200或300 bp的片段,说明DNA发生不同程度降解。
1.5 统计学处理 选用SPSS 21.0软件,两组样本间均数比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 DNA浓度检测结果 对44个样本进行检测,浓度在70.60~483.60 ng/μL,平均浓度290.13 ng/μL,样本浓度均达到检测要求,DNA浓度无明显差异(P=0.264)。
2.2 DNA纯度结果 44个样本A260/A280均在1.8~2.0之间,所提取的样本DNA未受到蛋白质或者酚类物质的污染,纯度较好,样本均符合检测要求(表1)。
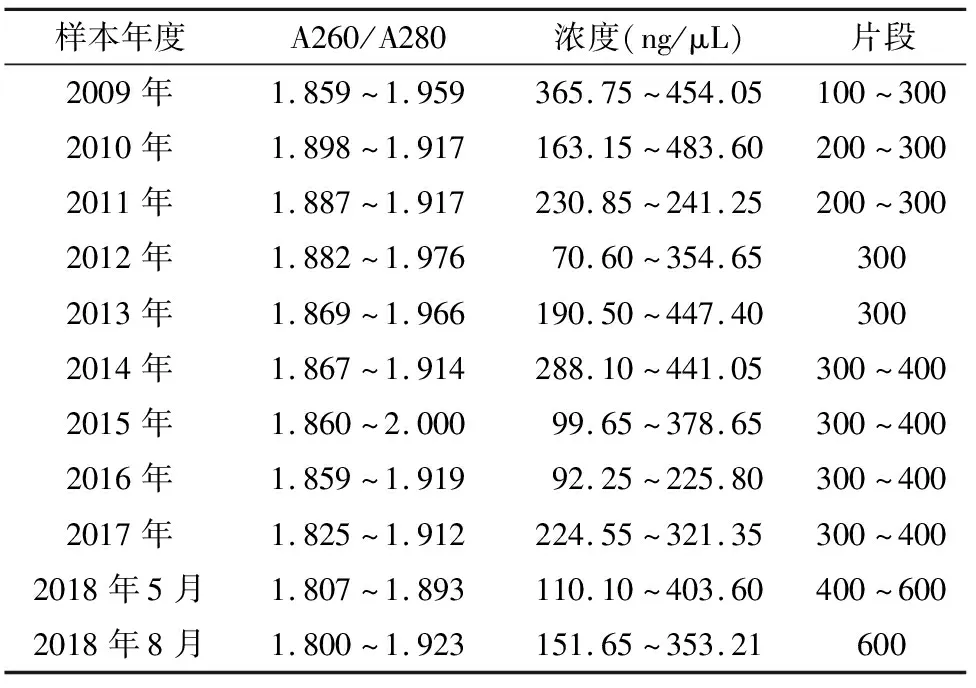
表1 样本DNA A260/A280、浓度检测结果
2.3 DNA片段分析 所有样本均能扩增出100 bp的片段,各标本之间差异不大。43例样本扩增出200 bp的片段,37例样本扩增出300 bp的片段;11例样本扩增出400 bp的片段,均为2014年之后的标本;7例样本扩增出600 bp的片段,均为2018年的标本。随着储存时间的减少,长片段的扩增效率逐年增高(图1)。
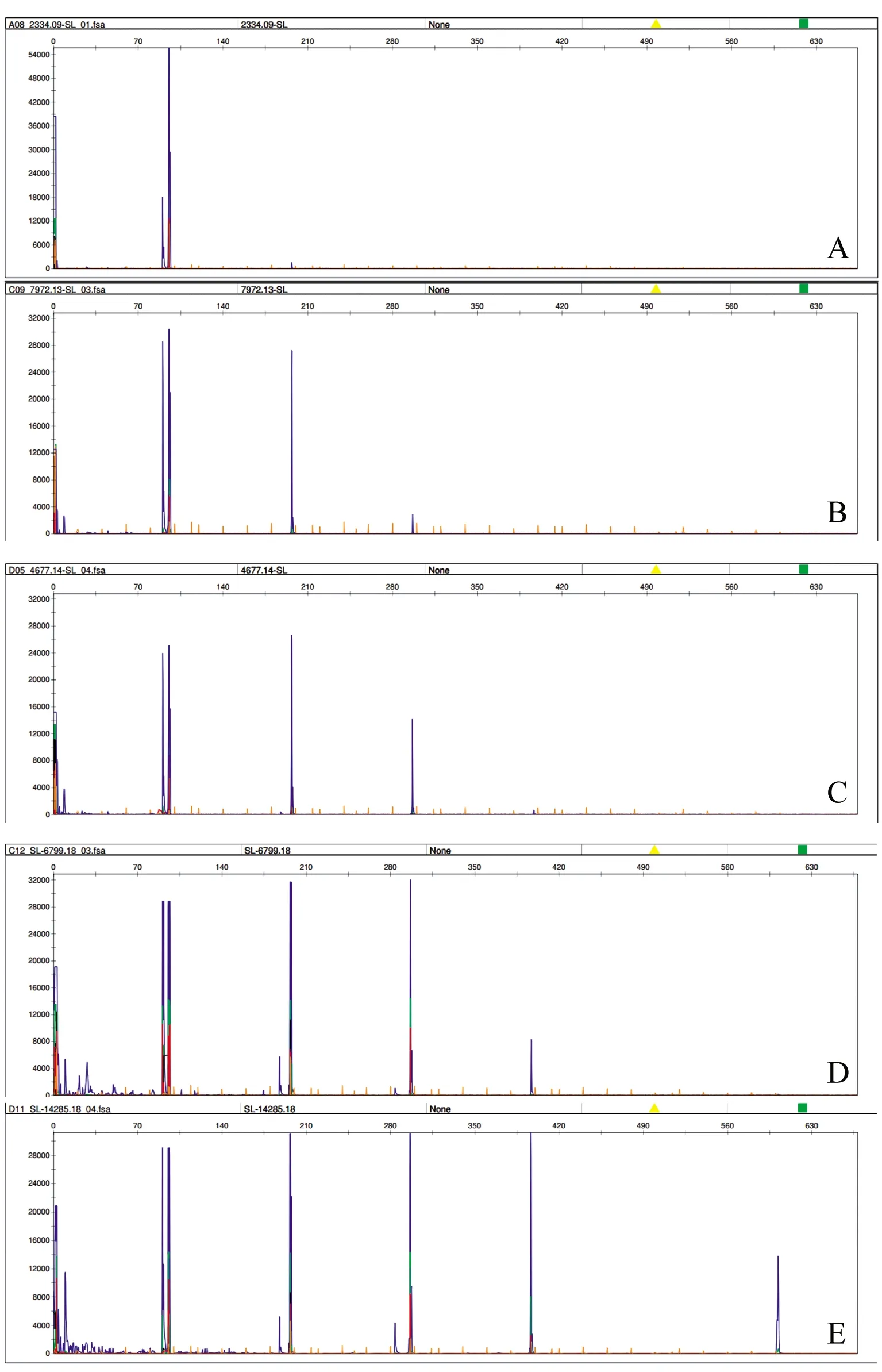
A:2009年标本;B:2013年标本;C:2014年标本;D:2018年5月标本;E:2018年8月标本
3 讨 论
福尔马林固定石蜡包埋组织的使用历史已逾百年,其制备、保存和使用方法已经比较成熟。近十年来,由于分子病理检测项目逐步开展,核酸提取和检测技术拓展了福尔马林固定石蜡包埋组织的应用范围[1-2]。然而,福尔马林固定石蜡包埋组织也存在一定的弊端,福尔马林固定液的主要成分甲醛是最小的含氧有机物,具有较高的反应活性,可以和带有-OH(羟基)、-SH(巯基)、-NH2(氨基)基团的分子发生亲核加成反应,最终作为亚甲基(-CH2-)的提供者,与上述基团中的两个基团反应,使自由的分子链被交联起来,从而发挥对组织固定的作用,同时也对DNA分子产生不利的影响,导致DNA链的脆性增加,在受到剪切力作用时,更容易发生随机断裂[3];同时DNA与蛋白质之间经广泛交联后形成牢固的复合物,可阻碍蛋白酶对组织的消化。甲醛除本身可造成DNA分子损伤外,其与氧化性物质接触后形成的甲酸,可改变环境pH,从而影响DNA分子稳定性,使核酸中嘌呤基的β糖苷键容易发生水解而导致DNA链断裂[4]。Funabashi等[5]提出缓冲甲醛固定标本的DNA质量好于普通甲醛固定者。我国之前的研究证实蜡块组织中DNA在最初几年降解迅速[6],存放3年的标本即不能扩增出400 bp长度的片段,而对于中性缓冲福尔马林固定的组织的DNA质量缺乏相关数据,因此我们对10年以内的标本更换标准中性缓冲福尔马林溶液商用试剂,并标准固定时间(所有标本固定时间均控制在6~24 h内)的石蜡包埋组织DNA质量进行回顾性分析。
对DNA标本浓度及纯度的评价方法,我们选用的是紫外分光光度计测定法,即利用核酸的紫外吸收性质测定核酸的质量。本研究显示,存放10年以内的福尔马林固定石蜡包埋组织中提取的DNA浓度及纯度无显明差异,DNA浓度虽因标本大小有所差异,但差异无统计学意义;提取的DNA A260/A280均在1.8~2.0范围内,说明DNA中无蛋白质、酚类等污染;同时也表明DNA的浓度及A260/A280不是评价DNA质量的良好指标,无法对DNA的特征进行全面评价。
在对DNA片段长度分析中,我们使用多重PCR评价DNA的完整性,该方法被多次报道用于DNA完整性评价,该评价方法比仅通过琼脂糖电泳来估计DNA样本中主要片段的长度更客观、准确且直观[7]。我们通过实验发现近3个月内的石蜡包埋组织中提取的DNA片段长度可达到600 bp,而半年时间降解到400 bp左右,以后降解速度变慢,5年之内的蜡块提取的DNA均能扩增出300 bp的片段。目前基因检测设计引物一般要求扩增长度为200~300 bp,能够满足目前存在的所有基因检测平台(包括Sanger测序、新一代测序及实时定量PCR)实验要求。目前已有研究证实存放3年的石蜡组织标本对EGFR基因的Sanger测序检测及AMRS法检测均没有影响[8-9]。随着检测的敏感性和特异性的提高,新一代测序技术对DNA片段的长度要求降低,一些研究也已经证实存放2~4年的石蜡组织标本提取的DNA质量能够满足靶向二代测序技术的要求[10-11]。本研究证实存放5年以上的蜡块只能扩增出很少的300 bp的片段,存放10年的蜡块仅能扩增出100 bp的片段,已经无法满足各基因平台检测的需求。
综上所述通过采用标准10%中性缓冲福尔马林固定,固定时间控制在6~24 h内,石蜡包埋组织存放5年之内,提取的DNA质量能够满足目前进行分子病理检测的大多数平台,因此在临床病理工作中做好固定液的选择、控制好固定时间是保证石蜡包埋组织DNA质量的关键。
