MiR-92a表达上调与结直肠癌临床病理及预后的相关性分析
2020-02-20魏前灯郑文波
魏前灯,郑文波,孙 凯
结直肠癌是我国常见多发的恶性肿瘤之一,在我国城市和农村的发病率分别为常见恶性肿瘤的第4和第5位,而随着我国生活水平的日益提高和饮食习惯的相应转变,其总体发病率逐年上升[1]。以广州地区为例,2010年—2014年期间,在广州共登记了14 618例结直肠癌病例,粗发病率为35.56/100 000,粗发病率从2010年(32.88/100 000)到2014年(39.36/100 000)增长了19.70%,平均年变化率为4.33%[2]。但目前我国结直肠癌临床诊治效果仍不尽人意,5年生存率徘徊不前,提高结直肠癌的综合治疗效果具有重要的科学价值和社会意义,而国人结直肠癌发生发展过程中分子特征的深入研究将为加强和促进我国结直肠癌防治工作提供必要的理论基础[3-4]。
近年研究表明,微小RNA(microRNA,miRNA)在mRNA转录后基因沉默中发挥着重要作用[5]。MiRNA是存在于各种生物体内的由19~22个核糖核苷酸组成的一类新型小分子RNA。MiRNA来自于内源性基因组DNA的非编码区的直接转录,首先在核内生成miRNA前体,继而在转运体的运载下由细胞核移出至胞浆,经Dicer酶切割成熟并与Argonaute(AGO)蛋白组装成RNA诱导沉默复合体,并与靶mRNA3′非翻译区(untranslated region,UTR)互补结合,从而切割降解目的mRNA或仅抑制靶mRNA的进一步翻译,产生相应的功能表型缺失,其究竟执行何种功能取决于AGO蛋白亚类是否具有内切核酸酶活性及miRNA与mRNA的互补配对程度,这一现象属于转录后基因沉默机制[6]。
既往研究表明,miR-92a在结直肠癌患者中表达上调[7],但是其表达异常在结直肠腺癌发生发展中的作用及对预后的影响尚知之甚少。本研究回顾性分析miR-92a在结直肠癌中的表达,并进一步分析其表达与结直肠癌临床病理特征、生存状况和预后的相关性。
1 资料与方法
1.1 一般资料 收集2013年10月—2014年6月于南方医科大学南方医院接受手术治疗的124例结直肠癌患者的临床资料,其中男71例,女53例,年龄23~89岁。纳入标准:经病理证实为结直肠癌、术前均未接受放化疗、原发肿瘤局部行根治性手术治疗、术后完成3年随访调查、临床及随访资料完整。排除标准:心肝肾肺器质性功能障碍者、脑血管疾病者、肠外肿瘤者、自身免疫功能缺陷者、血液系统疾病者、精神障碍者、妊娠或哺乳期女性、临床及随访资料不完整者。所有病例均经术后病理学检查确诊为结直肠癌,术前均未接受放疗和化疗,所有患者签署知情同意书。
1.2 研究方法 使用原位杂交法检测结直肠肿瘤组织中miR-92a表达水平。患者的肿瘤组织石蜡包埋后切片,厚度控制为3 μm,其用地高辛标记的探针(日本TaKaRa公司)原位杂交后染色。MiR-92a的地高辛标记探针的序列如下:5′-ACAGGCCGGGACAAGTGCAATA-3′。读片和图像采集使用Nikon 80i显微镜(日本尼康公司),同时使用Nikon NIS-Elements F2.3软件(日本尼康公司)进行分析。两名研究人员独立镜检,并使用基于DAB法染色程度的视觉分级系统定量miR-92a表达。
1.3 评价标准 采用半定量法,应用普通光学显微镜,高倍镜下(10×10)随机取5个不同的视野。计算阳性细胞占总细胞数的百分率并进行积分(0分,无阳性细胞;1分,1%~25%;2分,26%~50%;3分,51%~75%;4分,>75%),同时观察染色强度(0分,无染色;1分,淡黄色;2分,棕黄色;3分,棕褐色)。计算阳性细胞百分率积分与染色强度积分的乘积来定义肿瘤组织中miR-92a的相对表达[8]。
1.4 统计学处理 选用SPSS 20.0软件;应用卡方检验及Spearman相关检验分析miR-92a表达与结直肠癌临床病理特点的相关性;应用Kaplan-Meier方法分析结直肠癌患者术后3年生存率及生存时间;应用单因素及多因素Cox回归模型分析结直肠癌患者预后的独立危险因素;以P<0.05为差异比较具有统计学意义。
2 结果
2.1 MiR-92a表达水平与结直肠癌患者临床病理特征的相关性 使用原位杂交法分析患者的miR-92a表达(图1);取中位表达水平作为阈值将124例患者分为miR-92a高表达组(乘积≥7)和miR-92a低表达组(乘积<7),各62例。结直肠腺癌患者miR-92a的表达与性别(P=0.204)、年龄(P=0.590)、BMI指数(P=0.145)、肿瘤大小(P=0.043)和肿瘤部位(P=0.369)无明显相关性;而与结直肠腺癌分化程度(P=0.015)、T分期(P=0.031)、N分期(P=0.030)、M分期(P=0.011)和AJCC临床分期(P=0.047)存在显著相关性(表1)。

图1 结直肠癌组织中的miR-92a的表达(DAB法显色,×100倍)

表1 结直肠癌患者临床病理特点与miR-92a表达
2.2 MiR-92a表达水平与结直肠癌患者生存的关系 不同miR-92a表达组生存曲线见图2。高表达组和低表达组术后3年累积生存率分别为66.1%和91.9%,中位生存时间分别为29.350(95%CI:26.627~32.074)个月和34.939(95%CI:33.078~36.799)个月,miR-92a高表达组累积生存率明显低于miR-92a低表达组,两者术后生存率差异有统计学意义(χ2=12.006,P=0.001)。
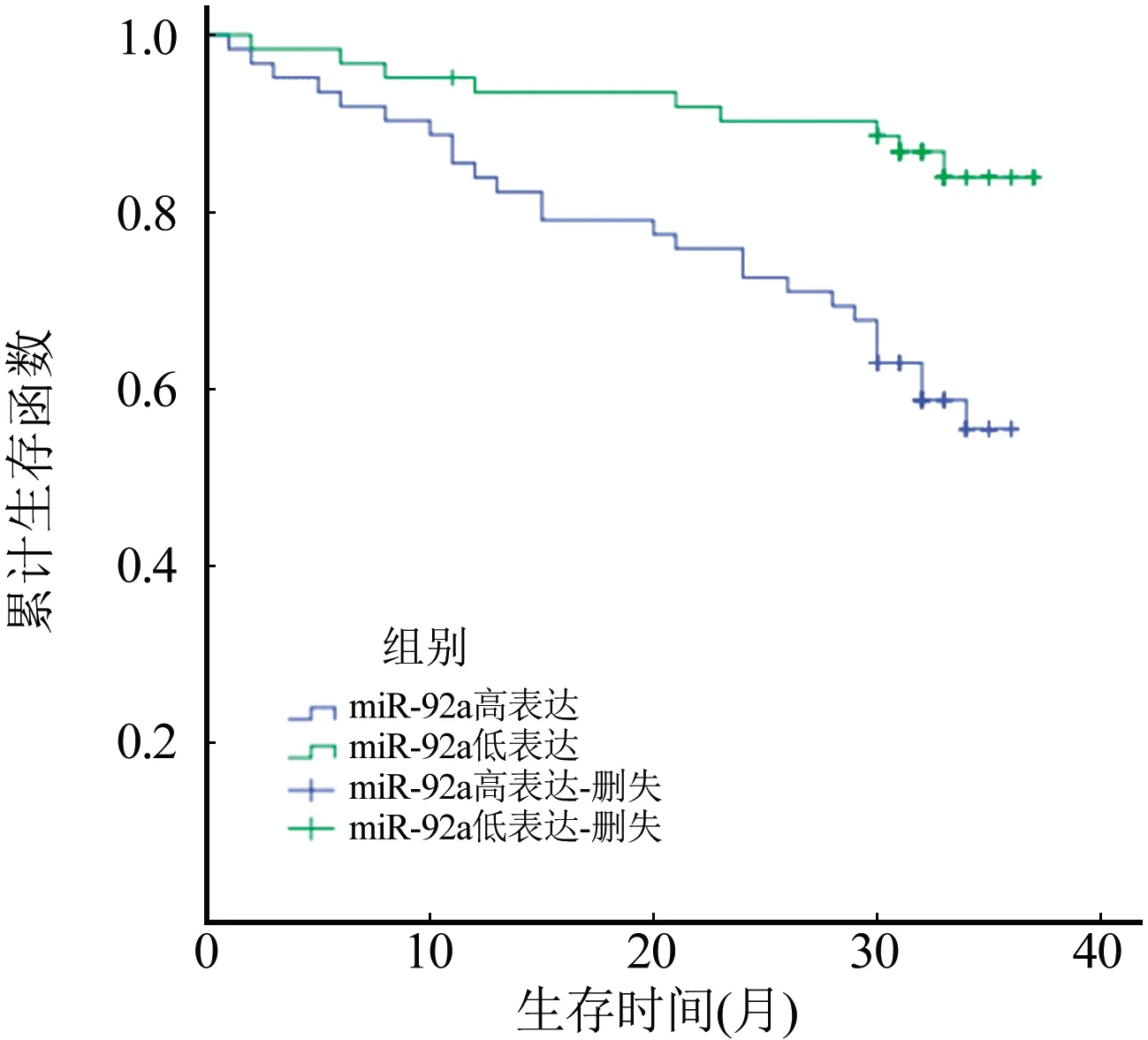
图2 不同miR-92a表达组生存曲线
2.3 MiR-92a表达与直肠癌患者预后的关系 应用单因素Cox回归模型分析显示,不良生存率与肿瘤大小(HR=2.293;95%CI=1.052~4.995;P=0.037)、分化程度(HR=2.762;95%CI=1.197~6.374;P=0.017)、T分期(HR=6.074;95%CI=0.822~44.859;P=0.044)、N分期(HR=7.985;95%CI=2.747~23.206;P=0.001)、M分期(HR=4.938;95%CI=2.227~10.952;P=0.001)、AJCC分期(HR=5.863;95%CI=2.207~15.573;P=0.001)、及miR-92a表达(HR=4.749;95%CI=1.790~12.602;P=0.002)显著相关。通过调整,将肿瘤大小、肿瘤分化、AJCC分期和miR-92a表达纳入多因素分析[由于已知结直肠癌浸润深度(T分期),淋巴结转移(N分期)和远处转移(M分期)与AJCC分期相互影响,所以从多变量生存分析中被预先排除]。结果显示AJCC分期(HR=6.983;95%CI=2.074~23.509;P=0.002)和miR-92a表达(HR=3.165;95%CI=1.144~8.756;P=0.026)是不良总生存期的独立风险因素(表2)。

表2 结直肠癌患者生存时间的单因素及多因素分析
3 讨论
在全球范围内,结直肠癌是位于发病率第三的常见恶性肿瘤[9]。在我国,高发病率和高死亡率是结直肠癌主要特点,严重威胁我国人民身体健康[10]。根治性、规范化外科手术和新兴化疗药物尽管已经使结直肠癌的近期疗效得到了显著的改善,但仍无法显著提高患者的5年生存率[4]。因此,探寻影响结直肠癌患者预后的因素并对这些因素进行积极干预具有重要的理论和实践意义,理论上可以进一步丰富结直肠癌发生和发展的机制,实践中可以指导临床针对结直肠癌的诊断、预防、治疗和预后提供新的策略和思路。
MiRNA在mRNA转录后基因沉默中发挥着重要作用,其与肿瘤的发生发展密切相关[11-12]。既往研究表明,miR-92a在结直肠癌患者中表达上调[13-15]。在本研究中,我们对结直肠癌肿瘤组织芯片进行miR-92a原位杂交,取中位表达水平作为阈值将患者分为miR-92a高表达组和miR-92a低表达组。发现结直肠癌患者miR-92a的表达与性别、年龄、BMI指数、肿瘤大小和肿瘤部位无明显相关性,而与结直肠癌分化程度、浸润深度、淋巴结转移、远处转移和AJCC临床分期存在显著相关性。这提示结直肠肿瘤组织中高表达miR-92a可能与患者不良预后有关。为进一步验证,我们对2组患者进行了Kaplan-Meier生存分析,结果提示高表达组患者的累积生存率明显低于低表达组。单因素Cox回归分析中,不良生存率与肿瘤大小、分化程度、T分期、N分期、M分期、AJCC分期和miR-92a表达相关。Cox回归分析结果提示miR-92a可能参与了结直肠癌的病情进展以及淋巴结转移过程,与国外研究结论一致[15-16]。因此,在临床工作中可通过对miR-92a表达情况进行检测,进一步有效评估患者病情严重程度以及淋巴结转移情况,为临床治疗方案的制订提供参考信息。基于单变量生存分析的结果进行多变量生存分析,AJCC分期和miR-92a表达被认定为是不良总生存时间的独立风险预测因素,这为miR-92a可能作为未来结直肠癌治疗的有效分子标志物提供了有力的证据。临床上可通过检测肿瘤组织miR-92a表达情况,从而对结直肠癌患者进行预后评估,miR-92a表达越高,患者远期预后可能越差。
本研究揭示了miR-92a在结直肠癌中的表达模式,并提示了其作为诊断标志物和治疗靶点的潜在应用价值。MiR-92a在结直肠癌发生发展中的作用及其机制还需要进一步研究验证。
