亨廷顿舞蹈病相关睡眠障碍特征1例报告及文献复习
2020-02-19高乐虹黄朝阳张益萌詹淑琴
袁 媛, 高乐虹, 李 宁, 黄朝阳, 张益萌, 赵 昕, 李 鑫, 翟 怡, 詹淑琴
亨廷顿舞蹈病(Huntington’s disease,HD)是一种由常染色体显性突变引起的遗传性疾病,导致中枢神经系统的进行性退行性改变[1]。由CAG重复序列异常扩增导致编码有毒性作用的Huntingtin蛋白(HTT)而致病[2]。该病的发病年龄在35~50岁之间,大多在15~20 y内死亡[3]。其典型的临床表现为进行性的运动障碍、认知障碍和精神行为异常[4]。
昼夜节律异常和睡眠障碍常见于许多神经系统退行性疾病,如帕金森病、阿尔兹海默病[5]等,HD也很常见,Taylor等对HD患者及照料者进行睡眠状况问卷调查显示约87.8%的患者存在各种睡眠障碍,其中61.7%的患者的症状更重。HD合并的睡眠障碍主要包括不宁腿综合征,周期性肢体抽动,夜间觉醒,白天过度嗜睡和早醒等。睡眠障碍是HD疾病晚期的一个突出特征,并严重危害了患者和照料者的生活质量[6]。Goodman等在2010年的研究也显示,80%的HD患者睡眠受到干扰,表现为睡眠效率降低,结构发生改变[7],睡眠潜伏期延长,夜间频繁觉醒,快速眼动睡眠潜伏期延迟或缩短[8,9]。睡眠觉醒周期的改变在HD疾病的早期阶段就已经存在,表现为卧床清醒时间延长,深睡眠和REM睡眠减少,这种改变通常发生在运动障碍出现之前,也见于疾病的晚期。然而,HD患者的睡眠障碍并没有得到医生和患者足够的重视,可能是由于对进行性的运动功能障碍、认知损害和精神行为异常的过多关注,而忽略了睡眠障碍的重要性。在此,我们希望通过报道1例伴有睡眠障碍的亨廷顿舞蹈病患者的病例并结合文献进行复习,以提高临床医生对HD患者睡眠障碍的关注度。
1 病例简介
患者,男,25岁,主因“右侧肢体不自主运动10 m”于门诊以“亨廷顿舞蹈病”收入我科。10 m前患者无明显诱因出现右侧肢体不自主运动,表现为右上肢投掷动作,右下肢舞蹈样步态,偶有怪笑、惊叫,7 m前患者出现言语笨拙、饮水呛咳、反应迟钝、计算力减退,无幻觉、头晕头痛、跌倒发作、抽搐,无睡眠障碍主诉等。既往史:无特殊。家族史:其父因HD去世,其叔叔及姑姑患HD(见图1)。
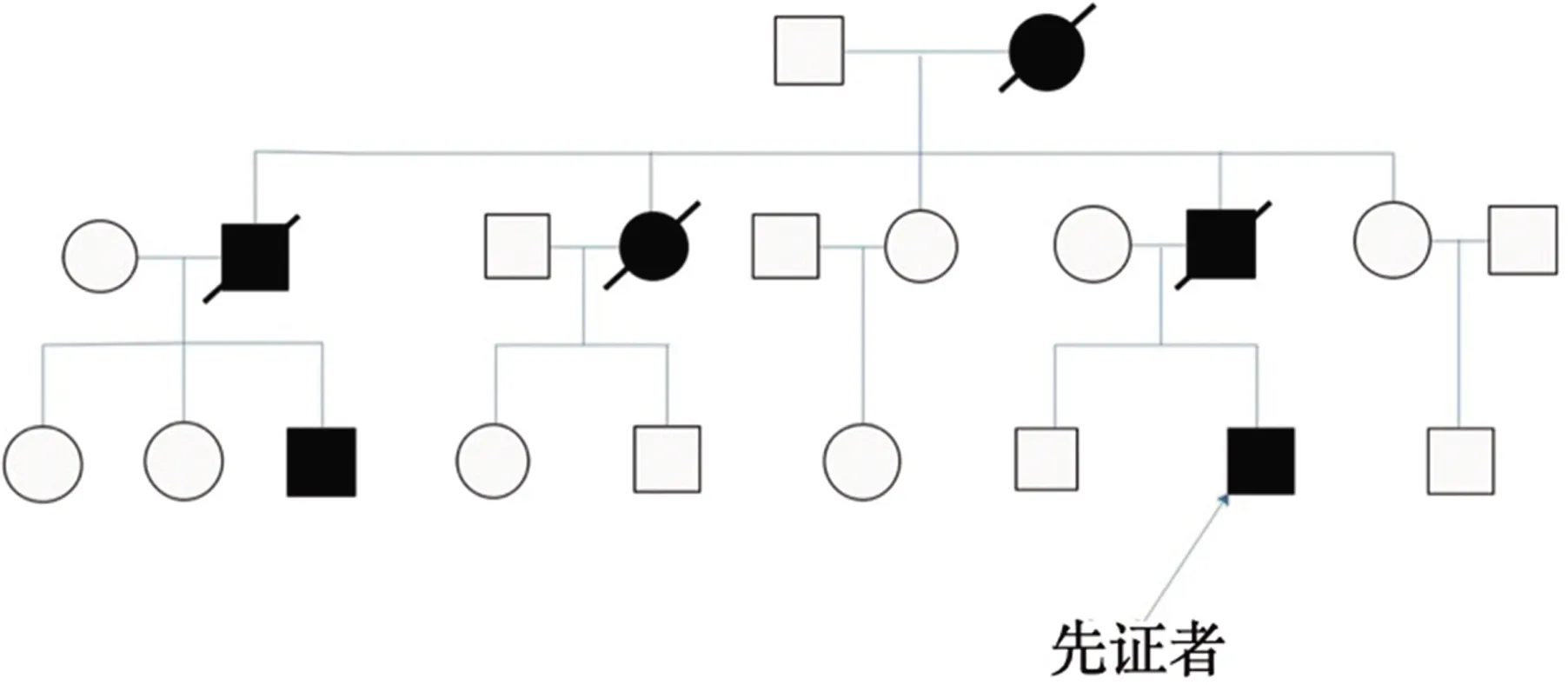
图1 患者家系图
入院查体:体温36.2 ℃,脉搏70 次/min,呼吸18次/min,血压120/70 mmHg。神清,言语略笨拙,记忆力、计算力减退,反应迟钝。双侧瞳孔等大等圆,对光反射灵敏,无复视,未见眼震,眼球各向运动充分,右侧鼻唇沟变浅,不自主右侧口角上抬,伸舌略右偏,咽反射存在,悬雍垂居中。四肢肌力Ⅴ级,肌张力正常,可见手指足趾不自主动作,双侧深浅感觉对称存在,右上肢腱反射亢进,右下肢腱反射活跃。双侧指鼻试验稳准,双侧跟膝胫试验欠稳准,脑膜刺激征阴性,Romberg征阴性,右侧掌颌反射阳性,双下肢病理征未引出。辅助检查:血尿便常规、凝血、糖化、ESR、甲功、维生素、肿瘤全项、抗核抗体谱、ANCA和铜蓝蛋白均未见异常。该患者文化程度为大专,简易智能精神状态检查量表(MMSE)评分24分,蒙特利尔认知评估量表(MoCA)评分17分(计算、记忆、空间结构能力受损)。韦氏成人智力测查提示:轻度智力障碍。脑电图:轻度异常。头部MRI示:右侧颞极囊肿;基底节萎缩,脑室扩大(见图2)。

A为患者头部MRI T1相,B为患者头部MRI T2相,C为患者头部MRI FLAIR相
患者基因检测结果提示:IT15基因1号外显子,CAG重复次数约为16和53次,在致病区间内(不完全外显:36~39次;完全外显:≥40次),符合亨廷顿舞蹈病致病特征(见图3)。患者哥哥CAG重复次数约为16次,提示重复次数未超出正常范围(正常人该序列的重复次数不超过26次,中间型不超过35次),不符合亨廷顿舞蹈病致病特征(见图4)。
该患者两次多导睡眠图均可见睡眠片段化,夜间觉醒次数明显增多(见图5、图6),从睡眠结构上看,该患者1期睡眠(N1期)比例增加,而深睡眠期(N3期)和快速眼球运动睡眠期(R期)比例明显减少,两次睡眠监测中并未记录到REM睡眠期行为异常(REM sleep behavior disorder,RBD)和肌肉失弛缓现象。

图3 患者毛细管电泳检测结果

图4 患者哥哥毛细管电泳检测结果

图5 患者第一次PSG

图6 患者第二次PSG
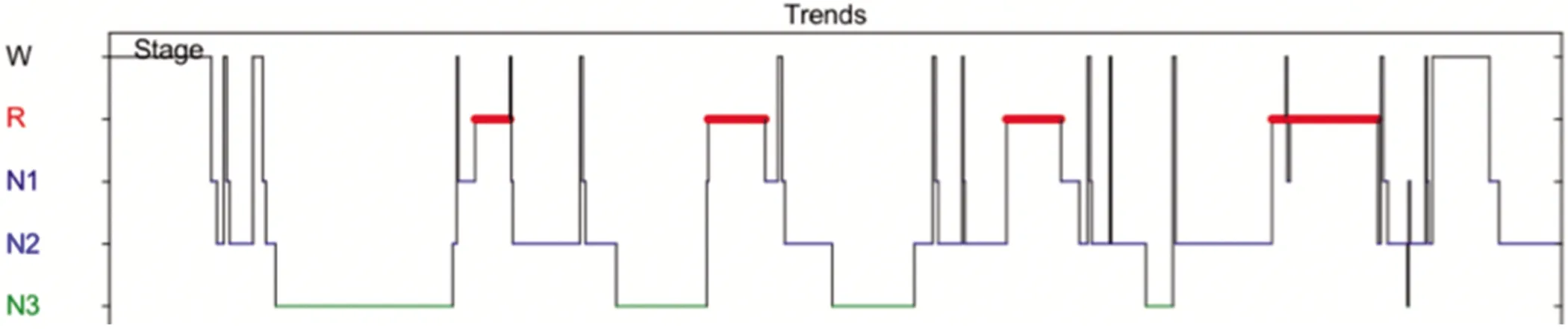
图7 正常人PSG
在文献报道中,HD患者表现出异常的昼夜节律,尽管他们没有主诉任何睡眠问题[10]。本文报道的患者并没有睡眠困难的主诉,而通过多导睡眠监测发现患者存在明显的睡眠紊乱。
2 讨 论
HD患者的睡眠障碍可通过以下观点解释:(1)HD携带者的纵向MRI研究显示,在临床诊断之前,下丘脑灰质显著减少[11],而下丘脑是睡眠调节的关键区域,下丘脑视交叉上核(SCN)控制松果体内褪黑素的合成,调控哺乳动物的昼夜节律。HD患者血浆中褪黑素的浓度减少,提示视交叉上核(SCN)神经元功能紊乱或退变,昼夜节律和光暗调节整合功能异常[12]。HD患者夜间褪黑素水平升高的时间明显推迟[13];(2)昼夜节律紊乱也是HD患者[14]和HD模型系统(包括小鼠[14]和绵羊[15])的一个保守特征。HD的果蝇模型,其中包括在HD患者中观察到的大多数特征性睡眠-觉醒周期紊乱,包括整体睡眠减少,睡眠破碎和睡眠潜伏期延长[16];(3)HD的特征性病理改变是纹状体(尾状核、壳核、苍白球)和皮质的萎缩和变性,最终累及到整个大脑,包括皮质下结构,在HD患者尸检的大脑病理研究显示,在大脑直接或间接参与睡眠和昼夜节律的多个脑区,尤其是下丘脑和脑干结构都存在广泛的神经元的退行性改变[10];(4)HD患者也常出现精神症状,包括焦虑、抑郁、易怒等,这些情绪障碍也可能是引起HD患者睡眠障碍的主要原因之一,Aziz等的研究表明,HD患者的夜间睡眠障碍主要与抑郁有关,其中睡眠周期延迟也与抑郁有关[17]。
Arnulf等的研究显示,与对照组相比,HD患者的睡眠效率更低,入睡后觉醒时间更长,但睡眠潜伏期无明显差异,表明HD患者主要在睡眠维持方面存在问题[9]。在一项对30例HD患者及30例健康受试者进行整夜的多导睡眠监测的研究[8]中发现,与对照组相比,HD患者的总睡眠时间(TST)更短,睡眠效率更低,觉醒次数更多,入睡后清醒时间(WASO)增加;N1期比例增加,N3期及REM期比例减少,所有受试者没有记录到RBD和肌肉失弛缓现象。不宁腿综合征和发作性睡病的患病率在HD患者中并无显著差异[18]。与对照组相比,HD患者有更频繁的周期性腿部运动[9],尚无法区分是周期性腿动还是睡眠中舞蹈样动作。
有越来越多的证据表明,睡眠连续性中断可能是神经退行性疾病进程的早期症状,但睡眠障碍往往早于HD的主要支持诊断的临床症状出现之前,这表明睡眠的连续性中断实际上很可能在神经退行性疾病的发展和恶化中也起了作用[5]。在神经退行性疾病研究的中,一个很重要的目标是寻找和如何尽早确定哪些症状是具有重要价值的疾病早期生物标记物或者是疾病的前驱症状,以达到早期诊断和早期干预的目的[19]。神经退行性疾病存在不同的睡眠障碍类型和睡眠特点,阿尔茨海默病(AD)患者的睡眠障碍特点为睡眠-觉醒模式改变,睡眠碎片化、日间思睡、慢波睡眠和快动眼睡眠期减少[20];帕金森病(PD)患者最常见的睡眠障碍类型包括睡眠碎片化、白天过度嗜睡和RBD[5],RBD也常见于其他突触核蛋白病,如多系统萎缩(MSA)、路易体痴呆(DLB)等;已有多项队列研究证明特发性RBD经过3~16 y约80%以上患者将转化为PD、MSA和DLB等神经变性疾病,被认为是突触核蛋白病早期最有特异性的预警生物标记物。但在本例HD患者和文献报道HD相关睡眠研究中都没有RBD,说明HD睡眠改变与PD相关的突触核蛋白病的睡眠障碍的病理损害及机制不一样,还有待于进一步研究。
睡眠是人类的重要生理功能,睡眠紊乱可能会诱发和加重疾病,从而导致人出现行为、认知和运动功能的障碍[20],对人的基本生理功能也会产生影响,如新陈代谢等[21]。在HD的转基因小鼠模型中,药物干预睡眠可以减缓认知能力下降,逆转昼夜节律基因表达的失调[22],说明睡眠障碍会影响HD患者的症状。睡眠和神经变性病的联系是双向的,因此HD患者睡眠障碍是进一步研究潜在干预措施的理想方向,这些措施不仅可以减轻症状,而且可以减缓病情的进展,从而使亨廷顿患者的睡眠问题成为诊断和治疗疾病的的新靶点。
