RYR2、FKBP12.6及CaMK-Ⅱ在COPD患者肺组织中的表达研究
2020-02-10王曦李萍耑冰苑群谢骏杨朝
王曦 李萍 耑冰 苑群 谢骏 杨朝
1苏州科技城医院呼吸内科215153;2宁夏回族自治区人民医院总院呼吸内科,银川750011;3苏州科技城医院心胸外科215153
COPD继发肺动脉高压(pulmonary hypertension,PH)是一种严重危害人类健康的常见病[1-2]。其主要病理生理基础是缺氧性肺血管收缩、重塑。肺血管平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)胞浆内Ca2+(cytoplasmic calcium ions,[Ca2+]i)浓度异常升高可导致肺血管收缩增强[3]。内质网钙释放是[Ca2+]i升高的主要原因[4],兰尼碱(ryanodine receptor 2,RYR2)钙通道是内质网上主要的离子通道,钙/钙调蛋白依赖性蛋白激酶Ⅱ(calciumcalmodulin-dependent protein kinase type 2,CaMK-Ⅱ)及FK506结合蛋白12.6(FK506-binding protein 12.6,FKBP12.6)是RYR2主要的调节因子[5]。研究发现,FKBP12.6与RYR2的结合能力与动脉性PH发病相关[6-7],然而目前COPD患者肺组织中内质网钙通道的表达研究少有报道,故本组拟观察RYR2、FKBP12.6及CaMK-Ⅱ在COPD患者肺组织中的表达并分析其意义。
1 对象与方法
1.1 研究对象 本研究获患者知情同意,经宁夏人民医院伦理委员会批准(2017伦审[科研]第071号)。选择2012年11月至2017年4月在宁夏回族自治区人民医院心胸外科住院的肺癌手术患者共30例,均符合2019年慢性阻塞性肺疾病全球倡议诊断及处理和预防策略[1]关于COPD的诊断标准:第1秒用力呼气容积/用力肺活量(forced expiratory volume in one second/forced vital capacity FEV1/FVC)≤70%且第1秒用力呼气容积占预计值百分比(forced expiratory volume in one second as a percentage of expected value,FEV1%pred)<80%。再根据2015年国际推荐超声心动图关于PH的诊断标准[8],心脏超声检查三尖瓣反流流速>3.4 m/s或估测肺动脉收缩压(pulmonary artery systolic pressure,PASP)为50 mm Hg(1 mm Hg=0.133 k Pa),考虑存在PH。将患者分为COPD合并PH组、COPD组、非COPD非PH对照组。选取远离癌变区>5 cm的肺组织待测。
排除标准:(1)排除COPD以外的其他呼吸系统疾病;(2)左心室收缩或舒张功能不全,急性心肌梗死,严重心律失常,不稳定性心绞痛,瓣膜性心脏病、心肌病;(3)其他类型的PH;(4)严重的失代偿性肝、肾疾病,中风;(5)全身性自身免疫性疾病;(6)近期有重大手术史、外伤史;(7)近期有口服影响代谢类药物(激素、免疫抑制剂等药物)史;(8)肺功能检测不能配合者。
1.2 试剂 小鼠来源的FKBP12.6(H-8)抗体(sc-376135)、小鼠来源的CaMKⅡ(A-1)抗体(sc-13141)购自美国SANTA CRUZ公司;小鼠来源的RYR2抗体[34C](ab2868)购自美国ABCAM公司;磷酸盐缓冲剂粉末(ZLI-9062)、EDTA抗原修复液(ZLI-9067)、DAB显色试剂盒(PV9019)、通用二步法检测试剂盒(小鼠/兔增强聚合物法检测系统)、伊红染色液(ZLI-9613)、苏木素染色剂(ZLI-9617)、无水乙醇(64-17-5)、中性树胶(G8590)等购自北京中杉公司。
1.3 仪器 Master Creen肺功能测定仪购自德国Jaeger公司;超声心电图诊断仪(iE33)购自美国Philips Andover公司;手动轮转切机(RM2245)、Leica ST5020染色机(ST5020)购自德国Leica公司;67℃电热干燥箱(GZX-DH)、37℃恒温培养箱(HH-B11)购自中国上海跃进医疗器械公司;黏附载玻片(158105白色)购自中国江苏世泰医疗器械公司;高压锅(YL249H2 18 cm)购自中国苏泊尔电器公司;光学显微镜(BX51)购自日本Olympus公司等。
1.4 方法
1.4.1 肺功能检查 所有入组患者接受肺功能检查。吸入支气管扩张剂15 min后使用德国Jaeger公司生产的Master Screen肺功能仪测定FEV1,FEV1/FVC。由专业肺功能师指导被检测者完成,报告通过专业肺功能师质控。
1.4.2 心脏彩超检查 所有入组被检测者均于平静呼吸5 min后由专业彩超师使用美国Philips Andover公司生产的超声心电图诊断仪进行检查,测量方法及各参数计算参照成人超声心动图评估、检查测量指南[9]。彩色多普勒测量三尖瓣的最大返流速度(V),然后根据伯努利公式计算跨三尖瓣反流压差(ΔP),ΔP=4V2;PASP=4V2+右房压。研究证实,超声测量肺动脉压与右心导管测量值之间存在良好的相关性[9-10],为PH患者首选的非侵入性检查。
1.4.3 肺组织标本制定 选取癌变远端>5 cm的肺组织,约0.5 cm3大小的新鲜标本固定并石蜡包埋。
1.4.4 免疫组织化学方法检测 RYR2、FKBP12.6及CaMK-Ⅱ免疫组织化学测定。取肺组织蜡块切片(厚度4μm)经无水乙醇脱水、烘干、脱蜡等处理后加入一抗,置于37℃恒温培养箱中,静置孵育2 h。PBS冲洗3次;加入二抗,37℃孵育1 h,PBS冲洗,DAB显色10 min,PBS冲洗,中性树胶封片。以PBS代替一抗作为阴性对照。结果判定:以细胞浆内出现棕黄色颗粒为阳性反应,(-)为阴性,(+)为弱阳性,(++)为阳性,(+++)为强阳性。采集图片并应用image pro plus 6.0图像分析软件测定阳性染色物质的光密 度(integrated optical density,IOD),对RYR2、FKBP12.6及CaMK-Ⅱ的表达进行半定量分析。
1.4.5 肺小动脉的选取及测量 选择显微镜下外径约200~400μm的肺动脉横截面为测量对象,选取镜头(×400)倍数下每张石蜡切片不同位置3个适宜外径的肺动脉观察,日本Olympus光学显微镜采图、存储,应用image pro plus 6.0图像分析软件测量:血管总面积(total area,TA)、管腔面积(luminal area,LA)、管壁中线周长(perimeter,P)。得出计算值为:血管半径(radius,R):R=P/2π、血管壁厚度(wall thickness,WT):WT=WA/P、管壁面积(wall area,WA):WA=TA-LA、 血 管 外 径(external diameter,ED):ED=R+WT/2。动脉平滑肌厚度占血管外径的百分比(wall thickness%,WT%):WT%=(2×WT)/ED×100%,平滑肌面积占血管总面积百分比(wall area,WA%):WA%=WA/TA×100%[11]。
1.5 统计学分析 采用SPSS 18.0统计软件分析数据,采用表示计量资料,组间比较采用单因素方差分析;变量相关分析采用Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 患者的一般资料 COPD合并PH组、COPD组和对照组患者在年龄、性别、肺癌类型、吸烟指数、FEV1/FVC比较差异无统计学意义(F=13.386,P>0.05),与对照组相比,COPD合并PH组、COPD组PASP升高(F=9.421,P<0.05),且COPD合并PH组高于COPD组。见表1。

表1 COPD合并PH组、COPD组、对照组间一般资料比较
2.2 3组肺动脉增殖结果 COPD合并PH组与COPD组、对照组WT%、WA%存在组间差异,且差异均有统计学意义(F=3.843、24.115,P值均<0.05),见表2。
表2 COPD合并PH组、COPD组、对照组的肺小动脉面积比较()
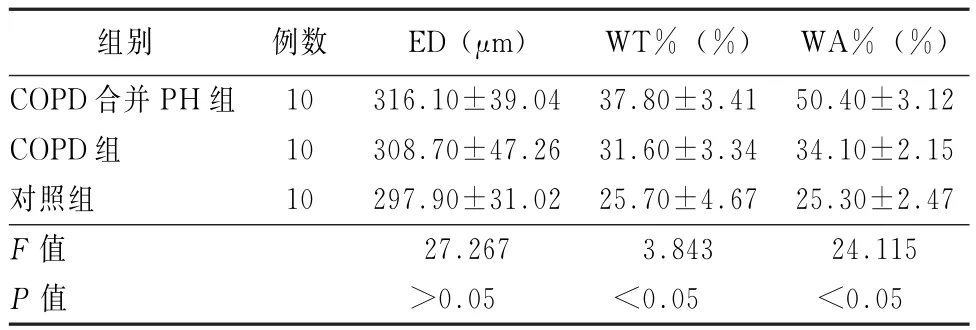
表2 COPD合并PH组、COPD组、对照组的肺小动脉面积比较()
注:PH为肺动脉高压;ED为血管外径;WT%为动脉平滑肌厚度占血管外径的百分比;WA%为平滑肌面积占血管总面积百分比
组别 例数 ED(μm) WT%(%)WA%(%)COPD合并PH组 10 316.10±39.04 37.80±3.41 50.40±3.12 COPD组 10 308.70±47.26 31.60±3.34 34.10±2.15对照组 10 297.90±31.02 25.70±4.67 25.30±2.47 F值 27.267 3.843 24.115 P值 >0.05 <0.05 <0.05
2.3 3组免疫组织化学结果 RYR2、FKBP12.6及CaMK-Ⅱ表达。发现RYR2、FKBP12.6表达及CaMK-Ⅱ表达均以表达于肺血管平滑肌内皮细胞及平滑肌细胞胞浆为主,呈棕黄色,见图1。
根据观察结果,应用机测法及人工计数测量出COPD合 并PH、COPD及 对 照 组 中RYR2、FKBP12.6及CaMK-Ⅱ表达情况,与对照组比较,COPD合并PH组、COPD组RYR2、FKBP12.6及CaMK-Ⅱ的表达IOD均增高(F=9.219、6.143、11.337,P值均<0.05),COPD合并PH组RYR2、FKBP12.6及CaMK-Ⅱ的表达IOD高于COPD组。见表3。
表3 COPD合并PH组、COPD组、对照组RYR2、FKBP12.6及CaMK-Ⅱ表达(IOD值)的比较()
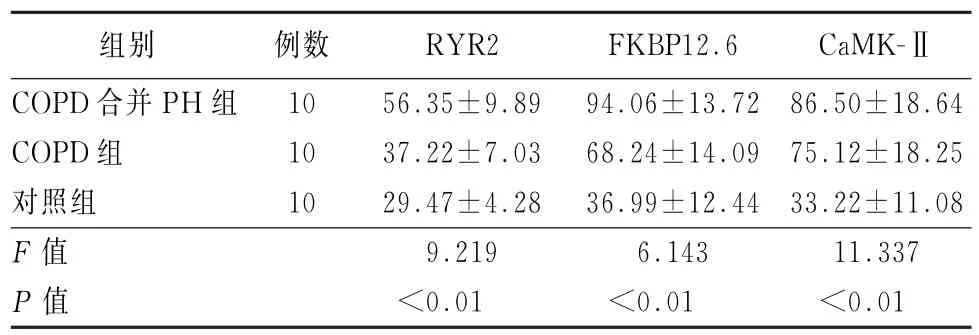
表3 COPD合并PH组、COPD组、对照组RYR2、FKBP12.6及CaMK-Ⅱ表达(IOD值)的比较()
注:PH为肺动脉高压;RYR2为兰尼碱钙通道;FKBP12.6为FK506结合蛋白12.6;CaMK-Ⅱ为钙/钙调蛋白依赖性蛋白激酶Ⅱ
组别 例数 RYR2 FKBP12.6 CaMK-ⅡCOPD合并PH组 10 56.35±9.89 94.06±13.72 86.50±18.64 COPD组 10 37.22±7.03 68.24±14.09 75.12±18.25对照组 10 29.47±4.28 36.99±12.44 33.22±11.08 F值 9.219 6.143 11.337 P值 <0.01 <0.01 <0.01
2.4 相关性分析 COPD合并PH组的RYR2、FKBP12.6及CaMK-Ⅱ 表 达(IOD值)的 与WA%、PASP相关性分析,COPD合并PH组、COPD组RYR2的IOD值与WA%呈正相关(r=0.547、0.771,P值均<0.01),COPD合并PH组RYR2的IOD值 与PASP呈 正 相 关(r=0.773,P<0.01)。COPD合 并PH组、COPD组FKBP12.6的IOD值与WA%呈正相关(r=0.796、0.810,P值均<0.01),COPD合并PH组FKBP12.6的IOD值与PASP呈正相关(r=0.729,P<0.01)。COPD合 并PH组、COPD组CaMK-Ⅱ 的IOD值 与WA%呈 正 相 关(r=0.879、0.504,P值均<0.01),COPD合并PH组CaMK-Ⅱ的IOD值与PASP呈正相关(r=0.748,P<0.01),COPD组的CaMK-Ⅱ的IOD值与PASP呈正相关,但相关性弱(r=0.216,P>0.05)。见表4、5。
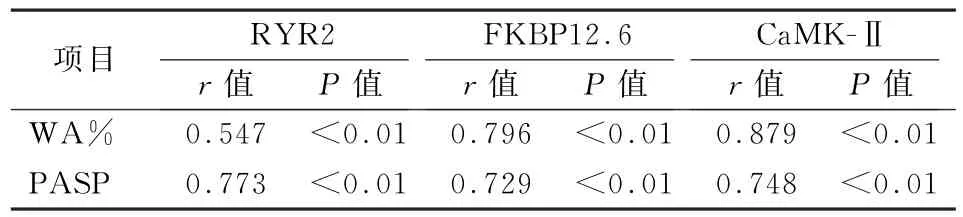
表4 COPD合并PH组RYR2、FKBP12.6及CaMK-Ⅱ表达(IOD值)的与WA%、PASP相关性分析
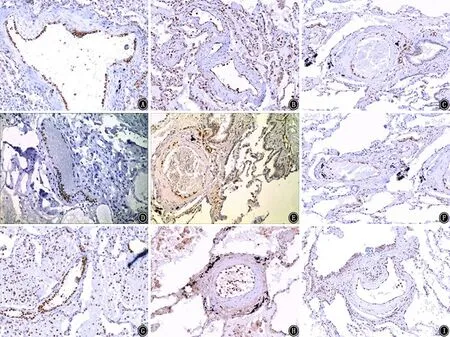
图1 COPD合并PH组、COPD组、对照组免疫组织化学结果图像 免疫组织化学染色 ×400 A:COPD合并PH组FKBP12.6表达;B:COPD组FKBP12.6表达;C:对照组FKBP12.6表达;D:COPD合并PH组RYR2表达;E:COPD组RYR2表达;F:对照组RYR2表达;G:COPD合并PH组CaMK-Ⅱ表达;H:COPD组CaMK-Ⅱ表达;I:对照组CaMK-Ⅱ表达

表5 COPD组RYR2、FKBP12.6及CaMK-Ⅱ表达(IOD值)的与WA%、PASP相关性分析
3 讨论
COPD是严重危害人群的常见慢性呼吸道疾病,目前,COPD相关PH的发病机制尚未完全阐明,临床治疗手段有限。COPD相关PH的主要病理生理基础是缺氧肺血管收缩和缺氧肺血管增殖。研究表明[12-13],慢性缺氧、炎症引起的氧化应激反应在COPD患者肺血管增殖、重塑及PH的形成中起重要的作用。氧化应激的主要产物为活性氧(reactive oxygen species,ROS)[13]。本组前期的研究发现[14],PASMCs线粒体电子传递链复合体可以感受缺氧,引起ROS生成增加;升高的ROS可诱导[Ca2+]i明显升高,导致PASMCs收缩增强。长期反复的肺血管异常收缩进而促进肺小动脉的增殖,最终导致PH的形成[2]。内质网是PASMCs内主要的钙库,多项研究已证实ROS可以开放内质网上RYR2钙通道,使钙库Ca2+释放至胞浆,引起[Ca2+]i升高从而诱发缺氧肺血管收缩[15-16]。PASMCs中[Ca2+]i浓度上升主要有2种方式,一是细胞外Ca2+通过细胞膜钙通道快速大量内流,二是细胞内钙库Ca2+的释放。内质网钙库由RYR2受体钙通道及三磷酸肌醇钙通道控制,研究发现RYR2作用效果是三磷酸肌醇钙通道的50多倍,所以RYR2起更重要的作用[17]。本组研究显示[17],低氧可以触发内质网钙库释放Ca2+,通过RYR2钙通道释放Ca2+在不依赖细胞外Ca2+内流的情况下参与了PH的发病,证明了由RYR2介导的内质网钙释放在PH的发病起部分作用。
FKBP12.6和CaMK-Ⅱ是内质网上RYR2钙通道的主要的调节因子[18]。FKBP12.6是一种相对分子质量为12 600的,可以结合免疫抑制剂FK506及雷帕霉素的免疫亲和素,参与蛋白质的折叠、受体信号通路转导、蛋白交联等多种生命过程。FKBP12.6与RYR2的结合可稳定RYR2钙通道,因此被分别命名为Ca2+通道稳定结合蛋白Calstabin 2。正常情况下FKBP12.6与RYR2结合形成稳态,RYR2钙离子通道关闭,在缺氧、炎症等刺激下,FKBP12.6从RYR2上解离,RYR2钙通道开放,内质网Ca2+大量渗漏,引起[Ca2+]i升高,平滑肌收缩增强,从而诱发一系列病理生理改变。FKBP12.6对RYR2的调控增强在于2个方面:一是通过FKBP12.6的过表达,二是增强FKBP12.6与RYR2的亲和力[19]。而CaMK-Ⅱ是钙离子/钙调蛋白(Ca2+/Ca M)复合体的效应蛋白。其作用是在细胞内钙超载时被Ca2+激活,CaMK-Ⅱ浓度上升,进而磷酸化RYR2,诱导RYR2开放并渗漏Ca2+,进一步加重胞内钙超载程度[20]。
本研究发现,与阴性对照组相比,COPD合并PH组患者、COPD组患者肺血管平滑肌RYR2的免疫组织化学表达水平是升高的,且在COPD合并PH组的表达高于COPD组。在COPD合并PH组患者PASP及WA%与RYR2表达水平的相关性分析提示RYR2的表达水平与PASP、WA%呈正相关。考虑肺动脉压力的升高、肺血管壁的增殖时,胞浆内RYR2的表达水平也是上升的。在基因方面已证实,缺血缺氧可以引起RYR2基因表达水平上升[5]。在多种疾病中发现,因胞浆内Ca2+转运的需求增强,导致了RYR2浓度升高,或其功能增强[20]。其原因可能是胞浆内高浓度的Ca2+可增加自发Ca2+振幅,导致FKBP12.6:RYR2化学计量增加,并增强RYR2钙通道功能[21]。在犬类心肌细胞中发现[22],心力衰竭、心肌缺血时,RYR2的免疫组织化学水平升高。本实验发现,在肺动脉压力升高、肺血管壁增殖的患者肺血管平滑肌中,免疫组织化学检测到的RYR2的表达升高,结合本组既往实验发现通过RYR2钙通道的Ca2+参与了PH的发病,考虑RYR2的表达升高增强了内质网钙渗漏,从而参与了PH的发病,但RYR2钙通道功能是否增强有待进一步研究。
与阴性对照组相比,COPD合并PH组患者、COPD组患者肺血管平滑肌FKBP12.6的免疫组织化学表达水平是升高的,且COPD合并PH组高于COPD组。在COPD合 并PH组PASP及WA%与FKBP12.6表达水平的相关性分析提示FKBP12.6的表达水平与PASP、WA%呈正相关。考虑肺动脉压力升高、肺血管壁增殖时,胞浆内FKBP12.6的表达水平也是上升的。周荣等[23]研究发现,缺氧时大鼠肠系膜上动脉平滑肌FKBP12.6从RYR2的解离,FKBP12.6存在内质网质膜至胞浆的转位,转位后胞浆FKBP12.6浓度明显上升。Liao等[24]在PASMCs中采用免疫荧光标记证实:缺氧产生的ROS可导致PASMCs内FKBP12.6与RYR2的共定位减少,提示ROS可导致在肌浆网上FKBP12.6从RYR2解离,FKBP12.6浓度升高,引发PASMCs的[Ca2+]i的升高,继而血管平滑肌张力升高、PH形成。即FKBP12.6的浓度升高与血管收缩增强、血管内压升高相关。本组通过免疫组织化学方法在COPD患者肺组织中发现了FKBP12.6的表达上升,考虑与FKBP12.6从RYR2上解离增多有关。既往在心肌细胞内的研究早已证实,FKBP12.6的过度表达和心肌细胞增殖、心肌肥厚相关[23]。与本实验发现的FKBP12.6的过表达与血管平滑肌增殖相关一致。但FKBP12.6过表达具体在质膜还是胞浆,及其浓度升高后与RYR2的亲和力的变化,仍有待进一步实验发现。
在与阴性对照结果中发现,COPD合并PH组患者、COPD组患者,CaMK-Ⅱ的免疫组织化学表达水平也是升高的,且在COPD合并PH组的表达高于COPD组。相关性分析提示,在COPD合并PH时CaMK-Ⅱ的免疫组织化学表达增强与WA%、PASP升高相关。原因可能考虑为两个方面:一是CaMK-Ⅱ过表达本身能促进RYR2通道磷酸化,引发RYR2通道构象改变,Ca2+渗漏,平滑肌细胞增殖[25];二是PH时[Ca2+]i的升高引起细胞钙超载,Ca2+/Ca M复合物生成增加,其效应蛋白CaMK-Ⅱ浓度也相应增加[26],且Ca2+信号增强及基因转录速度加快,反复刺激血管收缩增强,导致了平滑肌细胞增殖,引发血管重塑[27-28]。Kashiwase等[29]证明在离体的心肌细胞中过表达的CaMK-Ⅱ与心肌细胞增殖相关。本实验在对肺血管的研究中发现CaMK-Ⅱ过表达与肺血管壁的增殖相关,与上述研究结果一致。
总之,本实验结果提示,COPD合并PH患者FKBP12.6、RYR2及CaMK-Ⅱ过表达与促进血管增殖及肺动脉压力上升存在相关性。FKBP12.6和CaMK-Ⅱ可能在COPD相关的肺动脉增殖中起一定作用。
利益冲突所有作者均声明不存在利益冲突
