YY1通过转化生长因子β1信号轴在滋养细胞功能调控中的探索
2020-02-10鲜舒王艳清程艳香
鲜舒,王艳清,程艳香
适当的胚泡植入和胎盘发育,对于成功妊娠是一个复杂而关键的过程。在正常妊娠期间,滋养层细胞增殖、分化并侵入子宫蜕膜,并伴随着细胞外基质降解和子宫螺旋动脉重塑,确保胚胎有足够的血液供应。滋养细胞浸润不足或子宫脉管系统重塑失败与妊娠并发症相关,如流产和胎儿生长受限等[1-2]。
不明原因的复发性流产(unexplained recurrent miscarriage)是常见的妊娠并发症。近年来,复发性流产发生率为1%~5%,而约40%~60%的复发性流产患者病因尚不明确[3]。目前已有的肝素、被动免疫和孕酮等疗法未能有效改善其妊娠结局[4-6],对家庭和社会人口健康都造成了严重不良影响。因此,更好地了解人类滋养细胞功能的调控和机制,对改善不孕症和妊娠障碍的诊治非常重要。
滋养细胞侵袭是一个受到严格调控的过程,受细胞因子、生长因子和细胞外基质的成分等影响[7]。Yin Yang-1(YY1)是一种锌指转录因子,参与胚胎发育、肿瘤发生和转移等过程的调节[8-9]。Tian等[10]的研究初步揭示了YY1-基质金属蛋白酶2(MMP-2)在滋养细胞侵袭中全新的调节途径,认为滋养层细胞的迁移和侵袭类似于肿瘤转移。Yan等[11]的研究表明,YY1可通过转化生长因子β(TGF-β)信号通路调节肿瘤细胞的生物学行为。TGF-β家族由同种型TGF-β1、-β2和-β3组成,且以组织特异性方式表达[12]。TGF-β1在各种生理病理过程中具有多功能的作用,且TGF-β1能抑制滋养细胞的侵袭能力[13-15]。
迄今为止,YY1是否能够调控人滋养层细胞中TGF-β1的表达,TGF-β1是否介导了YY1对人滋养层细胞侵袭的抑制作用仍是未知。本研究结果证实了YY1可以通过TGF-β1信号通路调控滋养层细胞的活性、侵袭和迁移能力,可能参与胚胎的着床和胎盘发育,致使流产的发生。
1 材料与方法
1.1 研究材料 人滋养层细胞系HTR8/SVneo,购自武汉阿斯本生物技术有限公司(ASPEN)。小干扰RNA(siRNA)——YY1以及阴性对照由广州市锐博生物科技有限公司构建;转染试剂lipofectamine 2000购自Invitrogen公司;胎牛血清、DMEM F12培养液购自HyClone公司;TGF-β抑制剂SD-208购自 Selleck 公司;Trans-well小室(Corning,3422);光学显微镜(OLYMPUS,IX51)、荧光定量聚合酶链反应(PCR)仪(Life technologies,StepOneTM Real-Time PCR System)。提取 RNA的Trizol购自 Invitrogen公司;反转录试剂盒(ELK Biotechnology公司,货号EQ002);实时荧光定量PCR引物由TaKaRa公司设计并合成。
1.2 试验方法
1.2.1 细胞培养、转染及分组 HTR8/SVneo细胞培养于含P/S抗生素、10%胎牛血清的DMEM/F12培养基中,每24 h换1次。将细胞按4×105/孔接种在6孔板,待融合度达60%~70%时进行siRNA转染48 h。转染分组:YY1敲低(siYY1)和正常表达(阴性对照,NC)组,靶序列分别如下。siYY1-1:5’-CGACGACTACATTGAACAA-3’;siYY1-2:5’-CAAAGATGTTCAGGGATAA-3’;siYY1-3:5’-GAACTCACCTCCTGATTAT-3’。药物处理分组:NC 组、siYY1组和 siYY1+SD-208(TGF-β抑制剂,1 μmol/L,48 h)组。
1.2.2 实时荧光定量PCR检测各组中基因的表达情况 用Trizol试剂抽提总RNA,用紫外分光光度计和2%的琼脂糖凝胶测定其纯度、浓度和完整性。用M-MLV Reverse Transcriptase合成cDNA。使用SYBR®Premix Ex TaqTM试剂盒,在StepOne®Real-Time PCR仪上进行检测,3个复孔,实验重复3次。引物序列见表1。
1.2.3 蛋白质印迹(Western blotting)检测各组蛋白的表达水平 分别提取各组细胞总蛋白,BCA法测定蛋白浓度,依次进行电泳、转膜、封闭、一抗孵育和二抗孵育,最后应用ECL化学发光检测试剂盒检测蛋白表达情况,采用AlphaEaseFC软件分析目标条带的光密度值。实验重复3次。

表1 引物序列
1.2.4 CCK-8细胞活性实验 将对数生长期细胞,以1×104细胞/孔铺96孔板,24 h细胞贴壁后弃培养液,加入100 μL含药培养基,对照为药物溶剂的培养基,空白为无细胞培养液孔。继续培养24 h后,所有孔中加入10 μL CCK-8溶液,培养箱中孵育1 h。酶标仪测定450 nm吸光度,并计算细胞存活率。细胞存活率=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。每个样品均做3个复孔,实验重复3次。
1.2.5 划痕迁移实验 在6孔板背后每孔均匀画3条平行线,横穿过孔。将2.5×105细胞/孔接种24 h贴壁长满后,用枪头垂直于预先画的横线划掉细胞,磷酸盐缓冲液(PBS)轻轻漂洗后加入无血清培养基继续培养,分别于0、12、24 h取出孔板,拍照。实验重复3次。
1.2.6 Trans-well侵袭实验 无菌条件下,取50 μL matrigel和培养基的1∶3比例稀释液,均匀铺于Trans-well小室上层后干燥过夜。将200 μL 105个/mL处理后的细胞悬液(无血清培养液)加入Trans-well小室中,再将小室放入每孔500 μL完全培养基的24孔板中,37℃下培养24 h。将小室取出,无菌棉签擦去上室内的基质胶和细胞,4%多聚甲醛固定,结晶紫染色,显微镜下观察5个视野中穿膜细胞数。实验重复3次。
1.3 统计学方法 采用SPSS 13.0软件对研究数据进行统计分析。定量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t法。所有检验均以P<0.05为差异有统计学意义。
2 结果
2.1 YY1调控滋养细胞的细胞活性、迁移和侵袭能力 为揭示YY1参与流产发生的具体分子机制,构建了siYY1作用于滋养细胞HTR8/SVneo,验证对滋养细胞的影响。如图1A所示,在构建的3条siRNA中,siYY1-3效率最高,用于后续实验。实时荧光定量PCR检测发现细胞外基质重塑相关基因MMP-2和MMP-9表达显著降低,而TIMP1和TIMP2表达显著增加(见图1B)。进一步检测细胞功能发现细胞活性、细胞迁移和侵袭能力都明显减弱(见图1C~E)。以上结果都证实了YY1对于滋养细胞功能的重要作用。
2.2 YY1调控滋养细胞TGF-β1信号通路相关基因的表达 为了揭示YY1与TGF-β1的关系,运用GTRD (Gene Tranion Regulation Database,http://gtrd.biouml.org/)数据库进行转录因子与靶基因预测,发现YY1在TGF-β1基因上有多位点结合,见图2A(见封三)。进一步进行Real-Time PCR和Western blotting检测发现,在滋养细胞中敲低YY1后,TGF-β1信号通路相关分子TGF-β1、Smad2和Smad3的表达都显著增高,而抑制性Smad7的表达却降低(见图2B和2C,见封三)。提示YY1可能直接通过TGF-β1信号通路相关基因的表达来调控滋养细胞的功能。
2.3 YY1可能通过TGF-β1信号通路调控滋养细胞的迁移能力 为了验证上述结果,本研究在滋养细胞中敲低YY1后使用TGF-β特异性抑制剂SD-208处理细胞,随后进行细胞划痕实验检测细胞的迁移能力。结果发现敲低YY1能显著降低细胞的迁移能力,而用TGF-β抑制剂SD-208处理后能够显著改善细胞的迁移能力(见图3)。这种抑制剂的反转作用说明YY1可能通过TGF-β1信号通路发挥对滋养细胞功能的调控作用。

图1 YY1调控滋养细胞的细胞活性、迁移和侵袭能力
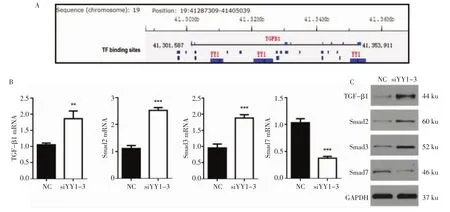
图2 YY1调控滋养细胞TGF-β1信号通路相关基因的表达

图3 YY1通过TGF-β1信号通路调控滋养细胞的迁移能力

图4 YY1通过TGF-β1信号通路调控滋养细胞的侵袭能力和细胞活性
2.4 YY1通过TGF-β1信号通路调控滋养细胞的侵袭能力和细胞活性 运用预先matrigel处理的Trans-well小室检测细胞的侵袭能力。敲低YY1后细胞的侵袭能力和细胞活性显著降低,而用TGF-β抑制剂SD-208处理后,细胞侵袭能力和细胞活性显著增强(见图4,见封三)。
3 讨论
滋养层细胞的增殖、迁移和侵袭被精确调控,这是胚胎成功植入和胎盘发育的先决条件,然而复杂的分子机制尚未完全揭示。TGF-β1及其受体在人滋养层细胞中表达,并调节滋养层细胞功能[16],且在绒毛膜癌中TGF-β1和TβRI的水平显著降低,表明TGF-β信号传导途径的紊乱可能是导致滋养层细胞恶变的因素[17]。与先前研究结果[18]一致,本文笔者所在课题组的实验结果也证实了TGF-β1可以改变MMP的表达来抑制滋养层细胞的侵袭。TGF-β1可通过多种信号传导途径抑制滋养层细胞的侵袭,但其上游信号传导途径仍不明确。滋养细胞显示出与恶性肿瘤细胞相似的表型,本研究发现YY1敲低可以上调TGF-β1表达,且人滋养层细胞迁移和侵袭能力被显著抑制,而使用TGF-β1抑制剂可逆转siYY1对滋养细胞活性、迁移和侵袭的抑制作用。这提示了YY1-TGF-β1信号通路调控人滋养层细胞侵袭的新机制。在本研究中,由YY1-TGF-β1信号通路调节的侵袭抑制与MMP-2和MMP-9表达的降低相关。TIMP是组织中MMP活性的主要内源性抑制剂,YY1敲低显著增加了滋养细胞中TIMP1和TIMP2的表达,其反过来抑制MMP-2/9活性并减少滋养层侵袭。这些结果提示了YY1-TGF-β1可能是通过影响MMP的活性来发挥对滋养细胞功能的调控作用。
TGF-β通过获得性免疫耐受在外周免疫系统中起关键作用[19-21]。耐受性对于预防不适当的免疫反应至关重要,且是子宫免疫环境的重要组成部分,能够使胚胎成功植入和维持正常妊娠状态。TGF-β可以抑制对妊娠有害的T辅助细胞1型(Th1)反应[22],并且阻断TGF-β信号传导可以增强胎儿NK细胞对靶细胞的反应[23]。因此,来自子宫内膜和滋养层细胞的内源性TGF-β的平衡状态可能有助于建立抗排斥策略从而允许半同种异体胚胎植入。因此,YY1-TGF-β1信号通路是否在母胎界面的免疫耐受环境的建立中发挥作用需要进一步探索。
总之,本研究首次发现YY1可以调节人滋养层细胞中TGF-β1的表达,并证明YY1-TGF-β1信号通路参与调控滋养细胞活性、迁移和侵袭,滋养层侵袭能力的减弱可能与MMPs活性的降低有关。这些发现证明了YY1-TGF-β1调控滋养细胞功能的新机制,也为不明原因的复发性流产等妊娠相关疾病的诊治提供了新策略。
