DR5、FADD在子宫肌瘤组织中的表达水平及意义
2020-02-10唐亮王敏张利军王梅肖燕
唐亮,王敏,张利军,王梅,肖燕
子宫肌瘤是妇科最常见的良性肿瘤,在育龄期妇女中的发病率高达20%~25%[1]。临床症状为月经紊乱、疼痛、白带增多、腹部包块及不孕症等。目前子宫肌瘤的发病机制尚未明确,探寻子宫肌瘤发病的分子及细胞机制具有现实意义。肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis ligand,TRAIL)属于肿瘤坏死因子超家族成员,死亡受体 5(death receptor5,DR5)是一种 TRAIL 特异性受体,TRAIL通过与其死亡受体DR4和DR5结合,选择性地诱导多种肿瘤细胞凋亡[2]。凋亡促进蛋白(Fas-associating protein with a novel death domain,FADD)是一种死亡域蛋白,与Fas胞浆区呈特异性结合,故又名Fas相关死亡结构域蛋白[3]。FADD介导多种死亡受体诱导的凋亡信号传导通路,在凋亡信号转导过程中起承上启下的作用[4]。细胞凋亡调节异常会导致各种疾病,如免疫失调、恶性肿瘤等。近年对DR5和FADD在子宫肌瘤中作用机制的研究较为少见,本研究将着重探讨DR5和FADD在子宫肌瘤中的表达情况以及临床意义,以期为两者在子宫肌瘤中的作用机制的研究提供参考。
1 对象与方法
1.1 临床资料 选取2017年3月—2018年5月在本院进行子宫肌瘤切除术的72例患者作为研究对象,年龄30~56岁,平均(43.82±6.84)岁;将手术切除的子宫肌瘤组织为肌瘤组织组,距离肿瘤边缘5 cm以外的瘤旁组织为瘤旁组织组。纳入标准:①根据《子宫肌瘤的诊治中国专家共识》临床指南[5]且术后病理诊断为子宫肌瘤者;②年龄≥18岁;③术前6个月内未接受激素治疗;④无其他盆腔病变者。排除标准:①合并其他恶性肿瘤疾病者;②合并血液系统疾病者;③合并严重心肝肾功能不全者。本研究经本院伦理委员会批准,组织样本的获取均取得研究对象的知情同意。
1.2 主要仪器与试剂 RNA提取试剂盒及逆转录试剂盒均购自于北京天根生化有限公司;实时荧光定量聚合酶链反应(real-time quantitative reverse transcription PCR,qRT-PCR)试剂盒购自德国QIAGEN公司;兔抗人FADD多克隆抗体、兔抗人DR5多克隆抗体均购自美国Zymed公司;免疫组织化学通用试剂盒购自武汉博士德生物工程公司;TUNEL细胞凋亡原位检测试剂盒购自凯基生物科技发展公司。
1.3 研究方法
1.3.1 样品采集 收集手术切除的肌瘤组织作为样本,同时采集距离肿瘤边缘5 cm以外的瘤旁组织为对照样本。所有收集的组织样本分为两部分,一部分保存于-80℃中用于RNA抽提,另一部分制作石蜡切片。
1.3.2 qRT-PCR法测定子宫肌瘤组织中DR5和FADD mRNA表达量 从-80℃取出保存的样本,提取组织总RNA:将样本超声匀浆,按照RNA提取试剂盒的说明书提取总RNA,检测RNA的纯度以及完整度;逆转录反应:将所得RNA用反转录试剂盒反转录为cDNA,严格依据说明书进行操作,产物置于-20℃冰箱保存备用。qRT-PCR反应体系20 μL:10 μL 2×SYBR Mix,上下游引物各 1 μL,cDNA 模板 1 μL,H2O 7 μL,每个样品做3个重复,反应条件为95℃反应30 s,95℃反应 15 s,60℃反应 30 s,40个循环,72℃延伸 10 min,在qRT-PCR仪上进行反应。其中DR5上游引物:5’-GGGAGCCGCTCATGAGGAAGTTGG-3’,下游引物:5’-GGCAAGTCTCTCTCCCAGCGTCTC-3’,FADD 上游引物:5’-GTGAAGACCCAGCAGGAAGC-3’,下游引物:5’-ACGCCACAGTGGTTGAGCAT-3’,两者均以β-actin为内参,上游引物:5’-CTCGTCATACTCCTGCTTGCTG-3’,下游引物:5’-CGGGACCTGACTGACTACCTC-3’。使用 ΔΔCt法对结果进行相对定量分析,根据各样本的平均Ct值,采用2-ΔΔCt法计算DR5和FADD mRNA相对表达量。
1.3.3 免疫组织化学法检测子宫肌瘤组织中DR5和FADD蛋白的表达情况 将石蜡切片脱蜡后,分别在100%、95%、80%、70%乙醇中孵育2~3 min,经蒸馏水漂洗后在3%H2O2常温孵育10 min,抗原热修复,柠檬酸盐缓冲液中加热5 min,磷酸盐缓冲液(PBS)清洗,加入山羊血清孵育15 min,滴加适当比例稀释的一抗湿盒中孵育过夜,PBS清洗3遍,加入二抗孵育25 min,PBS清洗,滴加辣根酶标记链霉卵白素工作液常温孵育10 min,DBA显色液进行显色反应,染色成功后,蒸馏水冲洗,在苏木素中复染1 min,蒸馏水冲洗后置于1%盐酸中5 s,继续用蒸馏水冲洗,最后分别置于70%、80%、95%、100%乙醇中脱水3 min,进行透明处理后,封片镜检。DR5蛋白位于细胞的细胞质中,偶可表达于细胞膜,但细胞核不着色,呈现黄色或棕黄色颗粒状为阳性表达;细胞不着色则为阴性表达。FADD蛋白位于细胞膜及细胞质上,呈黄色、棕黄色颗粒状表达为阳性;FADD蛋白表达缺失则为阴性。
1.3.4 末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(terminal dexynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)检测细胞凋亡 TUNEL法显示的凋亡细胞呈棕褐色,散在分布,核浓缩,胞体变小,大小不等,染色质沿核膜呈半月形边集或碎裂成片。凋亡指数(apoptosis index,AI)的计算:每张切片连续选取5个高倍(×200)视野,计算平均凋亡细胞所占细胞总数的百分比,即AI=凋亡细胞数/细胞总数×100%;增殖指数(prolifer-ationindex,PI)的计算:每张切片连续选取5个高倍(×200)视野,计算平均增殖细胞所占细胞总数的百分比,即PI=增殖细胞数/细胞总数×100%。
1.4 统计学方法 采用统计学软件SPSS24.0对数据进行分析,定量资料以均数±标准差(±s)表示,组间比较采用两独立样本均数的t检验;定性资料用率表示,组间比较采用卡方检验;Pearson法分析各组数据的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 2组DR5和FADD mRNA的表达情况 肌瘤组织组DR5 mRNA的表达量高于瘤旁组织组,FADD mRNA的表达量低于瘤旁组织组,差异有统计学意义(P<0.05),见表 1。
表1 子宫肌瘤组织中DR5和FADD mRNA的表达(±s)

表1 子宫肌瘤组织中DR5和FADD mRNA的表达(±s)
组别 n DR5/β-actin FADD/β-actin瘤旁组织组 72 4.61±0.99 2.18±0.56肌瘤组织组 72 2.49±0.68 4.23±0.97 14.978 15.530 P 0.000 0.000 t
2.2 2组DR5和FADD蛋白表达情况 肌瘤组织组DR5蛋白的阳性表达率高于瘤旁组织组,差异有统计学意义(P<0.05);FADD蛋白的阳性表达率低于瘤旁组织组,差异有统计学意义(P<0.05),见表2。
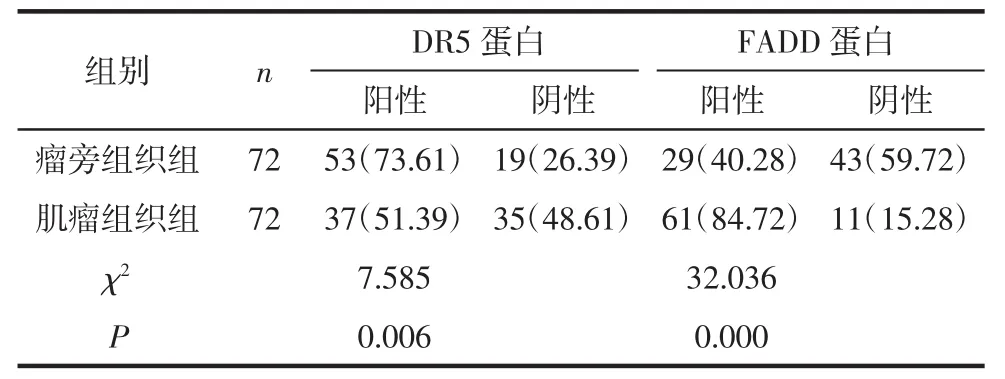
表2 子宫肌瘤组织中DR5和FADD蛋白阳性表达率例(%)
2.3 子宫肌瘤细胞凋亡及增殖检测 本研究中采用TUNEL法,用辣根酶结合卵白素取代荧光素结合抗体,标记后的细胞在光镜下核呈棕黄色或棕褐色。子宫肌瘤组织中细胞弥散分布,可见凋亡小体的形成;在瘤旁组织中,也存在少量的凋亡细胞。见图1(见后插一)。肌瘤组织组AI低于瘤旁组织组,瘤旁组织组PI低于肌瘤组织组,差异均有统计学意义(P<0.05),见表3。

图1 子宫肌瘤细胞凋亡图(TUNEL法×400)
表3 2组细胞凋亡及增殖率(%) (±s)
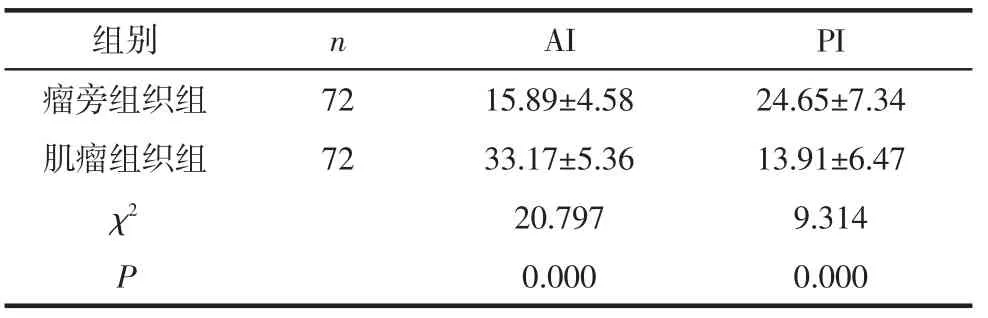
表3 2组细胞凋亡及增殖率(%) (±s)
组别 n A I P I χ 2 2 0.7 9 7 9.3 1 4 P 0.0 0 0 0.0 0 0瘤旁组织组 7 2 1 5.8 9±4.5 8 2 4.6 5±7.3 4肌瘤组织组 7 2 3 3.1 7±5.3 6 1 3.9 1±6.4 7
2.4 DR5和FADD mRNA的表达与子宫肌瘤细胞凋亡、增殖的关系 Pearson法分析结果显示,在子宫肌瘤组织中,DR5表达与AI呈负相关(r=-0.431,P=0.000),与 PI呈正相关(r=0.508,P=0.000);FADD表达与 AI呈正相关(r=0.642,P=0.000),与 PI呈负相关(r=-0.500,P=0.000)。
2.5 子宫肌瘤组织中DR5与FADD的关系Pearson法分析结果显示,子宫肌瘤组织中DR5与FADD 呈负相关(r=-0.556,P=0.000),见图 2。
3 讨论
子宫肌瘤是一种女性育龄期生殖系统良性肿瘤,可引发下腹疼痛、子宫异常出血及盆腔压迫等症状,损伤女性的生殖系统,增加子宫切除的风险,加重患者的经济负担,对患者的生活质量和生殖健康带来极大的影响。然而目前子宫肌瘤的确切病因尚不十分清楚。
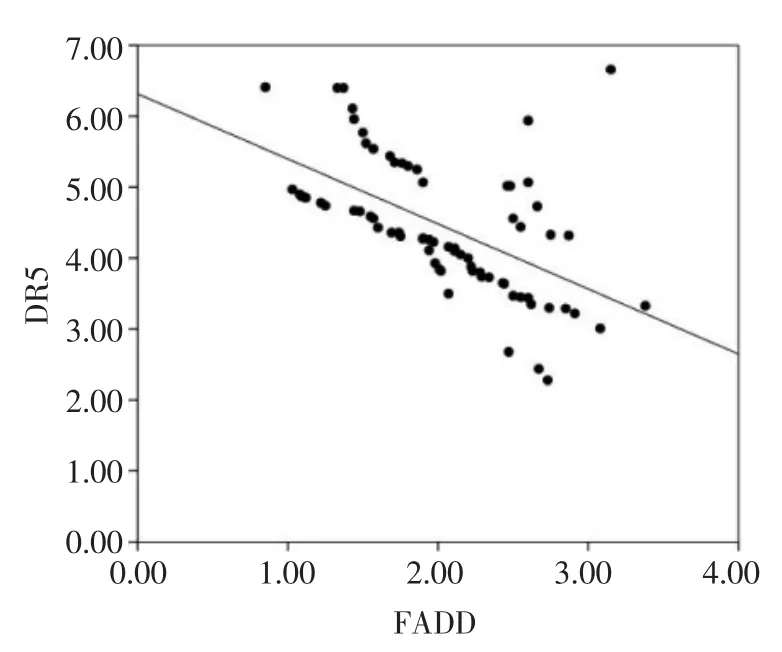
图2 子宫肌瘤组织中DR5与FADD的相关性
TRAIL有4种高亲和力的受体,分别是死亡受体DR4和DR5,诱导受体DcR1和DcR2;与TRAIL结合在细胞凋亡过程中发挥重要作用。其中DR4和DR5与TRAIL结合后诱导细胞凋亡;DcR1和DcR2缺乏内源性死亡结构域,与TRAIL结合后再与DR竞争结合TRAIL而保护细胞[6],因此TRAIL受体的表达水平影响细胞凋亡。外来的配体与DR5相结合时,可选择性地杀伤肿瘤细胞或转化细胞[7],但DR5本身对肿瘤的影响尚不明确。研究表明,DR5在多种肿瘤细胞中高表达,而在正常细胞中表达较少[8]。本研究中DR5mRNA和蛋白阳性率表达升高,提示DR5在子宫肌瘤的发展过程中水平升高可能影响细胞凋亡从而影响疾病的发生发展,可能受到某些因子的调控,从而发生子宫肌瘤组织的细胞凋亡逃逸。
人FADD基因定位于11号染色体11q13.3处,由2个外显子和1个内含子组成,是一种胞质蛋白,其羧基末端能与Fas蛋白的胞内区结合,氨基末端则是引起死亡信号转导的必需成分,因此FADD可诱导细胞凋亡信号传导通路从而诱导细胞凋亡[9]。当FADD蛋白表达异常或功能丧失时,Fas/Fas L结合后的促细胞凋亡信号不能有效地转导,细胞凋亡被阻止[10]。细胞凋亡调节异常会导致多种疾病,如免疫失调、恶性肿瘤等,FADD基因DD区或DED区发生缺失,亦无法诱导细胞凋亡[11]。研究显示,FADD基因的过表达能促进恶性脑胶质瘤细胞的凋亡[12];但在膀胱癌、宫颈癌等组织中表达水平较低,造成细胞凋亡异常[13]。本研究结果显示,肌瘤组织FADD基因mRNA和蛋白阳性率的表达低于瘤旁组织,提示FADD水平降低使细胞凋亡发生异常,从而影响疾病进程。
有报道指出死亡受体DR5诱导细胞凋亡需要依赖于FADD和半胱氨酸蛋白酶8(caspase-8)[14]。TRAIL通过与死亡受体DR4或DR5结合,从而使受体细胞内的DD活化,并与FADD的羧基端结合;FADD通过其氨基端的DED与半胱天冬酶8前体(procaspase-8)上的DED结合,从而形成了TRAILDR4/DR5-FADD-procaspase-8,即 DISC[15]。DISC 可促使procaspase-8形成有活性的凋亡起始蛋白caspase-8。活化的caspase-8释放到人的胞质中从而激发一系列下游的caspase-3等级联反应,最终诱发细胞凋亡。但当FADD水平降低时,会阻碍DISC的形成,从而影响caspase-8的活化,最终导致细胞凋亡受限。本研究结果显示,肌瘤组织AI低于瘤旁组织,PI高于瘤旁组织,提示子宫肌瘤组织中细胞凋亡降低、增殖升高。肌瘤组织DR5表达与AI负相关、与PI正相关,FADD表达与AI正相关、与PI负相关,提示DR5和FADD与子宫肌瘤细胞凋亡、增殖密切相关,影响细胞凋亡、增殖;肌瘤组织DR5与FADD呈负相关,提示子宫肌瘤组织中细胞凋亡减弱、加速细胞增殖从而加速疾病进程,可能是FADD表达下降,使DR5与FADD的结合受阻,影响凋亡蛋白的激活,从而使细胞凋亡减弱、细胞增殖加速,进而调控子宫肌瘤的发生发展。
综上所述,子宫肌瘤组织中DR5高表达、FADD低表达,且与子宫肌瘤凋亡密切相关。DR5与FADD两者负相关,共同参与子宫肌瘤的发生。但本研究并未深入探究DR5、FADD在凋亡过程中的具体机制,存在一定的不足。可能随着对DR5、FADD等抑癌基因、癌基因的调控机制的阐明,将有利于子宫肌瘤发病机制的明确,并为子宫肌瘤的诊治提供更为准确的理论支持。
