膜联蛋白A8在卵巢上皮性浆液性肿瘤中的表达及临床意义
2020-02-10朱连成勾睿郭骞李潇刘娟娟于冠楠郝莹莹严丽梅金山林蓓
朱连成,勾睿,郭骞,李潇,刘娟娟,于冠楠,郝莹莹,严丽梅,金山,林蓓
上皮性卵巢癌作为女性生殖系统常见的恶性肿瘤,其死亡率最高、预后最差,大部分患者发现时已经是晚期,目前尚缺乏早期诊断的可靠生物学标记物,其中上皮性浆液性癌是最常见的病理类型,因此探寻卵巢癌发生、发展、转移、耐药等机制可为卵巢癌早期诊断、综合治疗提供新的方法及治疗靶点[1]。膜联蛋白(Annexin)是一类至少12种基因编码的Ca2+依赖性磷脂结合蛋白家族,广泛参与了细胞信号转导、胞吞及胞外分泌、细胞分化、凋亡、钙离子通道形成、生长发育和抗凝血反应等[2]。近些年来发现,膜联蛋白A参与了肺癌、肝癌、结肠癌、胰腺癌、乳腺癌、膀胱癌、子宫内膜癌、宫颈鳞癌、卵巢癌等的侵袭、转移、血管生成、耐药等[3-6]。作为膜联蛋白家族成员之一,膜联蛋白 A8(Annexin A8,ANXA8)参与急性早幼粒细胞白血病[7]、胰腺癌[6,8-9]、乳腺癌[10-11]等肿瘤的发生、发展。但迄今为止,ANXA8在卵巢肿瘤中的表达情况及与上皮性卵巢癌相关性的研究国内外少见报道。本研究拟利用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结法(SP法)检测ANXA8在正常卵巢、卵巢浆液性良性肿瘤、卵巢浆液性交界性肿瘤和卵巢浆液性癌组织中的表达情况,探讨其与卵巢上皮性浆液性癌患者临床病理参数间的关系及预后的相关性,为深入研究ANXA8对卵巢癌生物学行为的影响及作用机制提供前期理论依据。
1 资料与方法
1.1 标本来源 收集中国医科大学附属盛京医院(我院)妇科2008—2012年住院患者手术切除的卵巢组织石蜡标本共75例,所有组织切片病理诊断均由我院病理科专家完成,其中正常卵巢组织组11例(来源于因罹患子宫肌瘤或宫颈癌无生育要求而切除全子宫双附件者),卵巢浆液性良性肿瘤组13例,卵巢浆液性交界性肿瘤组17例,卵巢浆液性恶性肿瘤组34例(均为原发性肿瘤,术前均未行放化疗、生物或激素治疗,术中均行全面分期探查术或卵巢癌肿瘤细胞减灭术,术后随访资料完整)。所有患者术前均签署知情同意书。
所有患者中位年龄50.0(43,61)岁,其中正常卵巢组织组中位年龄44.0(40,51)岁,卵巢浆液性良性肿瘤组中位年龄50.0(45,57)岁,卵巢浆液性交界性肿瘤组中位年龄43.0(35,51)岁,卵巢浆液性恶性肿瘤组中位年龄58.5(48,63)岁,各组年龄比较差异无统计学意义(Z=1.985,P=0.124)。卵巢浆液性恶性肿瘤组中年龄<60岁者19例;根据组织病理分化分级:高-中分化及低分化分别为20例和14例;按照2009年国际妇产科联盟(FIGO)临床病理学分期标准分期:FIGOⅠ期5例,Ⅱ期5例,Ⅲ期23例,Ⅳ期1例;盆腔和(或)腹主动脉旁淋巴结转移者11例;盆腹腔残余病灶直径>1 cm者17例。
1.2 主要试剂 兔抗人ANXA8多克隆抗体购自Abcam公司(Cambridge,英国),免疫组织化学试剂盒购自福州迈新生物工程公司,其他试剂及设备由我院妇产科实验室提供。
1.3 检测方法 所有卵巢组织标本均采用5 μm连续切片,采用SP法检测ANXA8的表达。兔抗人ANXA8抗体的工作浓度为1∶75。每批切片中均设阳性和阴性对照,阳性对照使用结肠癌组织,阴性对照使用以磷酸盐缓冲液(PBS)替代一抗染片。染色方法按SP试剂盒说明书进行。
1.4 染色结果判定标准 随机选取切片中5个高倍视野,以细胞质内、细胞膜上有棕黄色颗粒着色为阳性。按照着色强度分为不着色、淡黄、棕黄、棕褐,分别计分为 0、1、2、3 分;观察着色细胞所占整张切片组织的百分比为0%~5%、6%~25%、26%~50%、51%~75%、76%~100%,分别计分为 0、1、2、3、4 分;两项相乘得到该切片最终评分,0~2、3~4、5~8、9~12分并分别标记为-、+、++、+++,其中+++及++认为是高表达,+及-认为是低表达。实验阅片过程中,为了控制误差,由2位研究者分别独立阅片,当出现结果不一致时由第3位研究者再次阅片并集体讨论判断。
1.5 随访 用住院资料及电话联系的方法对所有卵巢浆液性恶性肿瘤组患者进行随访。末次随访日期为2017年9月30日,计算患者的总生存时间(OS),OS指自手术日期开始至患者因疾病死亡或至随访截止时间。
1.6 统计学方法 采用SPSS 22.0和Graph Pad Prism 8.0.0进行统计学分析及图片制作。定量资料正态分布的数据用均数±标准差(±s)表示;非正态分布的数据用中位数(M)和百分位数(P25,P75)表示,采用秩和检验。定性资料用例(%)表示,组间比较用卡方检验;不符合卡方检验条件的数据用Fisher确切概率法。多组间等级资料比较采用秩和检验。生存分析采用Kaplan-Meier法,以Log-Rank法分别对各种临床病理参数进行单因素分析,用Cox回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 ANXA8在各组卵巢组织中的表达 ANXA8以细胞膜、细胞质着色为主,在各组卵巢组织中均可检测到表达,见图1(见后插一)。ANXA8在各组卵巢组织中的表达有差异(Z=25.315,P<0.001),表达强度随着肿瘤恶性程度的进展逐渐增高。而正常卵巢组织组、卵巢浆液性良性肿瘤组和卵巢浆液性交界性肿瘤组的ANXA8表达差异无统计学意义(Z=2.476,P=0.290)。见表1。

图1 ANXA8在各种卵巢组织中的表达 (免疫组织化学染色×20)
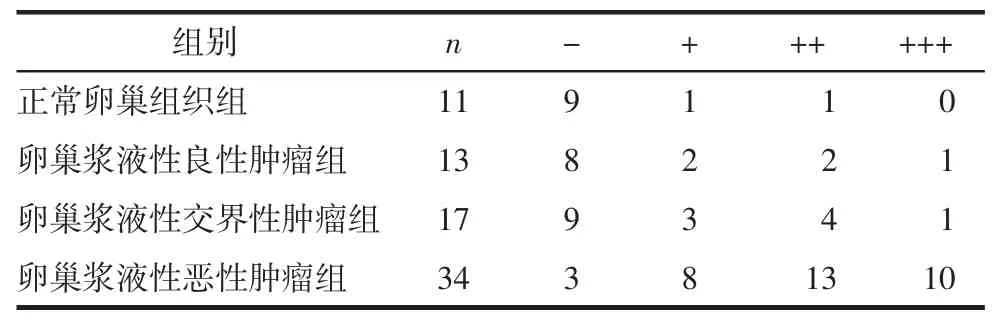
表1 ANXA8在各组卵巢组织中的表达情况
卵巢浆液性恶性肿瘤组的ANXA8阳性表达率(31/34,91.18%)高于正常卵巢组织组(2/11,18.18%)、卵巢浆液性良性肿瘤组(5/13,38.46%)及卵巢浆液性交界性肿瘤组(8/17,47.06%),差异有统计学意义(均P<0.001)。类似的,ANXA8在卵巢浆液性恶性肿瘤组中的高表达率(23/34,67.65%)明显高于正常卵巢组织组(1/11,9.09%)、卵巢浆液性良性肿瘤组(3/13,23.08%)及卵巢浆液性交界性肿瘤组(5/17,29.41%),差异有统计学意义(P分别为<0.001、0.007、0.010)。
2.2 ANXA8表达与卵巢浆液性恶性肿瘤临床病理参数的关系 FIGOⅢ~Ⅳ期患者的ANXA8的高表达率明显高于FIGOⅠ~Ⅱ期患者,差异有统计学意义(P<0.001);盆腹腔残余病灶直径>1 cm患者的ANXA8高表达率明显高于残余病灶≤1 cm患者,差异有统计学意义(P=0.010)。虽然年龄≥60岁组、低分化组及淋巴结转移组ANXA8的高表达率均高于年龄<60岁、高-中分化组及无淋巴结转移组,但差异均无统计学意义(均P>0.05),见表2。
2.3 ANXA8的表达与卵巢浆液性恶性肿瘤患者预后的关系 34例卵巢浆液性恶性肿瘤患者在随访期间内死亡16例,存活15例,失访3例,入组时间为24~111个月,患者平均生存期为80.6个月(95%CI:69.2~92.1)。Kaplan-Meier生存分析表明,FIGO分期、淋巴转移、残余病灶、ANXA8的表达都是影响OS的重要因素(均P<0.05),见表3和图2(见后插一)。将单因素分析中对预后有统计学意义的4个指标纳入到Cox多元回归模型分析中表明,ANXA8的高表达是影响卵巢浆液性恶性肿瘤患者预后的独立危险因素(P=0.019,HR=11.465,95%CI:1.498~87.757)。

图2 卵巢浆液性恶性肿瘤患者Kaplan-Meier生存分析曲线
3 讨论
膜联蛋白是一类至少由12种基因编码的钙离子结合蛋白,能和带负电荷的膜磷脂相结合,广泛分布于动植物的组织与细胞内,其在细胞总蛋白中占比高达 1%~2%,超家族分为 A、B、C、D、E 5类,其中A类在脊椎(哺乳)动物中表达,又分为A1~A11、A13共12种亚型[3,12],B类家族存在于非哺乳动物,C类家族存在于单细胞真核生物和真菌,D类家族存在于植物,E类家族存在于原生生物。
近年发现膜联蛋白参与了肿瘤的发生、发展。ANXA2在肺癌、肝癌、结肠癌、乳腺癌、膀胱癌、子宫内膜癌、宫颈鳞癌、卵巢癌的组织及细胞中表达上调[4,13-14],而在输卵管癌中表达降低,且与不良预后相关[15],其参与了肿瘤发生、发展、侵袭、转移及耐药过程,甚至可以作为肝癌、胰腺癌及子宫内膜癌的预后指标[4]。ANXA4参与了卵巢透明细胞癌的增殖、迁移和耐药[16],其岩藻糖基化修饰可增强与核因子κB(NF-κB)P50的相互作用,从而促进卵巢癌细胞肿瘤的进展[1]。ANXA5的表达与结肠癌的淋巴转移及更差的期别相关[5],其低表达能促进胃癌细胞的增殖[17],还可通过影响钙黏蛋白(E-cadherin)和基质金属蛋白酶9(MMP-9)的表达促进宫颈癌HeLa细胞的迁移和侵袭能力[18]。ANXA7在子宫内膜异位症组织中高表达[19],其可通过影响黏附相关分子[黏着斑激酶(FAK)、类固醇受体辅助活化因子(Src)、E-cadherin等]基因与蛋白表达水平改变小鼠肝癌细胞Hca-P细胞生物学行为[3],ANXA7下调能够通过影响细胞周期调节因子和 MMP-1、MMP-2、细胞间黏附分子 1(ICAM-1)而抑制胃癌细胞增殖、迁移及浸润[20]。ANXA11受抑制后可能通过抑制胸腺嘧啶脱氧核苷合成酶(TS)、B细胞淋巴瘤2(bcl-2)的表达提高胃癌细胞对氟尿嘧啶(5-Fu)的敏感性[21],其可通过蛋白激酶B/糖原合成酶激酶3β(AKT/GSK-3β)途径调节胃癌的增殖、迁移及浸润[22]。

表2 ANXA8表达与卵巢浆液性恶性肿瘤患者临床病理参数的关系
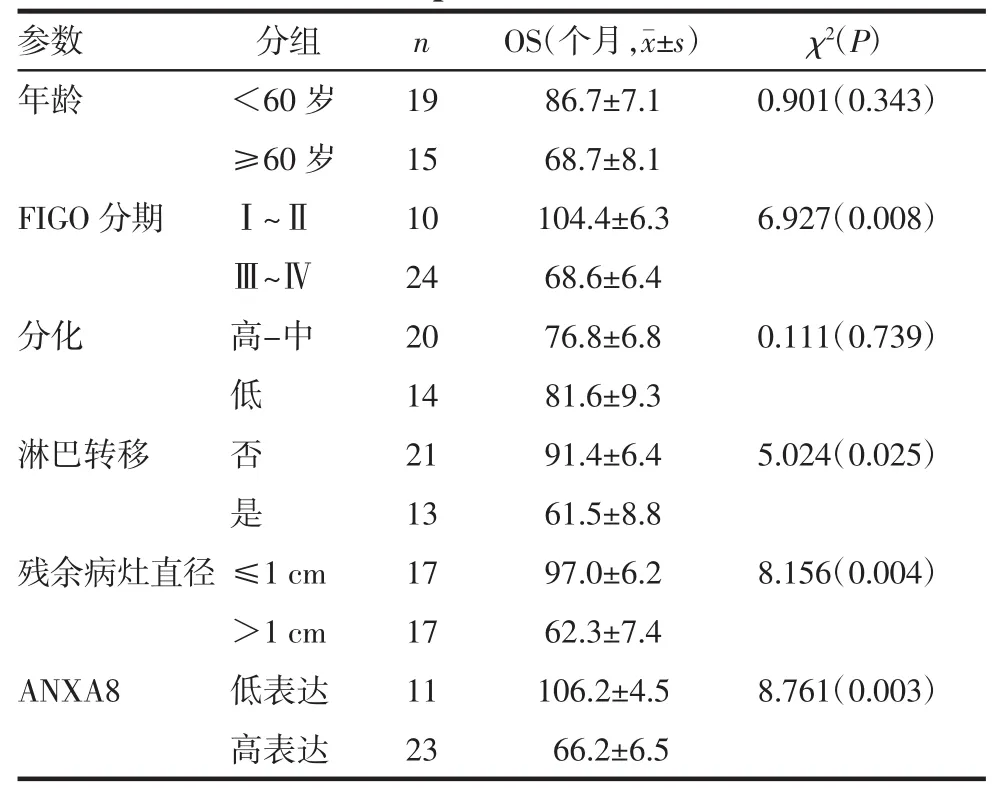
表3 34例卵巢浆液性恶性肿瘤患者的临床病理特征及预后的单因素Kaplan-Meier生存分析
目前关于ANXA8在肿瘤中作用的研究较少。最早开始于1992年,研究者们发现ANXA8的基因表达在急性早幼粒细胞白血病中特异性增高[7],其在白血病细胞的分化、增生、信号转导中起到了一定作用[23]。2008年,研究者通过基因芯片技术发现ANXA8在原发浸润性导管胰腺癌中高表达,可作为预后、诊断的指标及治疗的靶点[8]。近些年的研究逐步发现,ANXA8在胰腺癌中能够促进癌细胞的活性、迁移及集落形成,其高表达与更晚的分期及更差的预后相关[6]。ANXA8在口腔鳞状细胞癌患者颈部转移淋巴结中[24]、糖尿病口腔鳞癌患者唾液中[25]、宫颈鳞状细胞癌组织中[26]及乳腺原位导管癌组织[10]中均表达上调,其表达与乳腺癌患者的肿瘤分期、分级、淋巴转移、雌激素受体(ER)阴性、肿瘤细胞3D成型等相关[10-11],且可作为早期诊断的标记物[27]。还有研究发现,同 ANXA1、ANXA2、ANXA6 一样,ANXA8 以 Ca2+依赖方式与磷脂酰肌醇和F肌动蛋白相互作用,参与表皮细胞生长因子(EGF)受体定位,ANXA8的消耗损害EGF降解,导致丝裂原活化蛋白激酶(MAPK)激酶的持续激活[28]。在胰腺癌中,ANXA8通过钙信号传导诱导缺氧诱导因子1α(HIF-1α)的转录激活,导致血管内皮生长因子(VEGF)活化[9]。锌指转录调节因子2(ZIC2)可调控ANXA8使其高表达,进而调节细胞的增殖、凋亡和迁移[29]。在乳腺原位导管癌中,全反式视黄酸(RA)协同全反式视黄酸受体α(RARA)共同作用于ANXA8调节区域的视黄酸-反应元件(RARE),两者形成 RA-RARA-ANXA8反馈环路参与乳腺癌的异常形态形成[11]。在膀胱癌中,ANXA8与VEGF-C的表达相关[30]。在肝胆管型肝癌细胞中,ANXA8可由EGF-叉头框转录因子O4(FOXO4)信号通路参与上皮间质转化(EMT)[31]。在宫颈鳞癌中,ANXA8与细胞角蛋白5(CK5)共同参与角质细胞分化和p53介导的凋亡途径[26]。
但是迄今为止,尚无关于ANXA8在卵巢癌发生、发展中研究的报道,本研究发现随着肿瘤病变程度的进展,ANXA8的阳性表达率逐渐增高,差异有统计学意义,提示ANXA8参与卵巢上皮性浆液性癌的发生与发展。进一步研究发现,ANXA8高表达与FIGO分期晚、盆腹腔残余病灶直径大及预后差相关,且ANXA8高表达是影响卵巢癌患者预后的独立危险因素。以上发现均为ANXA8在卵巢癌中的作用机制提供了参考,同时也提示ANXA8有望成为判断预后的指标。当然,由于本项研究样本量较少,结论难免有所偏差,尚需后续大样本的研究进一步探讨。
Zhu等[32]对高表达及低表达人附睾蛋白4(HE4)的卵巢癌细胞系进行基因芯片分析,寻找与HE4相关的差异表达基因,发现ANXA8随着HE4基因受抑制而呈现低表达,差异有统计学意义(倍数变化-1.430),提示两者存在某种程度的相关性;同时还发现与HE4相关的差异表达基因中包括HIF1A(倍数变化 1.649)、FOXO4(倍数变化-1.087)、ZIC2(倍数变化-1.290)等。前文中已经讨论了这些基因通过ANXA8参与了肝癌的EMT[31]、胰腺癌的增殖凋亡[9,29]等,这些结果提示HE4可能在以上蛋白的协同下与ANXA8相互作用,从而促进卵巢癌的发生、发展,前期基因芯片的通路分析已经提示HE4差异表达基因主要参与了MAPK、p53等信号通路的激活[32-33],而上文已经讨论了ANXA8在MAPK激酶的持续激活[28]及p53介导凋亡[26]中起到了作用,故而有理由推测HE4与ANXA8的相互作用可能通过激活下游的MAPK、p53等信号通路而影响卵巢癌恶性生物学行为。以上推测为后续进一步的实验研究提供了理论参考。
