体外膜肺氧合技术对脑心双死亡器官捐献供肝的保护作用
2020-02-09丁利民李新长罗文峰杨小刚黄小梅徐志丹
丁利民,李新长,罗文峰,杨小刚,黄小梅,徐志丹
江西省人民医院 器官移植科,南昌 330006
脑心双死亡器官捐献(donation after brain death plus cardiac death,DBCD)在器官获取之前因全身血流动力学不稳定,会引起组织缺氧、酸中毒、细胞间稳态破坏、炎性通路大量激活而造成器官功能不同程度的损伤,供肝质量较传统供肝、亲属活体来源差[1-2],因此切实做好公民逝世捐献器官功能评估、器官功能保护及临床应用是当前亟需解决的难题。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是以体外循环系统为基本设备,采用体外循环技术进行操作和管理的一种中、短期心肺辅助治疗技术,可替代心、肺功能,为全身的组织器官提供血流灌注和氧供。ECMO主要用于严重呼吸和心功能不全患者的过渡支持治疗,近年来也应用于难以纠正的心脏停搏患者,在公民逝世后器官捐献中逐步得到应用及推广[3]。本文对运用ECMO技术成功实施DBCD供肝移植及常规DBCD肝移植患者的临床资料进行总结,并分析探讨供肝保护及移植的效果。
1 资料与方法
1.1 研究对象 收集本院2015年1月-2018年12月运用ECMO技术完成DBCD肝移植供者/受者及常规DBCD肝移植供者/受者的临床资料。纳入供者均根据《中国心脏死亡器官捐献工作指南(第2版)》[4]实施死亡判定。纳入受者术后常规用药方案基本相同,主要包括:预防感染、抗排斥、抑酸护胃、护肝、抗凝、支持等,出院后患者均在本院常规随访。本研究方案经由江西省人民医院伦理委员会审批(批号:2015029),患者家属均签署知情同意书。
1.2 ECMO技术 首先由脑死亡判定小组判定脑死亡,家属签署放弃治疗同意书及捐献志愿书,拔除气管插管停用升压药,应用ECMO等待心脏停跳。在超声引导下分别经股动、静脉ECMO插管,行股静脉和股动脉ECMO原位体内灌注。管道准备完成后启动ECMO,ECMO流量维持50~75 ml·kg-1·min-1,ECMO吸入氧浓度为50%~60%,给予肝素行全身抗凝处理。运用彩超监测肝动脉、门静脉血流情况。心脏停跳宣布死亡后留取血液标本检测肝肾功能。完成腹主动脉、门静脉插管开始进行器官冷灌注时停止运行ECMO。肝肾器官获取后于0~4 ℃保存。
1.3 统计学方法 采用SPSS19.0统计软件进行数据分析。计量资料以±s表示,2组间比较采用t检验;计数资料2组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 肝移植供者一般资料 共纳入一般情况及肝功能接近的供者32例,其中男26例,女6例,年龄21~64岁,BMI平均(21.33±3.22)kg/m2。肝移植供者中原发病颅脑损伤14例,自发性脑出血17例,良性脑瘤并脑干功能衰竭1例,4例供者接受过心肺复苏(2例接受过1次心肺复苏,2例接受过2次心肺复苏)。将32例供者分为对照组(常规DBCD肝移植)和研究组(运用ECMO技术完成DBCD肝移植),每组各16例。2组性别比、年龄、BMI、冷热缺血时间、捐献前未运用ECMO时肝功能比较,差异均无统计学意义(P值均>0.05)(表1),具有可比性。
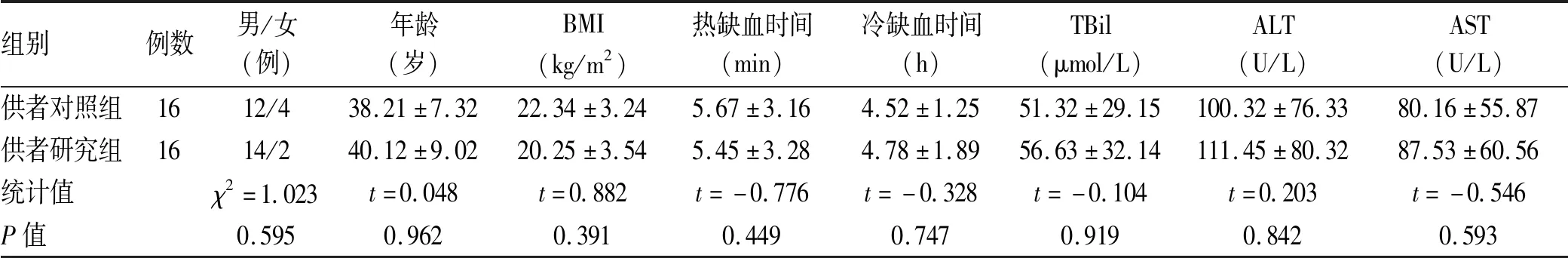
表1 肝移植供者一般资料
2.2 肝移植受者一般资料 32例肝移植受者中男27例,女5例,年龄35~62岁,BMI平均(23.43±2.85)kg/m2。将32例肝移植受者分为对应的对照组和研究组,每组各16例。受者对照组中原发疾病为肝恶性肿瘤10例,乙型肝炎肝硬化失代偿期4例,肝豆状核变性1例,急性重症肝炎1例。受者手术采用经典原位肝移植13例,背驮式肝移植3例。受者研究组中原发疾病为肝恶性肿瘤9例,乙型肝炎肝硬化失代偿期5例,酒精性肝硬化1例,急性重症肝炎1例。受者手术采用经典原位肝移植12例,背驮式肝移植4例。两组性别比、年龄、肝肾功能、凝血功能、术前MELD评分、供肝重量与受者体质量比(GRWR)等比较,差异均无统计学意义(P值均>0.05)(表2),具有可比性。
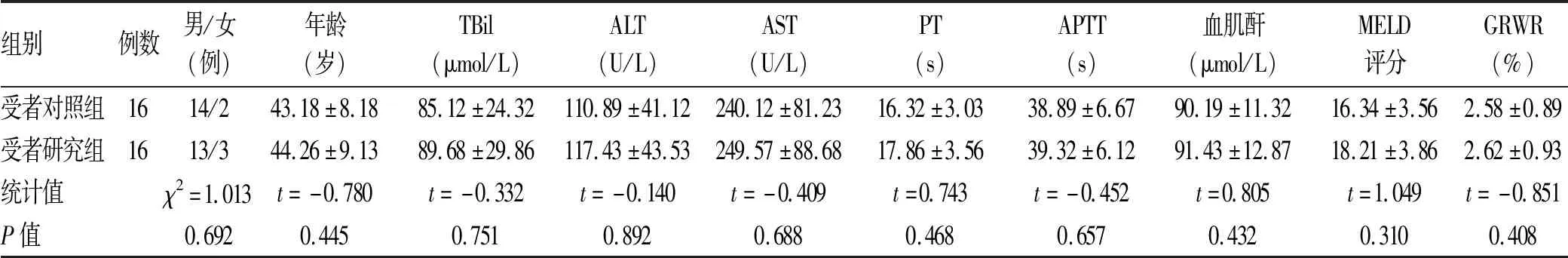
表2 肝移植受者一般资料
注:PT,凝血酶原时间;APTT,活化部分凝血活酶时间。
2.3 肝移植供者对照组和研究组器官获取前各项指标的比较 结果显示,DBCD供者应用ECMO后生命体征、血流动力学变化、乳酸水平、中心静脉压、定时监测的肝功能均得到明显改善,对照组与研究组相比,差异均有统计学意义(P值均<0.05)(表3)。

表3 肝移植供者研究组与对照组器官获取前各项指标的比较
2.4 肝移植术后第7天研究组和对照组受者情况比较 32例肝移植受者无手术死亡,未发生原发性移植肝无功能。与对照组受者术后第7天肝功能相比,研究组受者应用ECMO获取供肝肝移植术后肝功能恢复速度更快,患者住院时间明显缩短(P值均<0.05)(表4)。
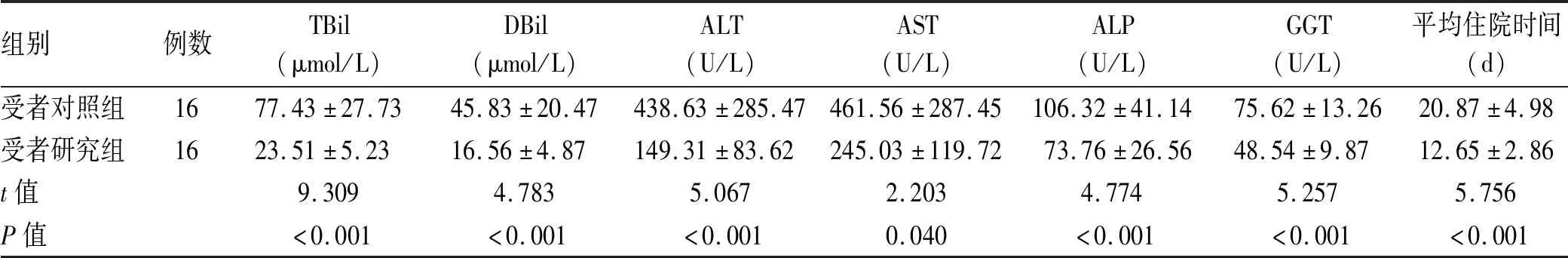
表4 对照组与研究组受者肝移植术后第7天情况比较
3 讨论
DBCD供者从拔除气管插管或停止呼吸机、停用升压药至心脏停跳5 min宣布死亡,再到器官获取冷灌注开始,供者器官不可避免经历热缺血损伤,多数DBCD热缺血时间至少超过15~18 min。临床上ECMO作为一种有效的心肺支持治疗手段,可以减轻心肺功能负荷,有效改善低氧血症,增加心排血量,改善全身循环灌注,维持心肺循环稳定。在移植领域,相对于传统的器官保护措施,ECMO的优势在于:(1)热缺血早期通过自体血再循环提供氧气和营养,改善酸中毒,减轻器官的热缺血损伤;(2)部分恢复机体能量储备的能力,降低器官炎症因子表达水平,减轻氧化应激损伤;(3)保持移植器官组织中的谷胱甘肽处于较低水平,降低移植物的氧化应激水平,维持肝组织中腺苷和黄嘌呤高水平表达,从而保护DBCD供肝细胞功能,抑制缺血-再灌注损伤引起的移植后肝细胞癌的复发与生长;(4)能够对供体器官进行更加精确、即时的评估,为器官获取和移植手术提供充分的准备时间[5-6]。ECMO在有效且迅速改善低氧血症和低灌注方面具有明显的优越性,为实体器官的功能保护提供了技术保障[7-9]。
DBCD供者常见的临床表现为低血压、低心排出量、低心脏每搏输出量、低血容量,最终出现恶性或顽固的低血压,其血流动力学特点常常是严重的“低排低阻”,呈现以分布性休克为核心的多种类型混合的特点,基本机制是血管收缩舒张功能调节异常。DBCD供者如果不接受任何支持性治疗,极容易导致获取供肝失败[9]。本研究发现,供者研究组应用ECMO后生命体征、血流动力学变化、乳酸水平、中心静脉压、定时监测的肝功能均得到明显改善,供者心率下降至正常范围,血压及动脉血气氧分压好转,与对照组供者相比,差异有统计学意义(P值均<0.05),证实了运用ECMO技术获取供肝可有效提升DBCD供肝质量,在改善低氧血症和低灌注方面具有其独特的先进性。肝移植术后第7天研究组受者肝功能(主要包括TBil、DBil、ALT、AST、ALP、GGT)恢复理想,表明应用ECMO有利于DBCD供肝移植功能的早期恢复。本研究中32例受者总体上恢复较好,这与术前严格供肝评估及受者选择有一定关系,移植受者MELD评分大部分在15~25分,GRWR均大于1%,避免了小肝综合征的发生[10-12]。
自2015年以来,国家正全力推动公民逝世后自愿捐献器官,国内外研究[13-15]表明,公民逝世器官捐献供肝术后各种并发症的发生率显著高于传统的尸体供肝,移植肝的长期存活率较前明显下降,延长了移植受者的住院时间并增大了受者的经济负担。如何在肝移植术前改善DBCD供肝质量,是目前肝移植领域亟待解决的难题。DBCD供者的最终血流动力学特征是有效循环血容量明显降低和器官组织低灌注,导致器官功能受损,其中组织细胞缺氧是最重要的损伤作用机制。因此,公民逝世后供肝功能保护的目标应是纠正组织细胞缺氧和偿还氧债。ECMO为实质性器官功能保护提供了根本的理论和技术保障——氧气供应和灌注,ECMO模式不仅可避免器官热缺血损伤且没有伦理学争议,还能在体修复器官功能[16],故合理使用ECMO技术保护供肝质量,对我国公民逝世器官捐献工作有着积极的作用[17-18]。当前笔者在DBCD供肝移植工作中应用ECMO技术取得了良好的临床效果和初步的临床经验,该成果将有助于改善DBCD供肝移植的远期疗效,但本研究开展移植量偏少,有待在今后的临床工作中进一步探索及总结。
