21例T细胞大颗粒淋巴细胞白血病的临床分析及文献回顾
2020-02-07董玉婷周敏然李淼马荷花王冉秦雪梅陈春燕
董玉婷 周敏然 李淼 马荷花 王冉 秦雪梅 陈春燕
T细胞大颗粒淋巴细胞白血病(T-cell large granular lymphocytic leukemia,T-LGLL)为一种少见的淋巴系统增殖性疾病,以大颗粒T 淋巴细胞(T-cell large granular lymphocyte,T-LGL)克隆性增殖为特点。表现为慢性病程,血常规检查常表现为一系或两系细胞减少,粒细胞减少较为常见。T-LGLL 常合并自身免疫性疾病,如类风湿关节炎、系统性红斑狼疮、纯红细胞再生障碍性贫血等,通常采用免疫抑制治疗。本研究回顾性分析2009年2月至2019年12月山东大学齐鲁医院收治的21 例T-LGLL 患者的临床及实验室检查资料,通过对T-LGLL 患者临床特征、细胞形态学、免疫学方面等资料的总结,探讨TLGLL的临床特征、治疗方案及预后情况。
1 材料和方法
1.1 病例资料
回顾性分析2009年2月至2019年12月山东大学齐鲁医院21 例T-LGLL 患者的临床及实验室检查资料,其中男性16例,女性5例,男女比约为3∶1。年龄为29~77岁,中位年龄59岁。依据文献方法诊断[1]。
1.2 方法
1.2.1 临床资料 性别,年龄,症状(乏力、腹痛腹胀、腹部包块、纳差、出血、感染、发热、体重减轻),体征(脾肿大、肝肿大、淋巴结肿大),合并的自身免疫性疾病。
1.2.2 实验室检查资料 血常规检查,血沉,乳酸脱氢酶,β2 微球蛋白,骨髓细胞学检查,骨髓病理学检查(包括免疫组织化学),免疫分型检查,基因重排检测,染色体核型检测等。
1.2.3 治疗方案 治疗药物,剂量,是否停药/换药,停药/换药原因。
1.3 疗效评估
1.3.1 评估时间 接受治疗6 个月后进行血常规检查以评估血液学反应。
1.3.2 评估标准 1)血液学完全缓解(hematological complete remission,HCR):ANC>1.5×109/L,血小板计数>150×109/L,淋巴细胞计数<4×109/L,且循环中LGL计数在正常范围内;2)血液学部分缓解(hematological partial remission,HPR):血细胞计数有改善,但未达到完全缓解标准,或输血需求量减少但仍依赖输血;3)治疗失败或疾病稳定(stable disease,SD):患者在开始治疗后的4个月内未达到上述标准,但血细胞计数无恶化,则表明疾病稳定或治疗失败;4)疾病进展(progressive disease,PD):血细胞计数进一步恶化或发现肝脾肿大较前进展。
2 结果
2.1 临床特征
21例患者中18例初诊时有临床症状,其中61.9%患者出现乏力或疲劳,活动力较前下降,5例(23.8%)患者出现腹部不适或可触及腹部包块,1例(4.8%)患者有出血情况,为牙龈渗血,无严重的器官脏器出血,其初诊时伴有血小板减少(43×109/L);6例(28.6%)患者出现感染,5例出现肺部感染并有发热,其中1例患者有曲霉菌感染证据,另外1例为反复口腔溃疡;出现体重减轻的4例患者(19%),体重减轻的范围为3~10 kg。体格检查方面,61.9%患者出现脾肿大,23.8%患者有淋巴结肿大,其中3例有浅表淋巴结肿大,2例影像学检查可见纵隔或腹部及腹膜后淋巴结肿大。21例T-LGLL患者中,6例(28.6%)合并自身免疫性疾病,4例合并纯红细胞再生障碍性贫血(pure red blood cell aplastic anemia,PRCA),2例合并自身免疫性溶血性贫血(autoimmune hemolytic anemia,AIHA),其中1例同时合并PRCA和AIHA,1例同时合并PRCA和类风湿关节炎(rheumatoid arthritis,RA)。详见图1,表1。

图1 21例T-LGLL患者临床特征
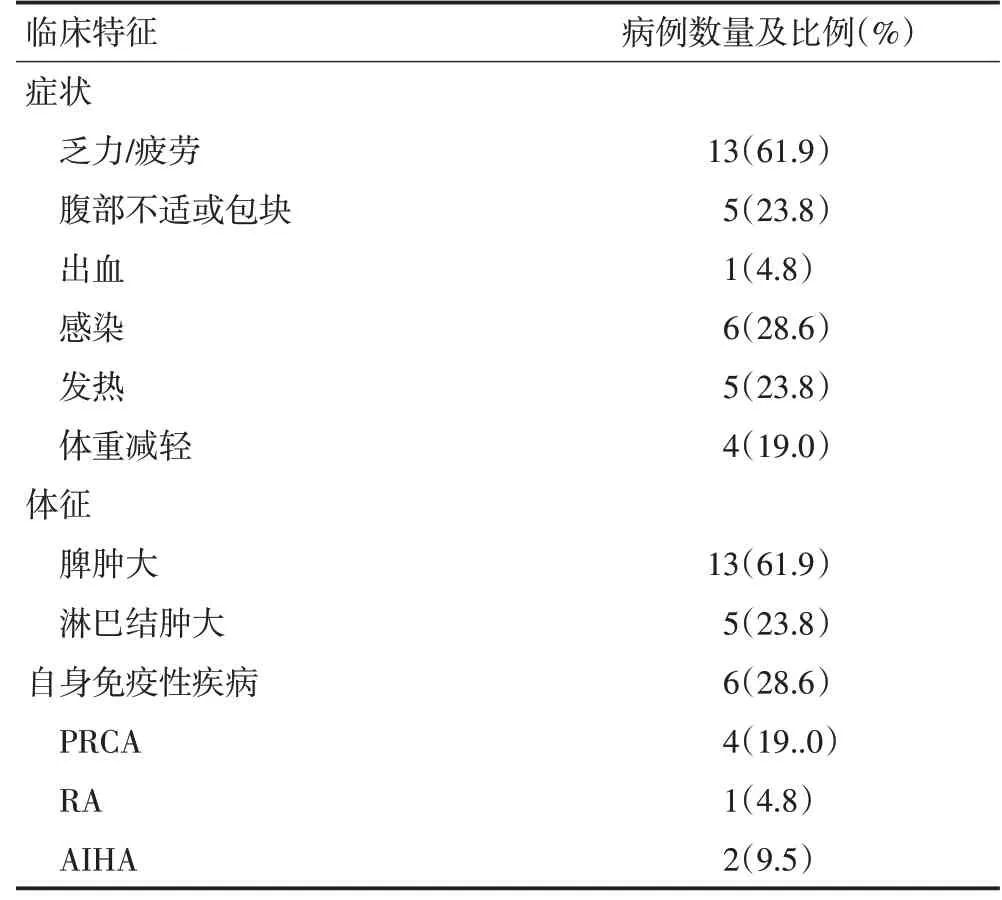
表1 21例T-LGLL患者的临床特征
2.2 实验室检查
2.2.1 血常规检查 21例患者初诊时血常规检查均有异常表现,白细胞计数的中位数为4.22×109/L,白细胞减少者9 例(42.9%),白细胞增多者5 例(23.8%);9 例(42.9%)患者出现粒细胞减少,无粒细胞缺乏(ANC<0.5×109/L)患者。外周血中淋巴细胞比例的中位数为58.6%,12 例(57.1%)患者超过50%。超过70%患者出现贫血,其中1 例为轻度贫血,其余14 例均为中重度贫血。血小板减少者4 例(19.0%)。详见图2,表2。
2.2.2 骨髓检查 21例患者均行骨髓穿刺检查。有16 例(76.2%)骨髓和(或)外周血涂片中可见大颗粒淋巴细胞数量增多,骨髓活检可见骨髓增生活跃或低下,淋巴细胞增多,粒系、红系增生受抑,巨核细胞数量、形态多无明显异常,无病态造血改变。其中2例患者骨髓活检可见纤维组织广泛增生,合并骨髓纤维化,1 例为MF-3 级且合并JAK2-V617F 基因突变,考虑同时合并原发性骨髓纤维化。


表2 21例T-LGLL患者的实验室检查特征
2.2.3 免疫分型 20 例患者进行了免疫分型检测,其中16例(80%)淋巴细胞呈CD3+CD4-CD8+,符合典型T-LGLL 免疫表型特征,另有1 例呈CD3+CD4-CD8-,2 例呈CD3+CD4+CD8+。多数患者表达CD57+,占93.8%,40%患者表达CD16+。45.4%患者表达CD3+CD56+。8例患者中7例为TCRαβ 阳性表达,仅1例表达TCRγδ,与文献报道基本相符。
2.2.4 基因重排 18例患者行TCR基因重排检测,其中16例为阳性,总检出率为88.9%。PCR方法检测TCR重排共检测出15例阳性,其中,TCRβ阳性率为55.6%,TCRγ阳性率为72.2%,TCRδ阳性率为14.3%。2例患者行流式细胞术检测TCR-Vβ(flow cytometry,FC-Vβ),其中1例患者PCR测定TCR重排均为阴性,流式细胞术检测CD3+CD8+T细胞TCRVβ24个亚家族比例,其中Vβ1占52.58%,比例明显增高,显示T细胞呈单克隆增殖;另1例患者TCRβ重排阴性,TCRγ及TCRδ重排阳性,FC-Vβ结果显示TCRVβ24个亚家族比例减低,间接提示其单克隆性。由此可见,FC-Vβ可做为T细胞克隆学证据的补充。
2.2.5 其他 10 例患者进行骨髓细胞遗传学检测,仅1 例检出add(3)(q29)克隆性异常,其余9 例均为正常核型。3 例患者抗核抗体阳性,均为低滴度阳性。1例患者各类免疫球蛋白均降低,基因突变检出ICOS 纯合突变,符合普通变异型免疫缺陷病Ⅰ型诊断,是一种常染色体隐性遗传病,考虑T-LGLL 为其继发性疾病。
2.3 治疗和预后
2.3.1 治疗方案 1例无治疗指征,其余20例接受治疗:14例应用以环孢素为主的免疫抑制治疗方案,其中5例单用环孢素治疗,8例加用糖皮质激素治疗,1例加用糖皮质激素和甲氨蝶呤治疗;2例应用环磷酰胺为主的治疗方案,其中1例单用环磷酰胺治疗,1例加用糖皮质激素治疗;2例应用COP方案化疗1个周期后序贯口服环孢素治疗;2例单用糖皮质激素治疗。
2.3.2 治疗效果及预后 20例接受治疗的患者随访至今,中位随访时间为28(4~134)个月,2 例失访,4例死亡,其余14 例生存至今。治疗6 个月后对治疗效果进行评估,20例患者总有效率为60%,血液学完全缓解率为20%,部分缓解率为40%。应用环孢素治疗的14例中2例获得血液学完全缓解,5例获得部分缓解,其中1例部分缓解后因合并间质性肺炎死亡;3例疾病稳定,其中1例合并原发性骨髓纤维化依赖输血生存,频率约2 U/周,1例为普通变异型免疫缺陷病Ⅰ型继发T-LGLL,规律注射免疫球蛋白25 g/月及口服环孢素、糖皮质激素治疗,间断给予升白细胞治疗,维持疾病稳定;4 例治疗效果不佳,疾病进展,其中2例改为口服甲氨蝶呤治疗,另2例分别于诊断后2 个月及17 个月因严重感染死亡。应用环磷酰胺治疗的2 例中1 例获得部分缓解后长期生存,1 例因胃肠道反应停药后改为环孢素治疗,6 个月后部分缓解。应用COP方案+环孢素治疗的2例均完全缓解后生存至今。2例单用泼尼松治疗的患者均疾病进展,1例更换COP方案2个周期后口服甲氨蝶呤,后失访,1 例加用环孢素治疗后仍效果欠佳,于确诊后4 个月因多器官衰竭死亡。
3 讨论
T-LGLL 为一种慢性淋巴细胞增殖性疾病,本研究21例病例从出现不适症状到诊断明确的中位时间为5(0.2~96.0)个月,可见T-LGLL起病隐匿,疾病进展缓慢,临床上对该疾病尚缺乏足够的认识及重视。T-LGLL 常出现血细胞减少,多为单系的中性粒细胞减少或血红蛋白减低,血小板减少者较少见,最主要的临床表现为粒细胞缺乏导致的感染、贫血导致的乏力等。Sanikommu 等[2]报道204 例患者,46%出现粒细胞减少,40%出现贫血,24%出现脾肿大,本研究病例中贫血患者较多,达71.4%,与上述报道不符。但是Yok-Lam 等[3]的报道将亚洲与西方国家的T-LGLL 患者进行对比,发现西方国家患者出现中性粒细胞减少较多,而亚洲患者出现贫血的频率较高,其中的机制尚未明确。T-LGLL 的病因及具体发病机制仍未明确,可能与淋巴细胞增殖和淋巴细胞凋亡的失衡有关。正常情况下,外界或自身抗原激活免疫系统,引起细胞毒性T 细胞(cytotoxic T lymphocytes,CTLs)大量激活,导致特异性淋巴细胞的克隆性增殖。大部分活化的淋巴细胞在抗原清除后发生凋亡,这一过程称为活化诱导的细胞死亡(activationinduced cell death,AICD)[4],该过程是维持自身抗原耐受性的重要机制。AICD 过程大部分是通过Fas/FasL介导的细胞凋亡机制来实现的,T-LGLL患者中大颗粒淋巴细胞虽然持续高表达Fas/FasL[5],但Fas依赖的凋亡途径出现抵抗,且Fas 未发生基因突变,表明其调亡信号转导通路被抑制。此外,Ras-MEK1-ERK信号传导途径[6]和PI3K-Akt信号传导途径[7]的过度激活可促进大颗粒淋巴细胞的增殖,从而导致T-LGLL 的发生。Koskela 等[8]首先通过全外显子测序发现,在T-LGLL 患者中,40%存在STAT3 基因突变,Jerez 等[9]报道在T-LGLL 中STAT3突变达到70%。另有报道显示,部分LGLL患者会出现STAT5b突变[10]。突变导致STAT 持续性活化,从而促进大颗粒淋巴细胞的增殖和存活,引发LGLL。
由于T-LGLL 的发生发展与免疫系统失衡密切相关,因此合并自身免疫性疾病是其显著特点。许多患者在诊断T-LGLL 之前即表现出自身免疫性疾病的临床表现,其中RA 最为常见[1]。T-LGLL 合并RA通常与Felty综合征的临床表现相似,均具有中性粒细胞减少、肝脾肿大等特点,对甲氨蝶呤治疗效果较好,提示二者可能有共同的发病机制[11]。其他较常见的自身免疫性疾病为免疫性的血细胞减少(如PRCA、AIHA、原发性免疫性血小板减少症等)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、干燥综合征(Sjogren′s syndrome,SS)、多发性硬化(multiple sclerosis,MS)及溃疡性结肠炎(ulcerative colitis,UC)等。Yok-Lam 等[3]的报道显示,亚洲患者中合并PRCA的比例更高,而西方国家T-LGLL患者中RA的发病率更高。本研究中6例(28.6%)合并自身免疫性疾病,4 例患者合并PRCA,2 例患者合并AIHA,1 例患者同时合并PRCA和RA。
由于部分自身免疫性疾病或感染性疾病也可能出现循环中大颗粒淋巴细胞增多,基于临床、形态学等方面难以区分T-LGLL和反应性LGL增多症,因此检测LGL 的克隆性对于鉴别这两种疾病十分重要。T-LGLL 的克隆学证据主要通过免疫学方法获得,最常用的为聚合酶链式反应(polymerase chain reaction,PCR)检测TCR 基因重排,TCR 为细胞表面识别和结合抗原并参与特异性细胞免疫的重要分子,正常淋巴组织中的淋巴细胞是多克隆来源的,其TCR 基因重排各不相同,由于T-LGL为单克隆细胞增殖,白血病细胞来源于同一克隆,其重排模式相同,检测时会出现同一种重排模式占优势,即TCR 基因重排阳性。由于TCRα基因极其复杂,TCRδ基因在成熟T细胞常缺失,因此通常针对TCRβ 及TCRγ 基因重排进行检测[12]。另外一种T 细胞克隆性检测方法是FCVβ[13],不仅可检测出T-LGLL 的单克隆特性,还能对其进行定量,但不适用于TCRγδ+T-LGLL患者,临床工作中可以将上述两种方法结合使用。
另外,T-LGLL 患者合并血液系统恶性肿瘤的情况时有发生,如淋巴瘤、多发性骨髓瘤、毛细胞白血病、骨髓增生异常综合征等。Masarova 等[14]报道34例骨髓增殖性肿瘤合并淋巴系统增殖性疾病(MPN/LPN),但T-LGLL合并原发性骨髓纤维化的病例尚未见报道。本研究病例中1例初诊时血常规示贫血、血小板减少,骨髓活检示骨髓纤维化3 级,并且JAK2 V617F 突变阳性,考虑T-LGLL 合并原发性骨髓纤维化。给予环孢素、糖皮质激素、沙利度胺、雄激素治疗,仍有顽固性贫血,目前依赖定期输注红细胞长期生存,约2 U红细胞/周。
T-LGLL 治疗的一线方案是以环孢素、环磷酰胺、甲氨蝶呤为主的免疫抑制治疗。研究显示,TLGLL治疗的总体缓解率(overall remission rate,ORR)范围为21%~85%(中位数约为50%),这3 种药物相似,且缺乏大规模的临床研究,因此很难进行比较[1]。完全缓解率相对较低:甲氨蝶呤(methotrexate,MTX)约为21%,环磷酰胺(cyclophosphamide,CTX)约为33%,而环孢素A(cyclosporine A,CsA)则低于5%[15]。本研究20例患者总有效率为60%,血液学完全缓解率为20%,部分缓解率为40%,较文献报道略低。究其原因,本研究病例中70%应用环孢素进行治疗,研究表明[15]环孢素可以纠正血细胞减少,但不能清除T-LGL 的克隆性增殖,仅能抑制其增殖。Fujishima 等[16]报道显示,14 例合并PRCA 的T-LGLL 患者中CTX 治疗效果优于环孢素和泼尼松,因此合并PRCA 的患者可首选CTX。由美国国家癌症研究所(NCI)赞助的一项Ⅱ期前瞻性研究(ECOG 5998)显示[17],55例患者中MTX的有效率为38%,且中性粒细胞减少患者的总生存期和无进展生存期均优于合并贫血的患者,因此合并中性粒细胞减少的患者可优先选择MTX。本研究2 例患者应用CTX,1 例部分缓解后长期生存,1 例因胃肠道反应停药后换用环孢素,6个月后达完全缓解;2例患者应用环孢素疾病进展后改用MTX 后有效。由此可见,对一种药物无效的患者可以换用另外两种药物,仍可达到缓解。抗CD52 单抗alemtuzumab 治疗复发或难治T-LGLL 显示出不错的疗效,一项Ⅱ期临床试验[18]中25 例TLGLL 患者接受alemtuzumab 治疗,其中24 例曾接受免疫抑制剂治疗,23 例为难治性患者,3 个月后总缓解率为56%(9例完全缓解,5例部分缓解),剔除MDS相关T-LGLL 及移植后T-LGLL 共6 例均为无效患者,其总缓解率为74%,表明alemtuzumab可以作为复发难治性T-LGLL 患者的新选择。另外,抗CD2 单抗、JAK/STAT通路抑制剂等靶向药物仍在研究中。
