肝细胞癌肉瘤11例诊治分析*
2020-02-07张荷月鞠明光戴朝六徐锋
张荷月 鞠明光 戴朝六 徐锋
世界卫生组织(WHO)将肝细胞癌肉瘤(hepatocellular carcinosarcoma,HCS)定义为肝细胞癌和肉瘤的混合物,肉瘤成分可为骨肉瘤、软骨肉瘤、横纹肌肉瘤、纤维肉瘤和梭形细胞瘤等[1]。HCS 发病率很低,仅占肝恶性肿瘤的2%左右[2-3]。该病总体预后较差,既往报导术后生存期为11.2(1.5~30)个月[4-6]。本研究对11 例HCS 患者的资料进行回顾性分析,总结HCS的特点并讨论治疗方式。
1 材料与方法
1.1 病例资料
2009年11月至2020年5月,在中国医科大学附属盛京医院病理系统中搜索“肝细胞癌肉瘤”,“肝细胞癌肉瘤样变”,“肝肉瘤样癌”。纳入病理结果符合WHO对HCS的定义的患者,共有16例患者确诊为HCS,排除4例失访患者及1例其他原因死亡患者,共11例患者纳入研究。收集纳入患者的临床资料,包括术前化验、影像学检查、肿瘤分期、治疗方法、病理结果等。以上资料收集均告知患者家属并征得同意。
1.2 方法
所有患者均接受手术治疗,其中患者8为根治性(R0)切除,其余10 例为姑息性切除。姑息性切除患者中3 例行多学科综合治疗:患者5 术前接受1 次肝动脉化疗栓塞术(TACE)和1 次TACE 联合门静脉栓塞术(PVE)治疗;患者7 术后靶向治疗(阿帕替尼);患者9 术后先后行化学治疗(索拉非尼)、靶向治疗(替吉奥)、免疫治疗(PD-1 抑制剂pembrolizumab 联合CTLA-4 抑制剂ipilimumab)。随访时间截止至2020年5月。根治性(R0)切除定义:1)切除的肿瘤边缘为阴性;2)肿瘤数量≤3个;3)门静脉、肝胆管、肝静脉的主干及下腔静脉未发现癌栓;4)无肝外转移。
1.3 统计学分析
采用SPSS 26.0 软件进行统计学分析,计量资料用中位数表示,计数资料用率表示。
2 结果
2.1 临床特征
11例患者中男性7例(63.6%),女性4例(36.4%),中位年龄58(41~71)岁。4 例患者因腹部疼痛或不适感入院,2 例有发热表现,6 例体检发现。肝炎患者9例,8例为乙型肝炎,1例乙型肝炎合并丙型肝炎,7例合并肝硬化。2例术前AFP >1 000 ng/mL,其余9例<20 ng/mL,6例CA19-9>40 U/mL。术后1例AFP 较术前升高,2 例CA19-9 较术前升高。肿瘤中位直径为7(2.0~15.6)cm,其中4例≤5 cm(36.4%),2例为5~10 cm(18.2%),5例>10 cm(45.5%)。10例单发肿瘤(90.9%),1例多发肿瘤(9.1%)。9例位于右半肝(81.8%),2例位于左半肝(18.2%)(表1)
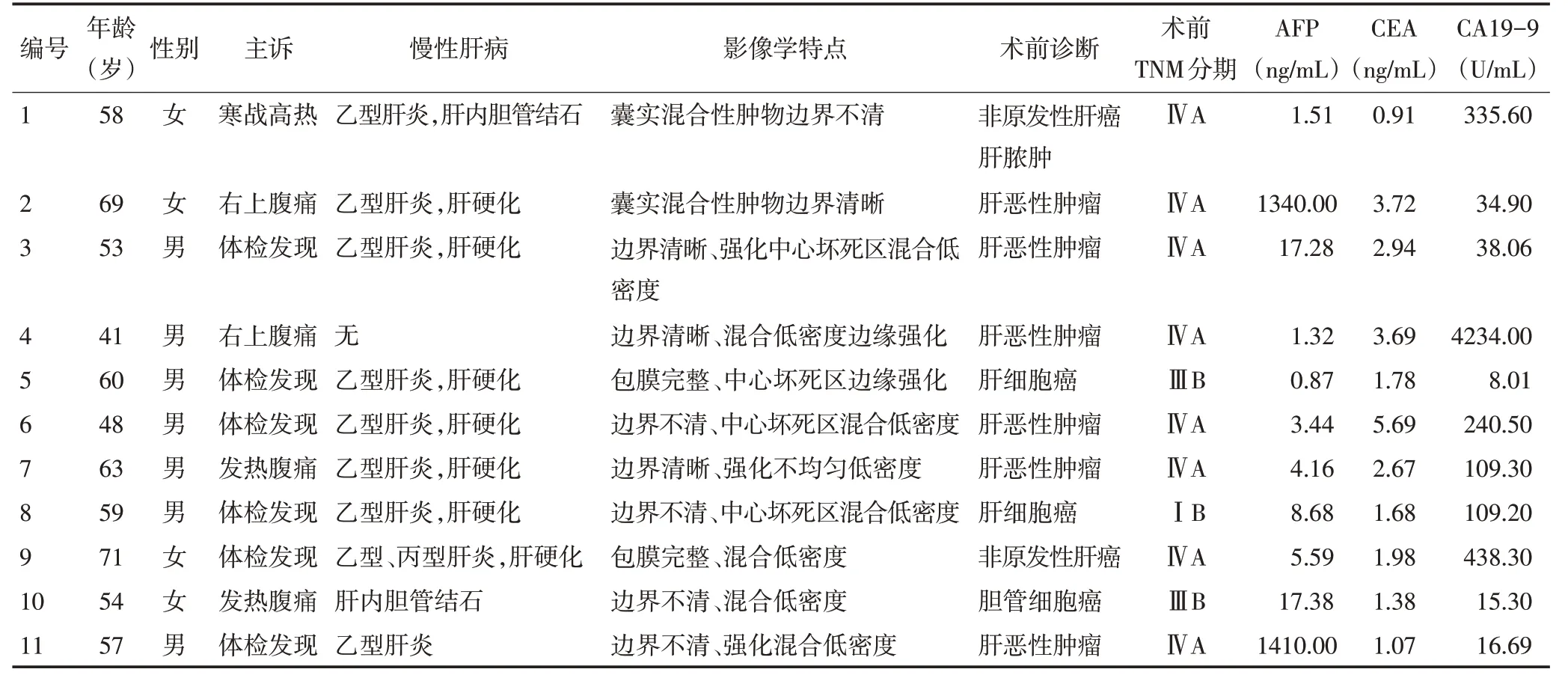
表1 患者术前信息
2.2 影像学资料
术前所有患者均未被诊断为HCS,6例诊断为原发肝恶性肿瘤,2例诊断为肝细胞癌,1例肝内胆管细胞癌,2 例非原发性肝癌,其中1 例因病灶较小,术前曾考虑肝脓肿可能。所有患者均为混合密度病灶,血供丰富,动脉期或门脉期强化显著(图1);3例肿瘤包含囊性变(图2A,图3A、B);4 例中心有坏死区域(图2B);6例病灶边界清晰(图1,图2A)(表1)
2.3 病理结果
镜下可见不同肉瘤细胞成分,异型明显,多呈巢状、片状或束状排列。6例为梭形细胞肉瘤(图4A),3例为平滑肌肉瘤(图4B),1例为横纹肌肉瘤(图4C),1例纤维肉瘤(图4D)。6例肿瘤侵犯重要管道,10例切缘阴性,1 例切缘为阳性。肿瘤TNM 分期:1 例为ⅠB期,2例为ⅢB期,8例为ⅣA期(表2)。
2.4 随访及预后
截止至2020年5月,中位无瘤生存时间6(2~87)个月,中位总生存时间12(3~87)个月。1、3、5年生存率分别为54.5%、36.4%、11.1%。患者5、8、9、7的生存时间明显长于其他患者。其余仅行姑息性切除术的患者术后无瘤生存时间为2~16个月,总生存时间为3~22个月(表2)。
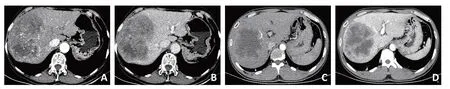
图1 患者2、4增强CT
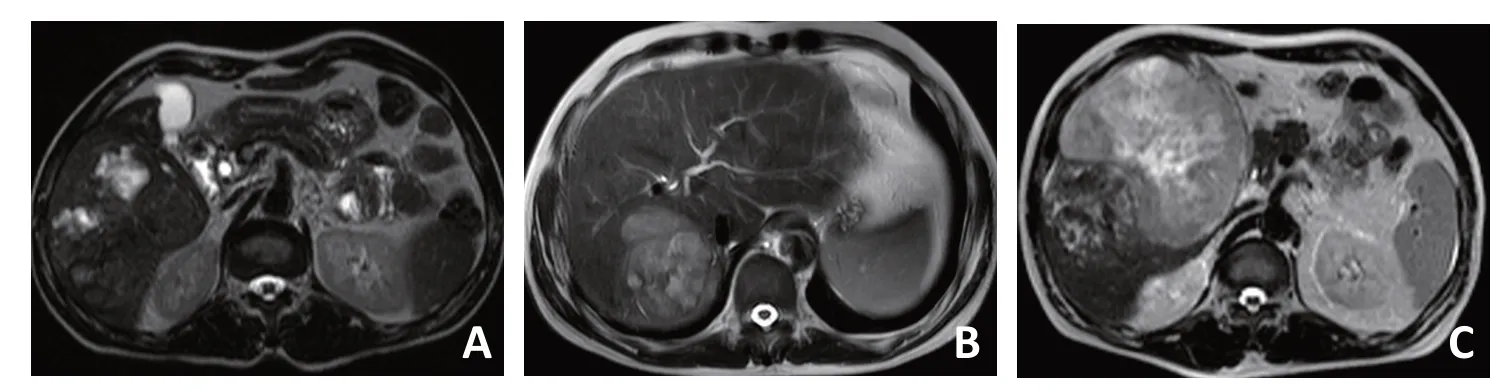
图2 患者6、8、11的MRI图像
图3 患者7术前、术后复发增强MRI图像
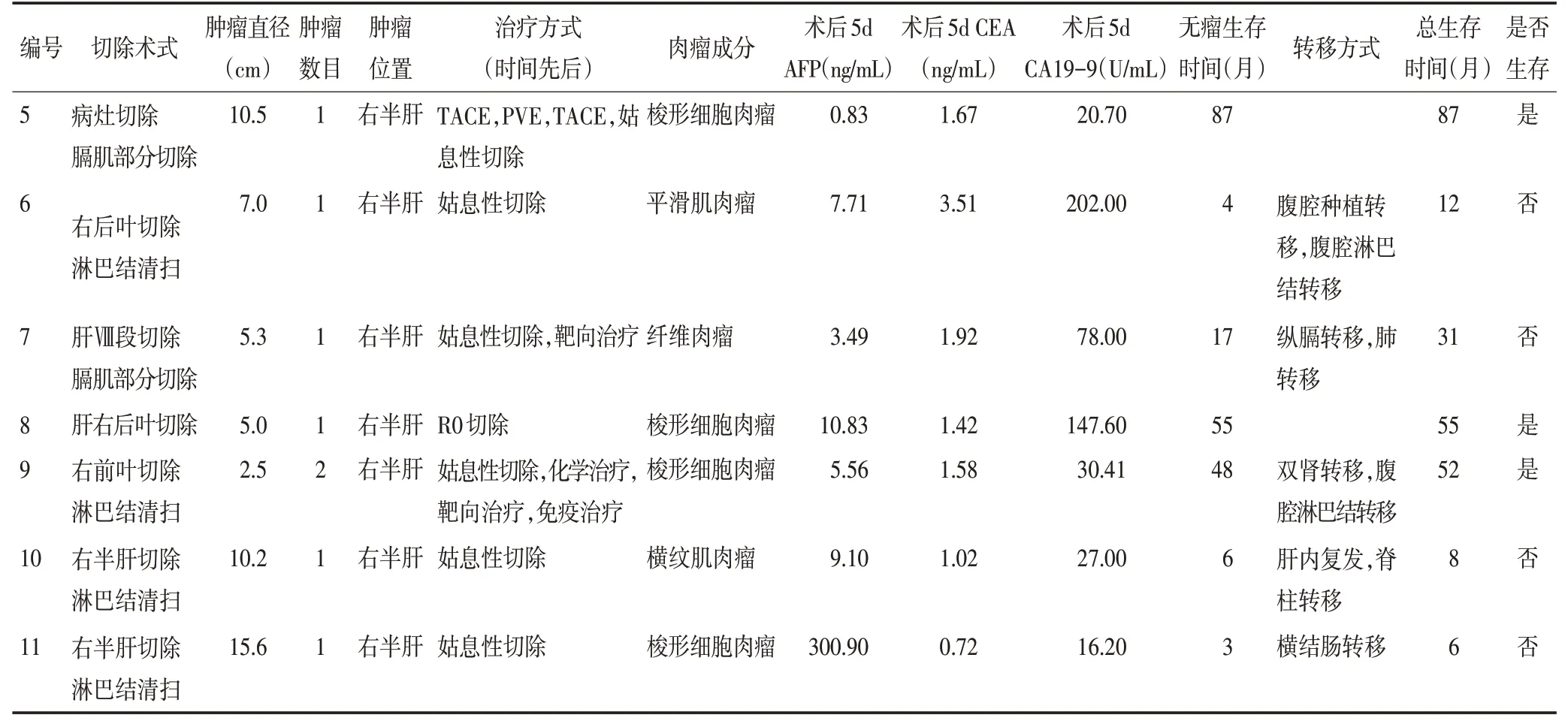
表2 患者术后信息(续表2)
3 讨论
HCS自身发病率较低,临床表现与影像学特征无显著特异性,术前容易误诊[7]。本研究11 例患者术前影像学诊断中有6 例诊断为原发肝恶性肿瘤,2 例诊断为肝细胞癌,1例为肝内胆管细胞癌,2例为非原发性肝癌,其中1例因病灶较小术前曾考虑肝脓肿可能。所有患者均未在术前诊断为HCS。既往文献报道也均通过病理检验才能对HCS作出明确诊断[8]。目前对于HCS的发病机制存在争议,一种理论认为其起源于同一个干细胞或多潜能肝祖细胞,可同时分化为癌和肉瘤,形成“组合”肿瘤[9-10]。另一种理论认为肝细胞癌可去分化后转化为肉瘤,形成“转化”肿瘤[11]。HCS中的肝细胞癌成分使其有部分明显的相关临床特征,如男性发病率高于女性,与肝炎肝硬化相关等。但AFP与肝细胞癌相比变化不明显,本研究术前仅有2例AFP升高。相比AFP和CEA,术前CA19-9异常患者更多。影像学上HCS无肝细胞癌在动脉期密度高于肝实质的典型表现,且更倾向于单发、直径大、内部呈分叶状,即使肿瘤直径<5 cm也含有坏死或囊性变[12],可能因肉瘤成分使肿瘤生长迅速,以至于血供不足导致内部缺血坏死。个别直径较小的瘤体边缘动脉期高灌注,结合寒战、高热等临床表现,容易与肝脓肿混淆,但肝脓肿壁通常密度均匀,且抗炎治疗后CA19-9无降低则需予以重视。部分HCS因其组合成分而具有明显的“组合特性”。HCS似乎较肝细胞癌更容易转移或侵犯邻近器官如右肾、肾上腺、右半结肠、膈肌等[13-14]。综上,在术前评估难以定性的肝恶性肿瘤可根据以上特点将HCS考虑在诊断范围内。
目前HCS无治疗指南,根治性切除被认为是最佳的治疗方式。但大多数HCS患者发现时已没有根治性切除机会,本研究仅1例R0切除患者。本组中1例患者来院时肿瘤体积大并已侵犯右肝静脉,考虑患者肝功能不良,术前共行两次TACE、一次PVE来控制肿瘤发展,同时改善肝功能并扩大左半肝体积。但栓塞期间肿瘤直径变大,提示控制不佳。1个月后切除肝病灶和部分膈肌,术后除抗乙肝病毒治疗外未进行任何辅助治疗,无瘤生存至今。该患者总体预后较好可能由于肿瘤包膜完整,虽然肿瘤体积变大但期间未发生肝外转移,为手术切除争取了宝贵的时间。目前栓塞治疗存在争议,因有证据表明反复栓塞治疗可导致肝细胞癌的肉瘤样转化[15],但其机制尚不明确。本例患者HCS中肉瘤成分是否因三次栓塞转化而来无法确认,但需尽量避免多次栓塞。部分姑息性切除患者术后AFP、CA19-9不降反增,提示预后不良。从研究结果来看,术后及时辅助治疗尤其重要。
本研究不足之处在于患者例数较少,对于治疗方式难以得出有力的结论,但可以明确单纯手术切除很难使HCS这种高度恶性肿瘤的生存时间得到显著延长,多学科治疗的优势得以体现。对于难以定性的肝恶性肿瘤或疑似HCS病例,如肿瘤过大或肝功能暂不具备切除条件,则建议穿刺活检,根据基因检测或免疫组织化学结果及时行新辅助治疗或联合动静脉栓塞等治疗方案,如有手术机会应行扩大切除术,术后及时行辅助治疗。也可根据肉瘤成分行个体化治疗,既往病例报告曾采用放射疗法使颈部转移灶减小[8]。
综上所述,HCS与肝细胞癌相比恶性程度更高。肿瘤标志物中CA19-9灵敏度高;短时间内更容易侵犯肝内重要管道,易发生邻近器官及淋巴结转移;影像学有囊变、坏死、组合肿瘤等特征性表现。术前信息对于HCS诊断有一定提示作用。根治性切除预后良好但几率较小,辅助治疗有利于患者改善预后。
