妇科门诊患者宫颈感染人乳头瘤病毒基因分型检测特征分析
2020-02-07张丽敏陈柯霖刘淑静谷愉愉康熙雄张国军
张丽敏,吕 虹,陈柯霖,刘淑静,周 金,谷愉愉,康熙雄*,张国军*
(1.首都医科大学附属北京天坛医院,北京100070;2.北京市免疫试剂临床工程技术研究中心,北京100070)
宫颈癌是常见的妇科恶性肿瘤之一,而人乳头瘤病毒(human papillomavirus,HPV)感染已被证实是宫颈癌发生的首要因素[1]。目前已鉴定出 HPV 有100 多种亚型,约有40多种与生殖道感染有关,根据其致病力分为高危型和低危型,高危型可引起多种恶性肿瘤如喉癌、膀胱癌、宫颈癌等,高危型 HPV 持续感染是宫颈癌的主要致病因素[2];低危型则常引起湿疣等良性病变。因此对女性宫颈脱落细胞进行HPV分型检测,了解HPV基因型分布特征,对预防和早期诊治宫颈癌具有重要的意义。本文对2014年1月至2016年6月北京地区来北京天坛医院妇科门诊初诊的妇女HPV感染情况作一回顾性分析,现将结果报告如下。
1 材料与方法
1.1 研究对象
2014年1月-2016年6月于北京天坛医院妇科门诊就诊的初诊妇女共10252例,年龄16-86岁,平均年龄40.7±11.5岁。患者未接受过抗HPV相关治疗,无宫颈切除术治疗史,排除妊娠。
1.2 标本采集
由妇科医生使用HPV采样刷采集宫颈脱落细胞标本,将毛刷放入加有专用细胞保存液的收集管中,4-8℃冰箱保存,3天内完成检测。
1.3 仪器与试剂
HPV基因分型检测试剂盒,由潮州凯普生物化学有限公司生产,HPV基因型进行分型检测,包括13种高危型HPV(16、18、31、33、35、39、45、51、52、56、58、59、68)和8种低危型HPV(6、11、42、43、44、53、66和CP8304),共21种。
1.4 实验过程
样本DNA抽提;PCR 扩增;导流杂交;酶标显色;根据芯片显色位点判断HPV基因型。
1.5 统计方法
用SPSS 18.0统计学软件;计数资料以百分比表示,率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 妇科门诊患者宫颈感染HPV检出情况
2.1.1HPV感染率及各基因型分布 10252例妇科门诊初诊患者,检出HPV-DNA阳性例数为1930例,总阳性检出率为18.83%(1930/10252),21种基因型均有检出。各基因型别分布如表1所示。其中HPV-52检出率最高,共363例,阳性率为3.54%(363/10252),其次为HPV-16、58、CP8304和53,阳性率分别为3.41%(350/10252)、3.13%(321/10252)、1.97%(202/10252)和1.89%(194/10252)。
2.1.2单一及多重感染分布 在1930例检出阳性标本中,单一感染1426例,占总阳性标本的73.89%,二重感染373例,占总阳性标本的19.33%,三重及以上感染131例,如表2所示。
2.1.3高危及低危型别感染分布 1930例检出阳性标本,根据HPV型别检出情况划分为3组:高危型感染组、高低危型混合感染组和低危型感染组,分别定义如下:高危型感染组,即至少有一个高危型阳性,且所有低危型阴性;高低危型混合感染组,即至少有一个高危型阳性,并且同时至少也有一个低危型阳性;低危型感染组,即至少有一个低危型阳性,且所有高危型阴性。
1930例阳性标本检出情况如表3所示,高危型感染检出率为68.81%(1328/1930),低危型感染检出率为18.39%(355/1930),高低危型别混合感染检出率为12.80%(247/1930)。其中,高危型感染组以单一感染为主,共1128例,占阳性标本的84.94%(1128/1328),主要型别为HPV-52、16、58、39和51。低危型感染组单一感染309例,占阳性标本的87.04%(309/355),主要型别为HPV-CP8304、53、66和6,二重感染22例。高低危混合感染组二重感染167例,占阳性标本的67.61%(167/247),主要型别为HPV- CP8304和53。
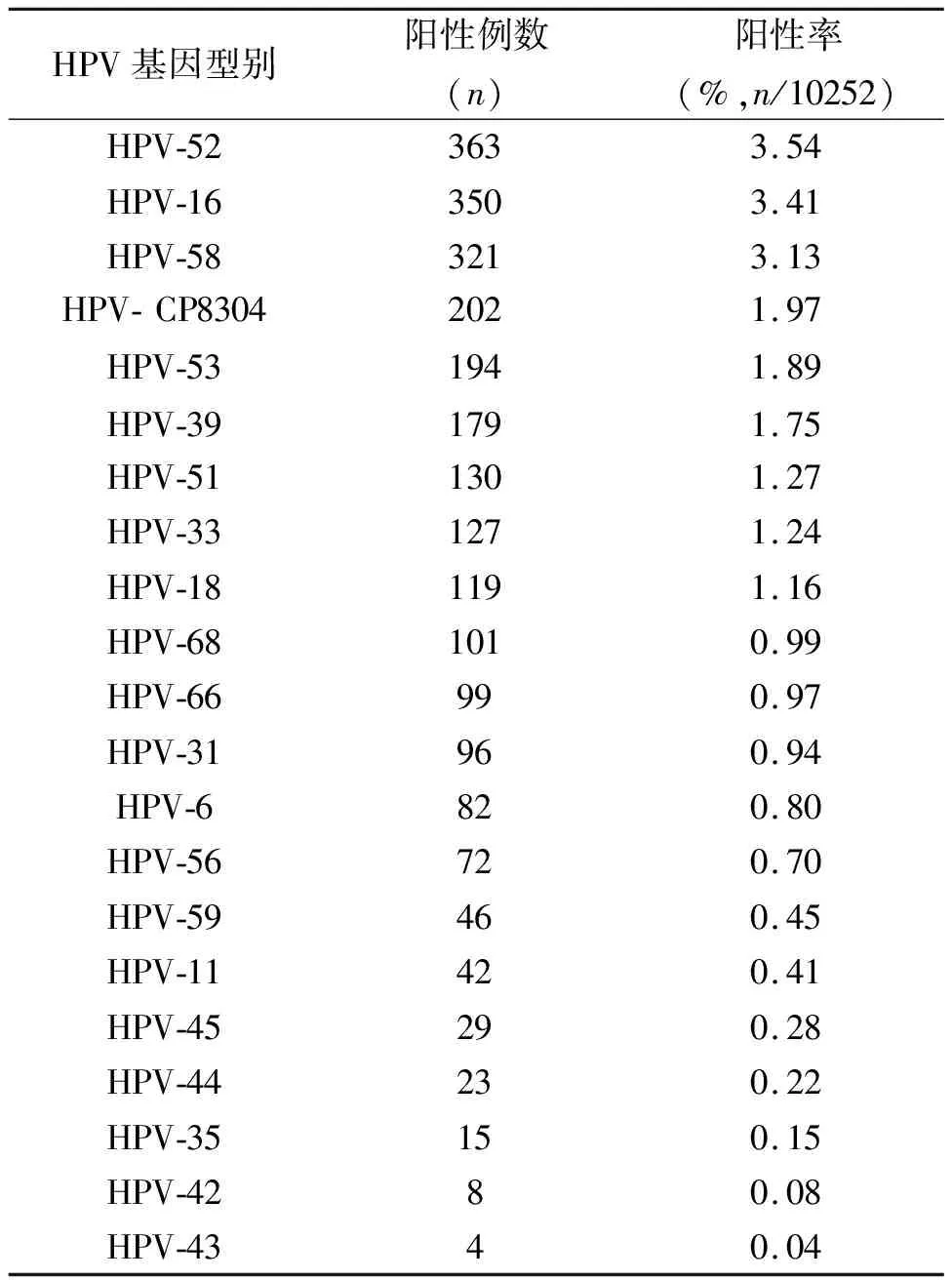
表1 10252例妇科门诊患者检出HPV各基因型分布

表2 妇科门诊患者检出HPV单一及多重感染分布
2.1.4妇科门诊患者感染HPV年龄分布情况
妇科门诊患者中,年龄<23岁患者HPV感染率最高,为35.48%。年龄>60岁患者感染率最低,为12.97%,如表4所示。

表3 妇科门诊患者检出HPV高低危感染分布

表4 妇科门诊患者感染HPV年龄分布情况
*与<23岁比较,P<0.05#与>60岁比较,P<0.05
2.2 妇科门诊患者和体检妇女宫颈感染HPV结果比较
前期研究中,对同期来北京天坛医院体检科进行体检的女性进行了宫颈感染HPV基因型别的分布特征分析[3],现将妇科门诊患者和体检妇女两组人群HPV感染分布特征进行比较如下。
2.2.1HPV感染率比较 妇科门诊患者与体检妇女感染HPV情况比较,妇科门诊患者HPV总感染率、单一感染和多重感染率均高于体检妇女,差异有统计学意义(P<0.01)。两组妇女中,高危型感染组与高低危型感染组合计为高危感染,低危型感染组与高低危型感染组合计为低危感染,统计学分析结果见表5。妇科门诊患者高危感染率及低危感染率均高于体检妇女(P<0.01)。

表5 妇科门诊患者及体检妇女HPV感染状况比较(n,%)
2.2.2HPV感染基因型别比较 两组患者HPV 感染前6 位型别完全相同,如表6所示,且HPV-52在两组均排首位。除HPV-CP8304外,其余5种基因型感染率妇科门诊患者均高于体检妇女,两组间差异有统计学意义(P<0.05)。

表6 妇科门诊患者及体检妇女主要HPV型别及感染率比较(n,%)
3 讨论
宫颈癌是妇科常见的恶性肿瘤之一,发病率仅次于乳腺癌,全世界每年有46万新发病例,每年有25万人死于宫颈癌[4]。1995年,国际癌症研究中心宣布HPV感染是子宫颈癌的发生主要原因。近年来HPV疫苗的研制及应用,虽然在一定程度上能够通过预防HPV感染进而防止宫颈癌的发生[5,6],但受疫苗的推广程度以及人们性观念的改变等因素影响,目前宫颈癌的发病率仍呈稳步上升及年轻化趋势。最近一项来自加拿大对19000名女性进行的随访研究报道,HPV检测可明确降低后续宫颈上皮内瘤变的发生率,并认为HPV检测比细胞学检查更有效,可作为宫颈癌的主要筛查方法[7]。我院妇科门诊患者,多数伴有下腹部不适等症状,作为HPV的高危人群,HPV检测尤为重要。并且随着我国新的生育政策的实施,部分妇女尚有生育需求,而孕前女性宫颈HPV感染,可对胎儿及新生儿的健康带来隐患,因此对这部分人群进行HPV筛查对促进母婴健康也具有重要的价值。
本研究回顾性分析了10252例妇科门诊初诊妇女宫颈感染HPV的资料,结果显示其阳性检出率为18.83%,这与国内多项研究结果相一致[8,9]。但也有研究显示部分地区HPV感染率高于本研究[10,11]。这说明HPV感染存在一定的地域差异,另外研究的样本量、实验室检测方法、所测HPV型别不同也是导致结果不一致的可能原因。在年龄分布上,数据显示<23岁女性感染率最高(35.48%),>60岁女性感染率最低(12.97%),而介于31-60岁之间的各年龄段之间感染率相近。这与我们前期在妊娠及体检妇女中的研究结果趋势一致[3],但不同于其他一些研究结论。如王新忠等研究报道女性HPV感染率随年龄增长均呈上升趋势[12]。另王小利等研究数据显示HPV在50-60岁妇女检出率最高[10]。首先这不能排除地域差异的因素,此外这也与每个年龄段入组人数的基数有关。<23岁的就诊女性检出阳性人数为66例,仅占总阳性例数的3.42%(66/1930),但由于此年龄段入组人数基数较少,为186例,为所有年龄段中人数最少者,其阳性检出率反而高于其他年龄组。高发病率呈年轻化趋势,也与此年龄段女性性行为习惯、缺乏生理卫生知识、免疫系统因素及自身防护意识较弱等有关。
在前期研究中我们对同期的体检妇女HPV感染特点进行了分析,此次研究中我们也将二者的资料进行了比较,结果显示妇科门诊患者在HPV总感染率,单一/混合感染及高危/低危感染方面均高于体检妇女。这是因为就诊于妇科门诊女性多数伴有身体不适而来就诊,而体检妇女大部分来自健康体检人群,因此不难理解。在基因型分布上,检出率排前六位的基因型别在两组间分布相同,且高危型别均占优势,这说明HPV基因型在不同人群中的分布具有一致性。
