长链非编码RNA MEG3对胃癌及其远期预后的诊断价值
2020-02-07程玉华连丽丽董红梅
程玉华,连丽丽,董红梅*,丁 璐
(吉林大学第二医院 1.胃肠及营养外科;2.神经内科,吉林 长春130041)
胃癌是一种较为常见的消化道肿瘤疾病,其发病率和死亡率分别位居第4位和低2位[1]。目前CA199、CA724等血清标志物对胃癌的诊断有提示作用,但是胃癌的诊断主要依据胃镜检查。早期胃癌经手术切除后生存率可达90%以上,而进展期胃癌生存率仅为30%[2]。故更加简单和廉价且快速的诊断方式能够使胃癌患者在早期得到治疗。非编码RNA作为在转录水平起调控作用的一种特殊RNA,已被证实参与到许多疾病的发生和发展中,其能控制细胞的增殖凋亡,甚至具有抑制肿瘤生长的作用[3]。因此被认为具备传统血清肿瘤标志物无法比拟的对疾病的诊断、预后甚至潜在治疗的作用。非编码RNA MEG3被认为是一种具有抑制肿瘤生长的基因[4],其在组织中的低表达和肿瘤的转移及预后有着潜在的关系。但是否其在所有的胃癌患者组织中均能呈现低表达以及是否能成为血清诊断标志物目前尚不明确。故本文通过组织标本验证MEG3对胃癌的诊断价值并分析其低表达对患者远期生存率的影响。
1 资料与方法
1.1 一般资料回顾性分析2011年1月—2014年12月因确诊为胃癌而就诊于吉林大学第二医院的胃肠及营养外科患者89例。全部患者均行手术治疗,癌旁正常组织为距离癌组织边缘5 cm。排除标准:①术前进行辅助放化疗及靶向治疗。②肿瘤合并大范围远处转移者。③多器官功能衰竭病例。④在院死亡病人或失访患者。其中男57例,女32例,平均年龄56.9±5.5岁。全部患者一般基本资料详见表1。本实验中组织取自的患者知情同意并签署相应文件,本项目经吉林大学第二医院伦理委员会批准。
1.2 方法
1.2.1全部标本均术中获得,包括胃癌组织及配对的癌旁正常组织,组织类型由病理科医生证实为癌组织及正常胃组织。所有标本自手术取下后迅速放入液氮封存并转运至实验室。组织RNA提取使用TRIZOL试剂,并进行RNA浓度及纯度的检测,OD260/OD280选择在1.8-2.0之间的RNA。然后将提取的RNA逆转录为cDNA,分两步进行并使用All In One cDNA逆转录试剂盒,实时定量PCR采用All In One PCR试剂盒,每组样品均设3 个重复。引物设计根据Primer-Blast设计,并经Oligo验证后由华大基因公司辅助合成,具体序列见表1。

表1 荧光定量引物表
1.2.2高通量生物信息分析方法 长链非编码RNA芯片GSE105476来源于GEO数据库(GEO,http://www.ncbi.nlm.nih.gov/geo/)。其中GSE105476包含5例胃癌组织组织和5例癌旁正常组织。通过GEO2R软件进行差异表达统计分析,差异表达筛选标准为(差异倍数在2倍以上及P<0.05)。Graphpad prism 7进行差异基因的火山图绘制。

2 结果
2.1 MEG3对胃癌患者年龄、性别、组织大小、分化程度的诊断价值MEG3在胃癌组织中呈现相对低表达水平,诊断阳性率可达100%。RT-PCR检测结果显示胃癌组织表达水平(7.47±0.35)较正常组织(9.68±0.42)存在统计学意义(P<0.05)。其中MEG3在肿瘤的分化程度上呈现差异性表达,但在年龄、性别、肿瘤大小方面无明显差异,详见表2。
2.2芯片分析结果显示总共对13055个基因进行检测,其中11013个基因无明显变化,626个上调差异性表达的基因,1416个下调差异性表达的基因。对上述数据进行火山图差异表达基因绘制,其中圆圈代表无明显差异基因,菱形代表差异上调基因,星号代表差异下调基因,显示如图1。
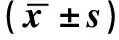
表2 2组患者一般资料及表达量与临床病理参数的关系
*P<0.05,表中数据以均数±标准差或例表示
2.3 MEG3表达量对胃癌患者预后的诊断价值Kaplan Meier曲线显示MEG3低表达病人预后较高表达病人预后差,中位生存时间分别为24.7个月和32.3个月,差异有统计学意义(P<0.05),见图2。TCGA数据库显示MEG3在胃癌患者年龄和性别方面表达无明显差异(P<0.05),见图3。
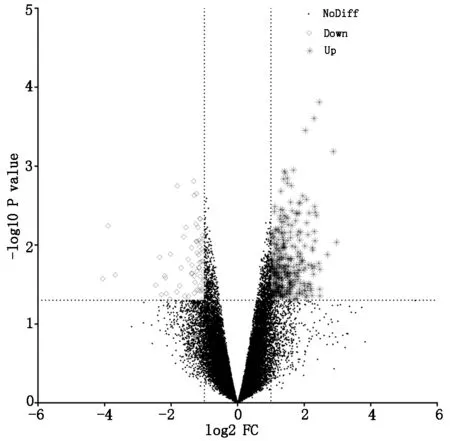
图1 胃癌组织与癌旁正常组织差异表达基因火山图
菱形◇代表差异上调基因,星号❋代表差异下调基因,圆圈●代表无差异表达基因。
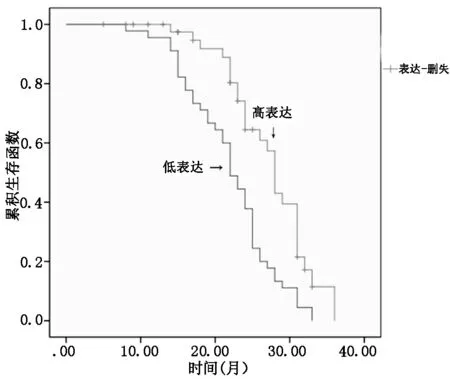
图2 Kaplan Meier曲线显示MEG3高低表达病人预后
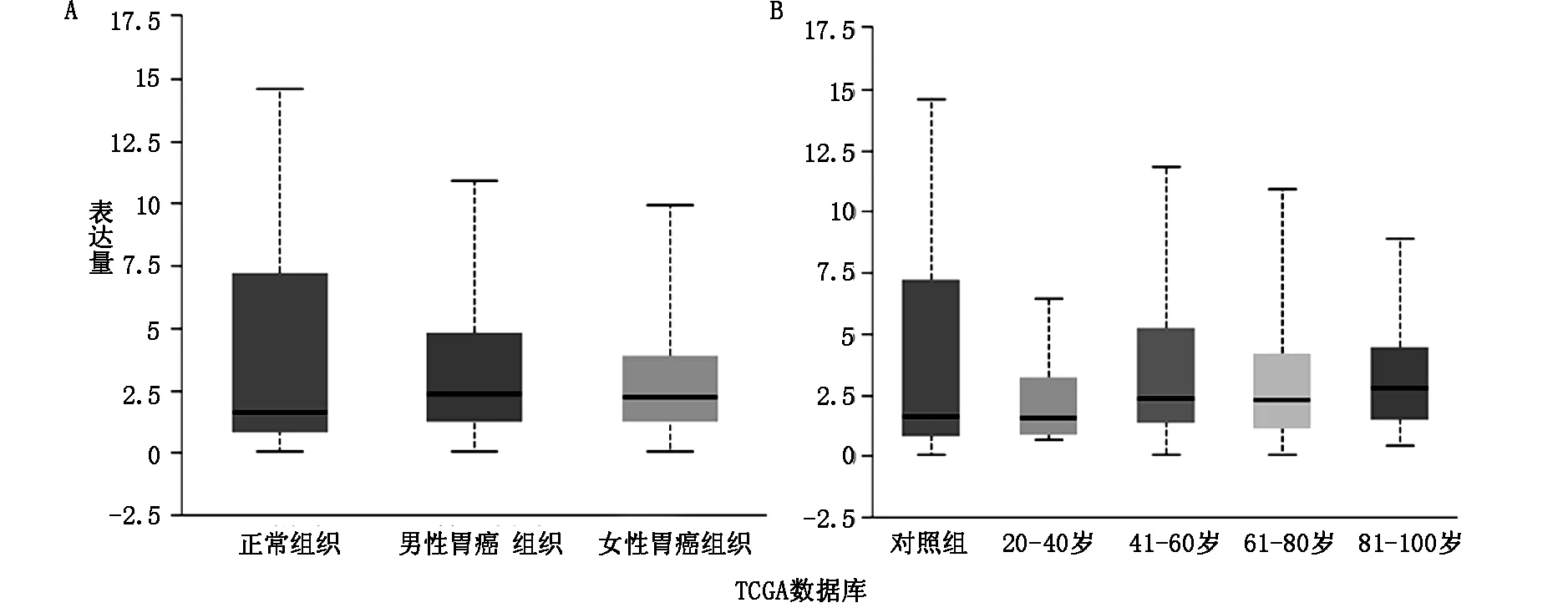
图3 TCGA数据库显示MEG3差异性表达病人无病生存率
3 讨论
胃癌作为较为普遍的一种消化道肿瘤,如何能够在疾病早期进行快速的诊断是目前研究热点。胃镜检查因价格较贵且检查费时费力,患者感觉痛苦显然不适合大量的人口普查。血清诊断标志物能够快速准确的提供疾病的诊断信息,而且检查方便价格低廉适合大量人口普查[5]。目前消化道肿瘤血清诊断标志物种类较多,包括CA125、CEA、CA199、CA724等,但是诊断特异性较低,需要联合检查或辅助其他检查手段。非编码RNA[6]的发现给疾病的早期诊断甚至治疗提供了新的新思路,特别是非编码RNA在肿瘤组织中的广泛存在并参与肿瘤细胞的增殖生长及凋亡,可能在编码RNA发生改变前即发生差异性改变,而且非编码RNA在体液中广泛存在,具备血清标志物的潜能。
既往研究报道,胃癌组织及患者血液中会产生大量差异性表达的长链非编码RNA,其中LncRNA ncRuPAR[7]对胃癌组织的诊断率达到81.2%,LncRNA HMlincRNA717也在胃癌组织中发生下调表达,LncRNA FER1L4和LncRNA FENDRR均在胃癌组织中差异表达。本文选择MEG3不仅是因为其已经证实在胃癌组织中呈现差异性表达,更是因为MEG3是第一个被发现具备抑制肿瘤生长的长链非编码基因,其可以通过竞争性吸附miRNA21抑制胃癌细胞发生癌变,也可以通过调控DNA甲基化从而影响胃癌细胞的增生和凋亡。像较为著名的P53抑癌基因,MEG3也被证实可能通过调控P53的活性进而发挥抑癌功能[8],从而有望成为胃癌诊断的血清肿瘤标志物。
本文通过RT-PCR对胃癌组织中MEG3的检测发现几乎全部的胃癌组织中均低表达此基因。而且低表达此基因的患者预后均较差。前人研究发现MEG3的低表达和肿瘤细胞的分化程度及转移程度相关,和本文研究相一致,说明对MEG3的检测可以作为胃癌的血清诊断标志物。而既往研究发现低表达组MEG3患者的远期存活率也较低。本文通过生存曲线也发现类似结果,因此说明对MEG3的检测可以预测胃癌术后患者的远期生存率,从而可以更加积极的在术后行辅助性放疗或化疗,从而提高患者远期生存率。MEG3作为首个具有抑癌作用的非编码RNA,其与P53途径、Rb途径及影响血管生成均有关,说明MEG3可能是胃癌发生的首要变化基因,针对此基因进行干扰如研发靶向治疗药物可能会发挥治疗及改善胃癌术后远期预后的效果。
总之,本文研究发现胃癌组织中过低表达的MEG3可能是胃癌发生发展过程中的一种重要改变,并可通过对MEG3的检测来预测患者胃癌的分化程度及远期生存率,针对MEG3的检测可能在早期为胃癌提供诊断信息。
