IVF-ET患者HLA-DQB*0301基因rs6928482、rs1056315和-A*3101 rs1061235单核苷酸多态性研究
2020-02-07王惠莹柴蓓蓓罗加欢张若鹏
王惠莹,刘 浏,柴蓓蓓,罗加欢,张若鹏
(1.大理大学临床医学院,云南 大理671000;2.大理大学第一附属医院;3.大理大学生殖医学研究所)
体外受精-胚胎移植(In vitro fertilization and embryo transfer,IVF-ET or IVF)作为一种辅助生殖技术也是治疗不孕不育最重要的手段。随着生活节奏的加快,工作压力增加以及生育年龄的上升,被不孕不育困扰的家庭逐年增加,IVF-ET为他们带来了福音,但成功率仍然徘徊在30%-40%之间,母胎间的免疫耐受以及人类白细胞抗原(Human Leukocyte Antigen,HLA)等免疫遗传因素成为胚胎移植妊娠结局的研究重点[1],从基因角度研究IVF-ET妊娠结局的影响因素能更好了解其可能影响机制,寻求治疗靶点,以期提高临床妊娠率。
1 资料与方法
1.1 对象及分组
随机选择2018年6月-2018年12月本中心330例确诊为不孕症行IVF-ET手术的患者,术后第14天患者随访抽血查HCG,根据阳性和阴性结果分为妊娠成功组(120例),平均年龄(31.45±3.65)和妊娠失败组(210例),平均年龄(31.17±3.41),两组年龄差异无统计学意义。排除合并感染性疾病,恶性肿瘤等疾病,男性精液常规检查出现异常,依据2011年世界卫生组织第五版标准检测精液样品,评估是否适合体外受精-胚胎移植,结果显示睾丸总精子数较低<5×106/ml予以排除。不孕症符合第八版《妇产学》中的诊断标准。
1.2 方法
1.2.1标本采集 征得同意后,行IVF-ET前每个研究对象均采用真空抗凝(EDTA)采血管采集晨起空腹静脉血5 ml,置-20℃冷冻贮存、待检。本研究内容经大理大学生殖医学伦理委员会批准。
1.2.2主要仪器与耗材 oKtopure 自动化核酸提取仪,烘箱,涡旋振荡仪,Nanodrop微量紫外分光,电泳系统,凝胶成像仪,LGC平台(IntelliQube + Hydrocycler)。
名称货号品牌MaglsoSwabDNAIsolationKitM5105-100GBCNunc2.0ml96深孔板278752NuncSEALINGTAPEPOLYESTRSTRLCLR封板膜276014Nunc0.2ml透明半裙边96孔PCR板PCR-96M2-HS-CAxygenoktowash,ConcentratedWashbufferKBS-0009-002LGCReplikatorK-wash,WashBufferKBS-0006-009LGC异丙醇I112011-500ml阿拉丁无水乙醇/广州牌化学试剂KASPV4.02XMastermixKBS-1016-012LGC
1.2.3DNA的提取 基因组 DNA 的提取利用试剂盒Maglso Swab DNA Isolation Kit(货号:M5105-100)说明书进行操作,最后上机(oKtopure自动化核酸提取仪)进行DNA自动化提取。
1.2.4DNA样本KASP(Kompetitive Allele-Specific PCR)(竞争性等位基因特异性PCR)检测
应用软件设计合适的特异性引物,rs6928482-FAM:CCATGACCCTGAAA-GCAGG,rs6928482-HEX:CCATGACCCTGAAAGCAGA,rs6928482-R:TGTGGGTGA-GGGAGAAAGGA;rs1056315-FAM:AGCATTTTGGGGTGTGAAGTAAG,rs1056315-HEX:AGCATTTTGGGGTGTGAAGTAAT,rs1056315-R:TAAAGAACCATGAATGATGCGACAA;rs1061235-FAM:TTGCAGAAACAAAGTCAGGGTT,rs1061235-HEX:TTGCAGAAACA-AAGTCAGGGTA,rs1061235-R:CTGCCTTGTGTGGGACTGAGA运用LGC的IntelliQube仪器进行自动化检测,KASP基因分型PCR扩增反应的反应程序为:阶段1:94℃预变性15 min;阶段2:94℃20 s,61-55℃ (每个循环降0.6℃)1 min,共循环10次;阶段3:94℃20 s,55℃ 1 min,共循环26次。其中PCR水浴热循环为Hydrocycler高通量热循环系统 ,最后对PCR扩增产物进行荧光扫描,读取荧光信号。
1.3 统计学处理
采用SPSS21.0软件进行数据分析,首先对研究样本进行 SNP Hardy Weinberg 平衡检验,保证研究对象选取的随机性,另外计量资料用t检验,计数资料用卡方检验,P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况比较
妊娠成功组与妊娠失败组在年龄、BMI以及子宫内膜厚度的差异无统计学意义(P>0.05),见表1。
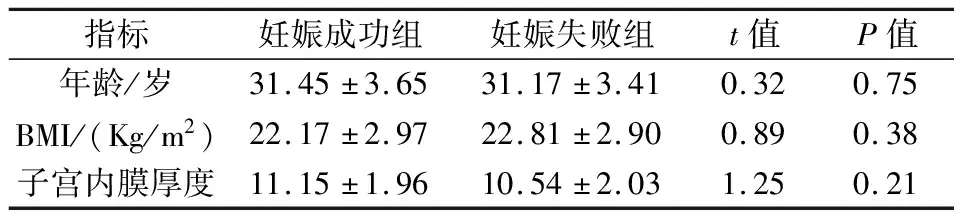
表1 妊娠成功组与妊娠失败组间计数临床指标比较
2.2 移植胚胎的不同类别及子宫内膜分型在妊娠成功组和失败组的组间比较
移植胚胎类型和移植胚胎数在妊娠成功组与妊娠失败组两组比较中差异无统计学意义(P>0.05),见表2。
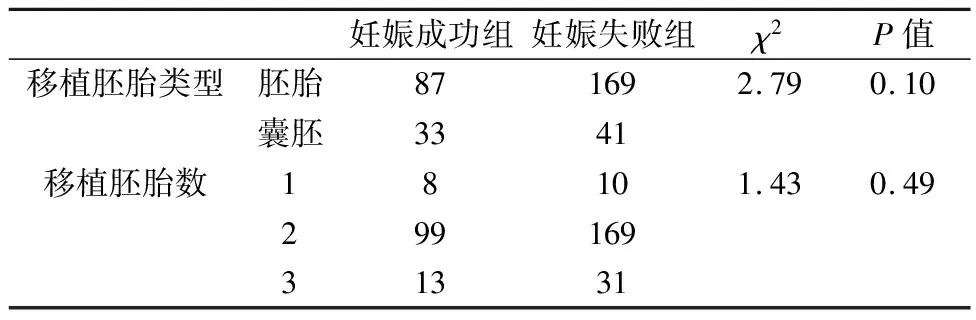
表2 移植胚胎类型和胚胎数在妊娠成功组和失败组的组间比较
2.3 妊娠成功组与妊娠失败组的HLA-DQB*0301、-A*3101基因不同位点基因型及基因频率的分布比较
rs1056315基因型分布不符合Hardy Weinberg遗传平衡定律需剔除,rs6928482、rs1061235基因型分布符合Hardy Weinberg遗传平衡定律(P>0.05),见表3,rs6928482位点CC、CT、TT在妊娠成功组的频率分别是6.67%、33.33%、60%,妊娠失败组的分布频率为13.81%、38.57%、47.62%,妊娠成功组TT基因型明显高于失败组,且差异有统计学意义(P<0.05)。rs1061235位点AA、AT在妊娠成功组的分布频率分别是83.33%、16.67%,在失败组的频率分别是87.62%、12.38%,两组差异无统计学意义(P>0.05),见表4,rs6928482位点T等位基因频率在妊娠成功组显著高于妊娠失败组(P<0.05),此外,TT基因型的高表达会增加妊娠成功的几率,OR值2.61,95%CI2.61(1.128-6.041)且差异具有统计学意义(P<0.05),见表5。
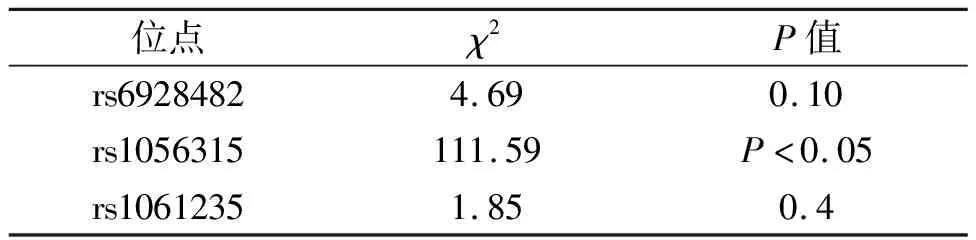
表3 三组基因位点Hardy Weinberg遗传平衡检验

表4 妊娠成功组与妊娠失败组的HLA-DQ基因不同位点基因型及基因频率的分布比较/例(%)
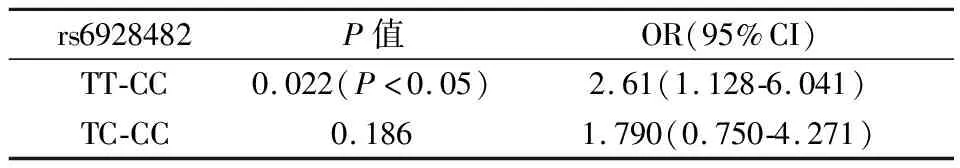
表5 rs6928482基因型妊娠失败风险比较
3 讨论
我们采用病例对照研究分别对两组的一般临床指标和移植胚胎数以及移植胚胎类型进行了比较,两组之间差异无统计学意义。IVF-ET术后妊娠结局的影响因素有很多,子宫内膜容受性是决定胚胎种植成功的关键因素,正常受精率、优质胚胎率、胚胎卵裂球数、胚胎的形态及生长速率等均是判断胚胎种植率的重要指标[2],当然还有卵巢刺激因素、实验室条件等等。国内苏宁指出HLA-C与复发性流产有关[3],周静等人采用ELISA方法和免疫组织化学法分别检测血清中和胎盘组织中HLA-I类分子的表达情况,得出HLA-I类分子的低表达可能与妊娠不良结局密切相关[4]。国外Dendrou C A 等人提出HLA分子通过调节母胎存活率与生殖适应性相关,从而驱动 HLA的多态性[5]。
HLA是人类复杂的遗传系统,其多态性决定了个体免疫应答的差异性[6],HLAⅡ类蛋白是人类适应性免疫识别的重要组成部分[7],IVF-ET过程相当于同种异体移植,会激发母体的免疫耐受反应,有研究指出HLA-I类分子HLA-G表达于母胎界面并参与母胎耐受,维持正常妊娠,若它不能诱导CD8+T细胞凋亡,可能会导致母体将胚胎当成“异己”成分,是引起胚胎植入失败和复发性流产的原因之一[8],因此有人提出淋巴细胞免疫疗法可以刺激母体产生封闭抗体,提高临床妊娠率[9],但是有研究证实rs16833431位点C/C基因型及C等位基因频率在复发性流产患者经主动免疫疗法失败组中表达较高,得出rs16833431位点基因多态性可能是导致主动免疫治疗妊娠失败的遗传因素[10]。HLA-A和HLA-DQ分别属于经典的HLA-I类和HLA-II类基因中的一个亚区,其SNP位点是今年来研究的热点,根据SNP的二态性及其频率分布差异有助于分析某些疾病或者肿瘤的易感性,SNP在辅助生殖领域用于评价妊娠结局方面鲜有报道[11],有研究证实HLA-DQB1*0302在妊娠丢失组中的表达频率增加,相关HLA-DQ等位基因是复发性流产的危险因素[12],Sipakszmigiel O等人利用PCR-SSP在早期妊娠丢失的妇女中发现等位基因HLA-DQA、HLA-DQB5的频率与显著增加的妊娠失败风险有关[13],本课题前期研究成果也已证实HLA-DQ在妊娠成功组的表达相对于妊娠失败组较高[14],此次实验以HLA-DQ*0301以及HLA-A*3101位点去探究rs6928482、rs1056315、rs1061235基因型在妊娠成功组与失败组之间的表达差异,得出rs6928482中TT基因型表达频率明显高于失败组(P<0.05),与前期研究结果一致,因此HLA-DQB1*0301rs6928482T等位基因可能是IVF-ET患者妊娠反应的一个保护基因,但其影响机制仍需进一步探讨。上述SNP位点周围是否存在其他基因参与妊娠过程仍需进一步研究,加强对IVF-ET相关基因的多态性研究,从分子免疫以及遗传的角度探讨可能影响IVF-ET妊娠结局的因素,并揭示其影响机制为指导临床奠定理论基础,目前HLA与辅助生殖领域的有效结合,尤其是在胚胎植入前遗传学诊断 (PGD) 方面有了较大的突破,使得生殖中心开展PGD-HLA 联合和不联合单基因病的临床工作有了更有效的依据[15]。SNP芯片技术可以发现常规染色体核型分析不能发现的微小病变,找出胚胎植入失败以及早期流产的原因,为临床采取合适的孕前优生措施提供依据[16]。
