肿瘤坏死因子-α在糖尿病痛性神经病变患者中的表达及其意义
2020-02-07周冬梅凌宏威沈梦媛
张 悦,周冬梅,李 伟,凌宏威,沈梦媛
(徐州医科大学附属医院 内分泌科,江苏 徐州221000)
糖尿病周围神经病变 (DPN) 是糖尿病患者最常见的慢性并发症和主要致残原因之一,发病率高达60%-90%[1]。其中约1/3 的患者会出现肢体烧灼样痛、刺痛、电击样痛或刀割样锐痛,称糖尿病痛性神经病变(PDN)[2]。这类患者往往面对睡眠障碍、营养失调、运动受限、情感障碍的问题,严重影响了生活质量[3]。PDN的发病机制错综复杂,近年来有越来越多的证据支持炎症与PDN之间的关系[4]。肿瘤坏死因子(TNF-α)作为一种重要的炎症因子,通过中枢敏化和调节疼痛介质分泌等多种机制参与神经病理性疼痛的发生。研究发现抑制血清TNF-α的表达可以明显改善PDN大鼠的痛觉过敏症状[5],我们在临床中发现对症止痛难以彻底缓解PDN患者的痛苦。本文通过研究DPN及PDN患者血清TNF-α表达水平,为临床防治2型糖尿病痛性周围神经病变提供参考依据。
1 资料与方法
1.1 一般资料选取2017年1月至2018年10月期间于徐州医科大学附属医院内分泌科住院的糖尿病患者80例。根据中国2型糖尿病防治指南提出的DPN诊断标准及视觉模拟评分量表(VAS评分)将入组人群分为3组:单纯糖尿病组21例,非痛性糖尿病周围神经病变组44例,糖尿病痛性神经病变组15例。其中男53例,女51例,平均年龄53.89±15.26岁。选取同期至我院体检的健康对照组24例。纳入标准:①所有患者符合1999年版WHO制定的2型糖尿病诊断标准②DPN患者:既存在DPN症状或体征,同时肌电图提示神经传导功能异常的确诊DPN患者。对入组DPN患者进行视觉模拟评分(VAS),凡是超过0分为PDN患者。单纯DM患者:DPN症状、体征、神经传导功能异常三者均不存在。③自愿配合参与本次研究。排除标准:①合并急慢性感染者;②合并心、肺、肝、肾功能障碍者;③合并自身免疫性疾病者;④合并恶性肿瘤者;⑤合并其他可以引起周围神经病变的疾病如颈腰椎病变(神经根压迫、椎管狭窄、颈腰椎退行性变)、脑血管疾病、脊髓疾病、格林-巴利综合征、 严重动静脉血管病变 (静脉栓塞、 淋巴管炎)、(中毒性、营养性)周围神经病变、酒精性周围神经病(每日饮酒,持续至少1年以上,或每周1次,每次饮酒300 g以上,超过1年)。本研究符合2013年修订的《赫尔辛基宣言》,所有入组对象签署知情同意书。
1.2 研究方法
收集各组研究对象的一般资料包括:年龄、性别、糖尿病病程、有无吸烟饮酒、身高、体重、收缩压、舒张压,计算体质指数(BMI),每位研究对象完成VAS量表。受试者自前一日20:00开始禁食水,次日清晨空腹采肘静脉血,检测白细胞、中性粒细胞百分比(采用日本希斯美康XE-5000全自动血液分析仪),空腹血糖、甘油三酯、胆固醇、低密度脂蛋白、高密度脂蛋白、白蛋白、尿酸、胱抑素,C反应蛋白(采用德国罗氏cobas8000全自动生化(免疫)分析仪),空腹胰岛素(ARCHITECT分析仪i2000SR)、高效液相交换色谱法检测糖化血红蛋白(日本东曹HCL-723G8分析仪),ELISA法检测TNF(试剂购自上海江莱生物技术有限公司,酶标分析仪:Rayto RT-6100)。稳态模型评估胰岛素抵抗指数(HOMA-IR)=FPG*Flns/22.5。
1.3 统计分析

2 结果
2.1 各组一般资料比较
各组患者收缩压、舒张压、体重、身高、BMI、男女比例、饮酒史比较差异无统计学意义(P>0.05)。DPN、PDN组患者年龄、病程、吸烟人数比例均明显高于NC、DM组,差异均有统计学意义(P<0.05),见表1。

表1 各组患者一般资料比较
注释:a与NC组比较,P<0.05;b与DM组比较,P<0.05。
2.2 各组生化指标比较
NC组、DM组、DPN组、PDN组患者血清TNF-α水平依次升高,各组之间比较均有统计学意义(P<0.05)。PDN组CRP水平高于DPN组高于NC组,DPN组、PDPN组HbA1C、FIns高于DM组高于NC组。PDPN组HOMA-IR高于DM组高于NC组,差异均有统计学意义(P<0.05)。四组患者的ALB、Scr、UA、Cys-C、TC、TG、HDL、LDL、WBC、NE%水平比较差异无统计学意义(P>0.05),见表2。

表2 各组生化指标比较
注释:a:与NC组比较,P<0.05;b:与DM组比较,P<0.05;c:与DPN组比较,P<0.05 CRP:C 反应蛋白;TNF-α:肿瘤坏死因子α;ALB:白蛋白;Scr:肌酐;UA:尿酸;Cys-C:胱抑素C;FPG:空腹血糖;TC:总胆固醇;TG:甘油三酯;HDL:高密度脂蛋白;LDL:低密度脂蛋白;WBC:白细胞;NE%:中性粒细胞百分比;HbA1C:糖化血红蛋白;Flns:空腹胰岛素;HOMA-IR:胰岛素抵抗指数
2.3 TNF与临床指标的Spearman相关性分析
Spearman相关性分析结果显示,TNF-α与病程、年龄、吸烟、CRP、HbA1C之间均存在明显的正相关(rs>0,P<0.05),见表3。
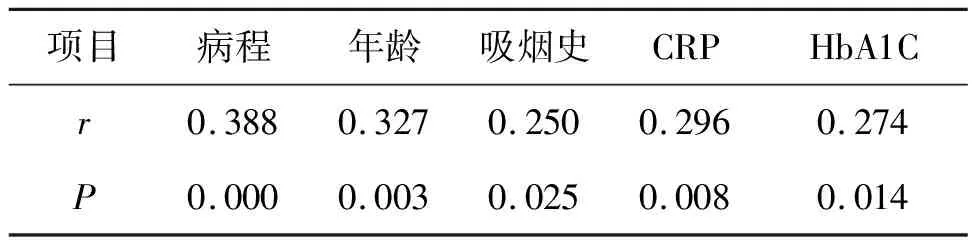
表3 TNF-α与临床指标的Spearman相关分析
2.4 多因素logistic回归分析PDN的危险因素
以是否PDN为因变量,分别以CRP、TNF-α、ALB、Scr、UA、Cys-C、FPG、TC、TG、HDL、LDL、HbA1C、Flns、HOMA-IR、BMI、年龄、病程、吸烟史、饮酒史为自变量,建立二元logistic回归模型。结果显示,CRP、TNF、HbA1C、年龄在模型中均有统计学意义(P<0.05)。将单因素分析中筛选出的影响PDN相关因素纳入多因素logistic分析,发现 TNF-α、CRP是PDN的独立危险因素(P<0.05),见表4。

表4 影响PDPN的多因素logistic回归分析
3 讨论
糖尿病痛性神经病变是常见的、难以治疗的糖尿病并发症之一,约占DPN患者的1/3。主要表现为自发性疼痛、痛觉过敏、痛觉超敏和一定程度的感觉缺失,应用镇痛剂效果差[6]。目前认为PDN的发生与损伤神经的异位放电、离子通道活性改变、丝裂原活化蛋白激酶MAPKs信号转导通路激活、交感神经系统激活、小胶质细胞活化、脊髓背角抑制性神经元递质的变化等机制相关[6-8]。根据发病机理,临床治疗往往围绕控制血糖、血压、血脂,营养神经、抗氧化、改善微循环及镇痛治疗。有研究报道TNF-α等炎性细胞因子在PDN的发生发展中发挥重要作用,它们的级联反应导致神经缺血、局部神经纤维脱髓鞘,从而引起痛觉及热觉过敏[9]。
一项荟萃分析发现与健康对照组相比,糖尿病患者合并DPN的TNF-α升高,DPN患者TNF-α水平越高 越容易合并痛性神经病变,且患者血清中TNF-α水平越高,疼痛反应越剧烈[10]。这和我们的研究结果相符。本研究发现NC组、DM组、DPN组、PDN组TNF-α的水平依次升高,Logistic回归分析发现矫正年龄、病程、糖化血红蛋白等因素后,TNF-α仍是PDN发生的独立危险因素。
CRP主要受TNF等炎症源性细胞因子调控[11]。本研究再次证实TNF-α与CRP呈正相关,CRP是PDN独立的危险因素。这和Herder等人之前的报告一致,即便在多变量调整后,CRP与糖尿病多神经病和一些神经缺陷也存在独立且持久的关系,进一步影响PDN的发生[12]。CRP是肝脏合成的急性时相反应蛋白,直接参与机体的炎症过程[13]。糖尿病周围神经病变是一种低度慢性亚临床炎症状态[14],而疼痛性神经病变与炎症标志物的进一步增加以及神经轴突反射减退相关[15]。因此,适度的抗炎治疗对PDN患者有重要影响,然而,非甾体类抗炎药(NSAIDs)由于其毒副作用限制了其临床应用。因此,探索新型的、安全、有效的抗炎治疗药物是非常重要的,以TNF-α为靶点的生物制剂将成为治疗PDN的热点。
高血糖是导致细胞因子调控异常的主要原因,本研究发现HbA1C与血清TNF-α呈正相关,考虑患者长期高糖状态激活并促使巨噬细胞浸润神经组织从而产生更多TNF-α[16]。本研究还发现PDN组、DPN组HbA1C水平高于DM组,HbA1c影响PDN的发生。考虑与以下机制相关:患者长期高血糖水平,醛糖还原酶介导的多元醇途径通量增加,神经营养因子减少,引起NCV下降,另一方面,高糖继发线粒体功能障碍、酰基肉碱的积累以及氧化应激,驱动炎症反应,多种细胞因子及趋化因子释放包括TNF-α,引发轴突脱髓鞘变性和神经炎症,最终引起DPN及PDN[17]。提示糖尿病患者积极控制血糖在一定程度上可以避免PDN的发生。本研究发现DPN、PDN组患者年龄、病程高于DM组,考虑与患者年龄增长,病程延长,AGEs堆积,神经组织损伤相关[6]。
本研究没有发现饮酒与PDN的相关性,我们推测试验剔除了长期大量饮酒的患者,而酒精摄入量与周围神经病变严重程度有直接的量效关系[18],不少患者虽少量饮酒,但尚未对轴突运输系统造成病理性改变[19]。当然,这仍需进一步的研究加以验证。
