温肾醒脑方对血管性痴呆大鼠Ang-1和HIF-1α表达的影响*
2020-02-06胡久略侯紫君张瓅方陈丽平王三沆
胡久略,商 健,侯紫君,张瓅方,陈丽平 ,樊 赟,卞 华,郅 琳,王三沆
(1.河南省张仲景方药与免疫调节重点实验室 ,河南 南阳 473004;2.河南中医药大学2018级硕士研究生,河南 郑州 450046 )
血管性痴呆(vascular dementia,VD)是由于脑血管系统的病理改变导致的缺血性、缺氧缺血或者出血性脑损伤所引起的严重认知功能障碍综合征。VD是继阿尔茨海默病之后世界上第二常见的老年痴呆症,占所有痴呆疾病的15%~20%[1]。目前临床直接用于VD治疗的药物较少且相关的药效学研究不系统。温肾醒脑方由经典名方四逆汤和地黄饮子化裁而来,临床治疗VD疗效显著[2]。本研究采用免疫组织化学法观察温肾醒脑方对VD大鼠Ang-1与HIF-1α的影响,探讨其抗缺氧与促进血管新生的作用,揭示温肾醒脑法的现代生物学基础,为中医药治疗脑损伤性疾病提供理论依据。
1 材料与方法
1.1 动 物
健康成年Wistar大鼠54只,雄性,体质量200~250 g,购自郑州大学动物实验中心,动物许可证号为医动字第20-012号。室温18~22 ℃下,自由饮水,普通饲料喂养,适应性饲养1周后进行实验。
1.2 药品、试剂与仪器
温肾醒脑方处方组成:桂枝 12 g,附子 20 g,半夏 10 g,巴戟天15 g,赤芍 15 g,石菖蒲 12 g,淫羊藿10 g,生晒参10 g,大黄 6 g,远志 10 g,甘草片 6 g。中药材经南阳理工学院中药教研室鉴定。将药物加水回流提取2次,第1次加10倍水提取2 h,第2次加8倍水提取1.5 h,药液过滤、合并浓缩至含生药1 g/mL,4 ℃保存备用,用时稀释。红四氮唑(TTC),购自上海山浦化工有限公司,批号20170913;BrdU单克隆抗体,购自美国Chemico公司,批号20160119;SABC试剂盒(批号20170816)、AEC显色剂(批号20171021)、Ang-1单克隆抗体(批号20170617)、HIF-1α单克隆抗体(批号20170911),均购自北京中杉金桥生物技术有限公司。KH-Q 360冰冻切片机,湖北欧美莱公司产品;FCLW6-20电热恒温水浴箱,上海善志仪器设备有限公司产品;SYZ-550型纯水蒸馏器,上海那艾精密仪器有限公司产品;CHS-D电子天平,日本赛多利斯公司产品。
1.3 动物分组与给药方法
将54只大鼠随机分为模型对照组、假手术组、温肾醒脑方组,每组18只。动物术后分别存活 3 d、7 d、14 d,每组每个时间点各6只。实验中各组死亡动物由重新造模随机递补。 动物分组结束即开始灌胃。温肾醒脑方组予以7.1 g/kg药液(体表面积换算,相当于60 kg成人量的3倍)灌胃给药,每天1次;模型对照组和假手术组给予等体积蒸馏水。
1.4 模型的建立
采用劳倦过度+房事不节法[3]制作肾(阳)虚大鼠模型,采用高脂饮食法[4]制作成痰瘀型动脉粥样硬化大鼠模型[5]。①诱导过度劳倦:每天强迫大鼠在水深为25 cm、25 ℃、容积 5 L的圆型玻璃缸内游泳,直至无力且下沉时捞出水面。②诱导雄性鼠房室不节:将每只雄性大鼠与6只发情期雌性鼠同笼喂养,每天更换发情期雌性鼠。③高脂饮食法:喂养高脂饲料25 g,火腿肠15 g。均连续进行1个月。
在成功制备肾(阳)虚痰瘀模型后,按照文献[6-7]方法制备急性期缺血再灌注VD模型:用100 g/L 水合氯醛350 μg/g腹膜内注射麻醉大鼠,固定大鼠于手术台上。常规消毒,颈部切口,双侧颈总动脉分离,穿线备用。同时,给大鼠腹腔注射硝普钠 3.5 μg/g 以引起低血压,用非侵入性动脉夹夹住双侧颈总动脉 10 min,再通10 min,如此反复进行3次,再通后缝合切口。放回笼中保温饲养,次日继续灌胃。假手术组仅分离双侧颈总动脉。手术后立即注射青霉素16 U/g体质量,连续 3 d ,以预防感染。
1.5 模型评价指标
行为改变表现为动物苏醒后提尾时左侧前肢的内收屈曲,同侧Horner征,爬行时向左划圈,站立时左侧倾倒。醒来 2 h后,根据Longa等的5级量表进行神经学评分。0级:行为无明显变化,计0分。1级:左前肢弯曲,左后肢伸展,计-1分。2级:有左侧追尾现象,计-2分。3级:行走困难,摇摆不定,计-3分。4级:无自发性活动,有意识障碍,计-4分。1级、2级和3级的大鼠被鉴定为成功模型并分配给每组。
1.6 检测指标
1.6.1 样本采集
造模后3 d、7 d、14 d各组大鼠分别断头取脑,取左侧大脑半球,立即在冰台上去除小脑、嗅脑和脑干,用冰生理盐水冲洗残血,吸干后称量组织质量,放置于-20 ℃冰箱保存。
1.6.2 神经功能评分
按照参考文献[8]方法进行5级评分。0分:无神经损伤症状。1分:不能完全伸展对侧前爪。2分:向瘫痪侧转圈。3分:向对侧倾倒。4分:不能自发行走,意识丧失。各组动物在手术后2 h和处死前2 h进行评分。
1.6.3 大鼠脑组织Ang-1和HIF-1α表达
采用免疫组织化学法检测。用组化笔标记制作的组织切片周围,放入体积分数为3%过氧化氢甲醇溶液中浸泡10 min灭活过氧化物酶,以蒸馏水清洗5 min,并用 0.01 mol/L PBS缓冲液洗5 min,反复3次;滴加100 μL马血清封闭105 min,倒掉溶液;加入兔 Ang-1和HIF-1α抗体(1∶300),37 ℃育1 h,0.01 mol/L PBS洗5 min,反复3次;加入生物素化二抗10 μL,37 ℃水浴 30 min,0.01 mol/L PBS 洗5 min,反复3次;加入过氧化物酶标记链霉卵白素100 μL,37 ℃水浴10 min,0.01 mol/L PBS洗 5 min,反复3次;滴加AEC显色剂10 min,0.01 mol/L PBS 洗 5 min,反复3次;65 ℃ 封片剂封片。另外以山羊血清与PBS替代一抗作为对照以检测免疫反应的特异性。
1.6.4 阳性细胞计数
AEC显色呈现红色,单标免疫组化细胞呈现红色则为阳性。每张图片随机选择5个视野,运用图象处理系统计数阳性细胞,并计算其平均数。
1.7 统计学方法
2 结 果
2.1 各组大鼠神经功能评分对比
手术后,各手术组大鼠均有较为明显的神经功能缺损现象,提示动物造模成功,各组间神经功能评分差别无统计学意义。随着大鼠存活时间的延长,各组大鼠的评分呈现逐步减少现象,提示大鼠具有一定的自愈能力。与假手术组对比,模型对照组和温肾醒脑方组大鼠神经功能评分差别有统计学意义(P<0.05或P<0.01)。与同一时间点模型对照组对比,用药3,7,14 d温肾醒脑组的神经功能评分降低,差别有统计学意义(P<0.05或P<0.01)。结果提示,温肾醒脑方能改善大鼠局灶性脑缺血神经功能缺失症状。见表1。


组 别造模后时间点3 d 7 d 14 d 假手术组0.00±0.00∗∗0.00±0.00∗∗0.00±0.00∗∗模型对照组1.97±0.39##1.56±0.34##0.89±0.32##温肾醒脑方组1.21±0.37∗∗##0.95±0.42∗##0.43±0.26∗##
注:与模型对照组对比,*P<0.05,**P<0.01;与假手术组对比, ##P<0.01。
2.2 各组大鼠Ang-1表达对比
假手术组大鼠脑组织内均有Ang-1蛋白不同程度的阳性表达,多位于胞浆,部分位于胞核,表达程度有所不同。脑缺血后Ang-1阳性细胞主要见于缺血周围区,随时间延长而增加。与假手术组对比,模型对照组和温肾醒脑方组在各时间点阳性细胞数明显增多,差别有统计学意义(P<0.01)。与模型对照组对比,温肾醒脑组在各时间点阳性细胞数明显增多,差别有统计学意义(P<0.01)。见表2,图1。
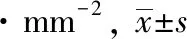

组 别造模后时间点3 d 7 d 14 d 假手术组13.04±1.07∗∗13.22±0.66∗∗13.17±2.05∗∗模型对照组21.16±1.23#25.53±2.41##36.39±5.24##温肾醒脑方组28.20±0.32∗##38.64±1.54∗##55.73±4.22∗##
注:与模型对照组对比,*P<0.05,**P<0.01;与假手术组对比,#P<0.05,##P<0.01。

造模后3 d假手术组:阳性细胞表达较少

造模后3 d模型对照组:阳性细胞表达增多

造模后3 d温肾醒脑方组:阳性细胞表达较多

造模后 7 d温肾醒脑方组:阳性细胞表达较多
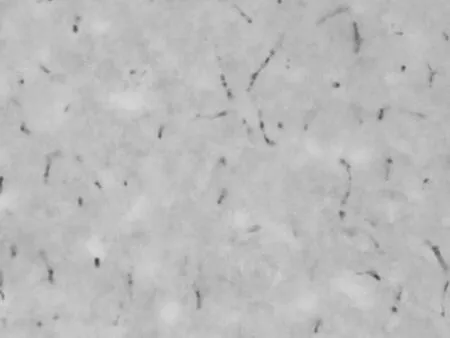
造模后 14 d 温肾醒脑方组:阳性细胞表达较多
2.3 各组大鼠HIF-1α表达对比
免疫组化结果呈现的HIF-1α染色阳性物质为深染棕红色,聚集在神经细胞胞体和轴突,在神经胶质细胞与神经纤维网处也可见到较多的阳性颗粒物沉着。在假手术组能见HIF-1α有较微弱的表达。模型对照组脑缺血后HIF-1α的表达呈现增强,并随着脑缺血时间的延长出现持续上升趋势,7 d后增长速度减慢,在14 d到达最高值。与假手术组对比,模型对照组和温肾醒脑方组在各时间点HIF-1α表达明显增高,差别有统计学意义(P<0.01)。与模型对照组对比,温肾醒脑方组在各个时间点HIF-1α 的表达均有明显增高(P<0.01) 。见表3,图2。
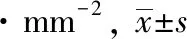

组 别造模后时间点3 d 7 d 14 d 假手术组12.16±0.73∗11.89±1.22∗∗11.82±0.89∗∗模型对照组20.85±2.88#26.83±2.25##35.45±3.27##温肾醒脑方组28.80±2.61∗#39.70±3.37∗##43.86±2.43∗##
注:与模型对照组对比,*P<0.05,**P<0.01;与假手术组对比,#P<0.05,##P<0.01。

造模后3 d假手术组:阳性颗粒物沉着较少

造模后3 d模型对照组:阳性颗粒物沉着增多

造模后3 d温肾醒脑方组:阳性颗粒物沉着较多

造模后 7 d温肾醒脑方组:阳性颗粒物沉着较多

造模后 14 d 温肾醒脑方组:阳性颗粒物沉着较多
3 讨 论
在血管生成过程中,Ang-1往往不参与调控内皮细胞的增殖,而是参与调节从形成内皮细胞层成为多细胞的精细血管的血管逐渐成熟的过程。研究表明,Ang-1在血管生成及血管新生的过程中往往与血管内皮生长因子(VEGF)在作用与表达上协同互补:早期,VEGF能够促进血管内皮细胞的增殖和迁移,从而形成均匀的基础血管网;后期,Ang-1对基础血管网实施重塑,形成大小不等的血管,最终生成完整、具备完善功能、有内皮与外膜细胞的成熟血管网[9-10],并且维持着成熟血管的相对稳定性。可见,在血管新生的后期过程中Ang-1发挥着至关重要的作用。
在脑缺血、缺氧后生成的HIF-1介导的基因转录、激活与低氧情况下细胞的存活息息相关,在脑缺血的保护中起至关重要作用。在缺氧状态下HIF-1α在胞浆内形成,然后进入细胞核并与HIF-lp结合生成了HIF-1。HIF-1是细胞低氧状况下非常重要的转录因子,能够激活转录诸多靶基因,比如VFGF、P53等,从而达到调控细胞对缺氧的耐受性[11]。研究表明,HIF-lα仅仅能在缺氧细胞核中存在,而HIF-lp能在缺氧细胞和正常细胞的胞浆,以及胞核中存在。
本研究发现:脑缺血后各组大鼠神经功能出现缺损,模型对照组神经功能随时间延长而逐渐恢复,温肾醒脑方能促进VD大鼠神经功能恢复,与模型对照组对比,在3,7,14 d差别均有统计学意义。Ang-1和HIF-1α阳性细胞在假手术组脑组织内有一定量的表达,VD模型后缺血周围区Ang-1和HIF-1α表达迅速增加,温肾醒脑方能促进Ang-1和HIF-1α表达,使其维持相对高水平。这些结果提示温肾醒脑方能促进VD大鼠缺血区微血管新生,其可能作用机制是通过调控Ang-1、HIF-1α表达来实现的。温肾醒脑方具有温肾逐痰、助阳化瘀之功,此研究结果为“阳化气,阴成形”理论在血管性痴呆中的临床运用提供了部分现代科学依据。
