失代偿期肝硬化并感染性休克患者住院死亡的危险因素分析
2020-02-03刘小丽黄帅黎钟山
刘小丽,黄帅,黎钟山
肝硬化是由多种原因导致的慢性进展性肝损伤,全球每年新增肝硬化死亡病例140万,居人群死因构成第5位,仅次于心血疾病、脑血管疾病、肺部疾病及恶性肿瘤[1]。由于肝脏具有强大的代偿功能,肝硬化早期肝功能可正常,随着肝损伤的加重,逐渐进入失代偿期。失代偿期肝硬化患者由于肝功能的低下,营养不良及免疫功能降低,极易合并感染,导致感染性休克[2-3]。感染性休克是失代偿期肝硬化患者病情进展,发生多器官衰竭及死亡的重要原因[4-5]。研究肝硬化并感染性休克患者预后的危险因素有助于对高危人群的筛查,减轻疾病负担[6],改善患者预后,目前研究的较少。本研究探讨合并感染性休克的失代偿期肝硬化患者住院死亡的危险因素,现报道如下。
1 资料与方法
1.1 研究对象
回顾性分析2010年6月至2020年6月我院住院治疗的175例失代偿期肝硬化并感染性休克患者的临床资料,其中男性119例,女性56例,年龄(52.56±8.38)岁;原发病:113例乙型肝炎,21例自身免疫性疾病,30例酒精性肝病,11例丙型肝炎。纳入标准:①肝硬化的诊断符合中华医学会制定的指南[7];②感染性休克的判定符合中国医师协会制定的指南[8];③年龄>40岁;④住院时间>48 h;⑤住院期间配合治疗[8]。排除标准:①合并肿瘤患者;②合并真菌感染者;③非感染导致的休克;④其他原因导致的死亡;⑤资料不完整患者。
1.2 方法
1.2.1 资料收集 通过电子病历系统搜集患者临床资料,包括年龄、性别、原发病、合并基础疾病等一般资料,入院后生化指标,系统评分,住院期间并发症等。生化指标包括白细胞(white blood cell, WBC)、白蛋白(albumin, Alb)、血小板(platelet, PLT)、红细胞分布宽度(red blood cell distribution width, RDW)、乳酸、血肌酐(serum creatinine, SCr)、总胆红素(total bilirubin, TBiL)、C反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)、丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)等,系统评分包括APACHEⅡ评分、序贯器官衰竭估计评分(sequential organ failure assessment, SOFA)评分。
1.2.2 研究终点 观察患者住院期间转归,住院时间2~30 d,平均(15.23±6.38)d。住院期间死亡者62例(35.43%)为死亡组,病情稳定出院者113例(64.57%)为存活组。
1.3 统计学分析
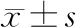
2 结 果
2.1 两组一般资料比较
如表1所示,死亡组合并糖尿病比率、肺部感染比率高于存活组,差异均有统计学意义(P<0.05)。两组年龄、男性比例、原发病比较差异无统计学意义(P>0.05)。
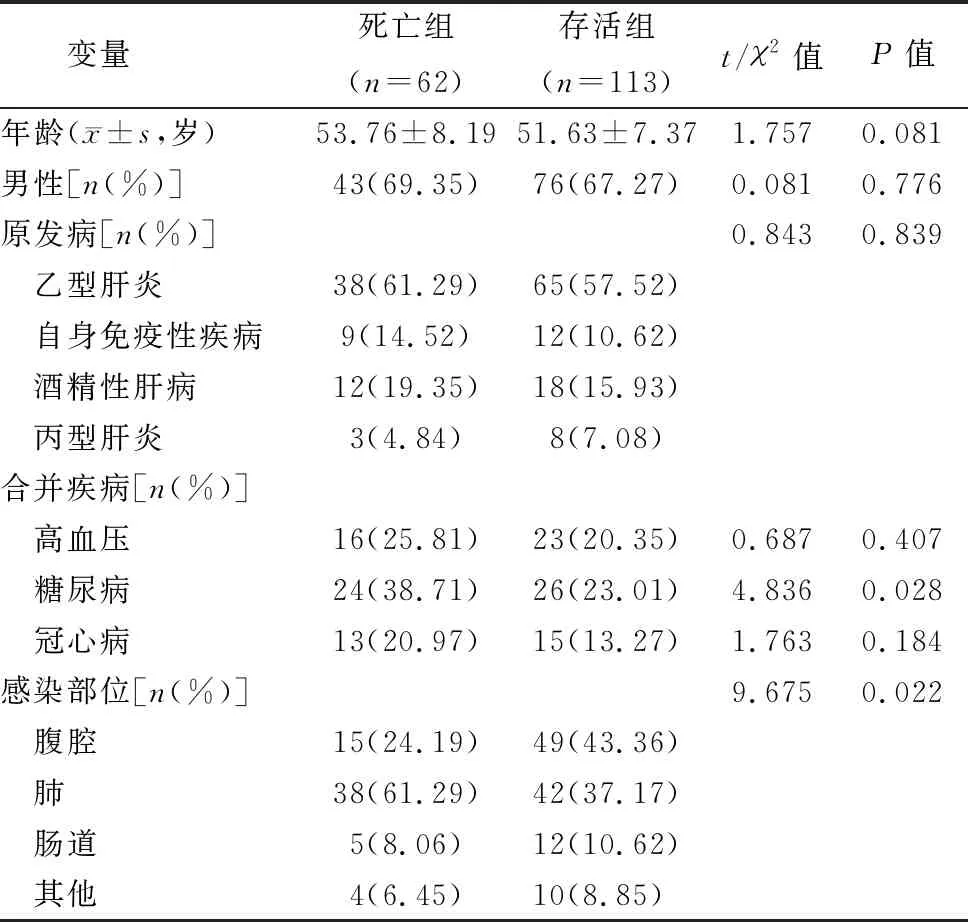
表1 两组一般资料比较
2.2 两组生化指标比较
如表2所示,死亡组PLT、Alb低于存活组,RDW、SCr、CRP、PCT、乳酸、机械通气时间、APACHEⅡ评分、SOFA评分高于存活组,差异均有统计学意义(P<0.05),两组WBC、ALT、AST、TBiL、cTnI比较差异无统计学意义(P>0.05)。
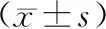
表2 两组生化指标比较
2.3 两组并发症比较
如表3所示,死亡组上消化道出血发生率高于存活组,差异有统计学意义(P<0.05),两组腹腔积液肝性脑病发生率比较差异无统计学意义(P>0.05)。
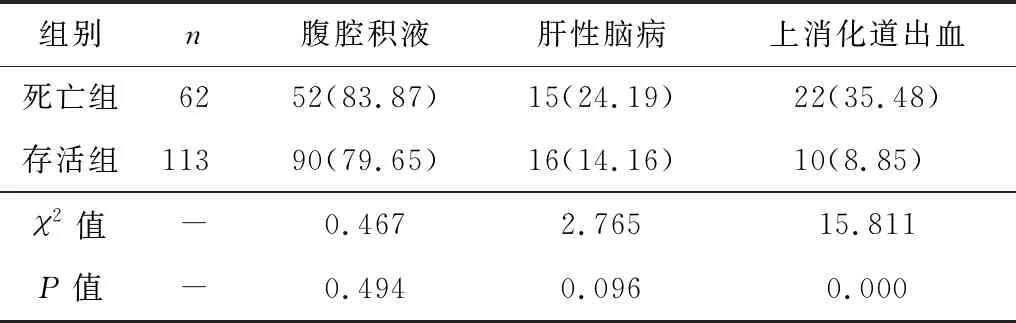
表3 两组并发症发生率比较[n(%)]
2.4 肝硬化并感染性休克住院死亡的多因素分析
考虑到单因素分析可能存在混杂因素,故将单因素分析P<0.1的指标(连续变量以中位数为界线转化为二分类变量)为自变量,年龄、糖尿病、机械通气时间为协变量,住院转归为因变量纳入模型进行多因素Logistic回归分析,结果显示肺部感染、上消化出血、RDW>14.95%、PCT>5.50 μg/L、乳酸>4.52 mmol/L、APACHEⅡ>20分是失代偿期肝硬化并感染性休克住院期间死亡的独立危险因素,见表4、表5。
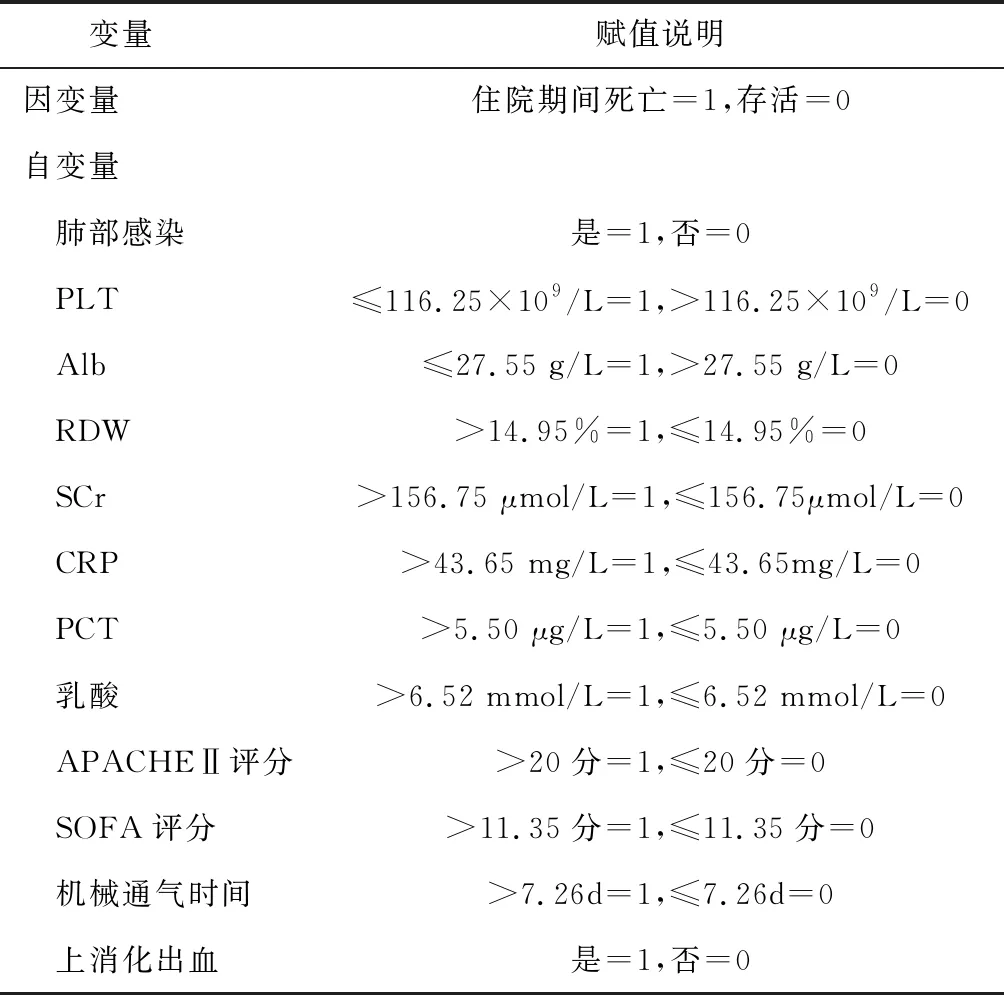
表4 多因素Logistic回归分析变量说明
2.5 ROC曲线分析
将上述多因素回归分析结果建立肝硬化并感染性休克患者预后回归方程,Logit(P)=-1.592+0.686(肺部感染)+0.356(上消化出血)+0.410(RDW)+0.533(PCT)+0.278(乳酸)+0.396(APACHEⅡ)。ROC曲线分析显示回归方程预测肝硬化并感染性休克患者住院死亡的AUC为0.818(95%CI:0.764-0.871,P=0.027),敏感性为79.03%,特异性为70.80%,提示具有较高的预测价值。见图1。
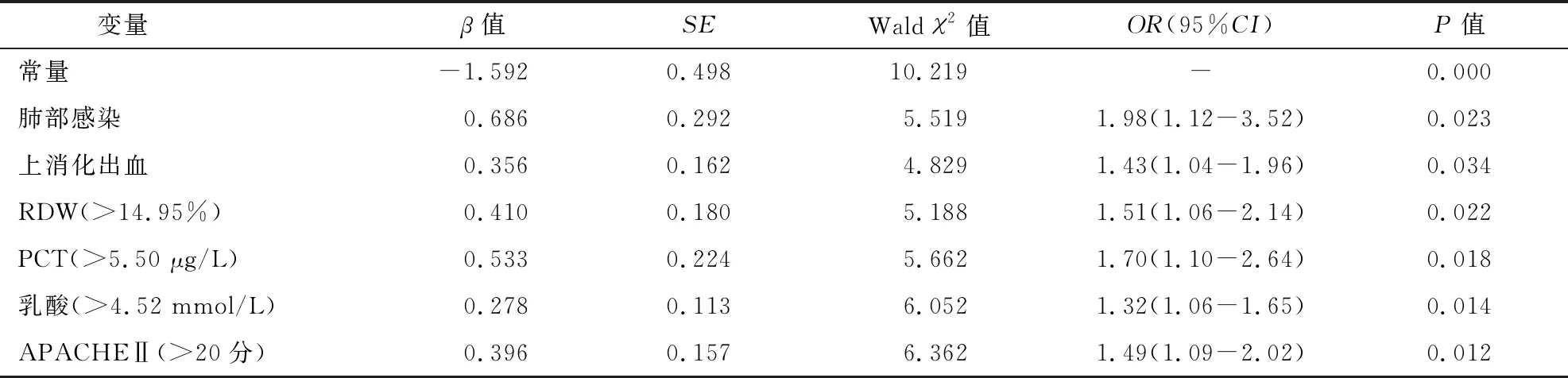
表5 肝硬化并感染性休克住院死亡的多因素logistic回归分析结果
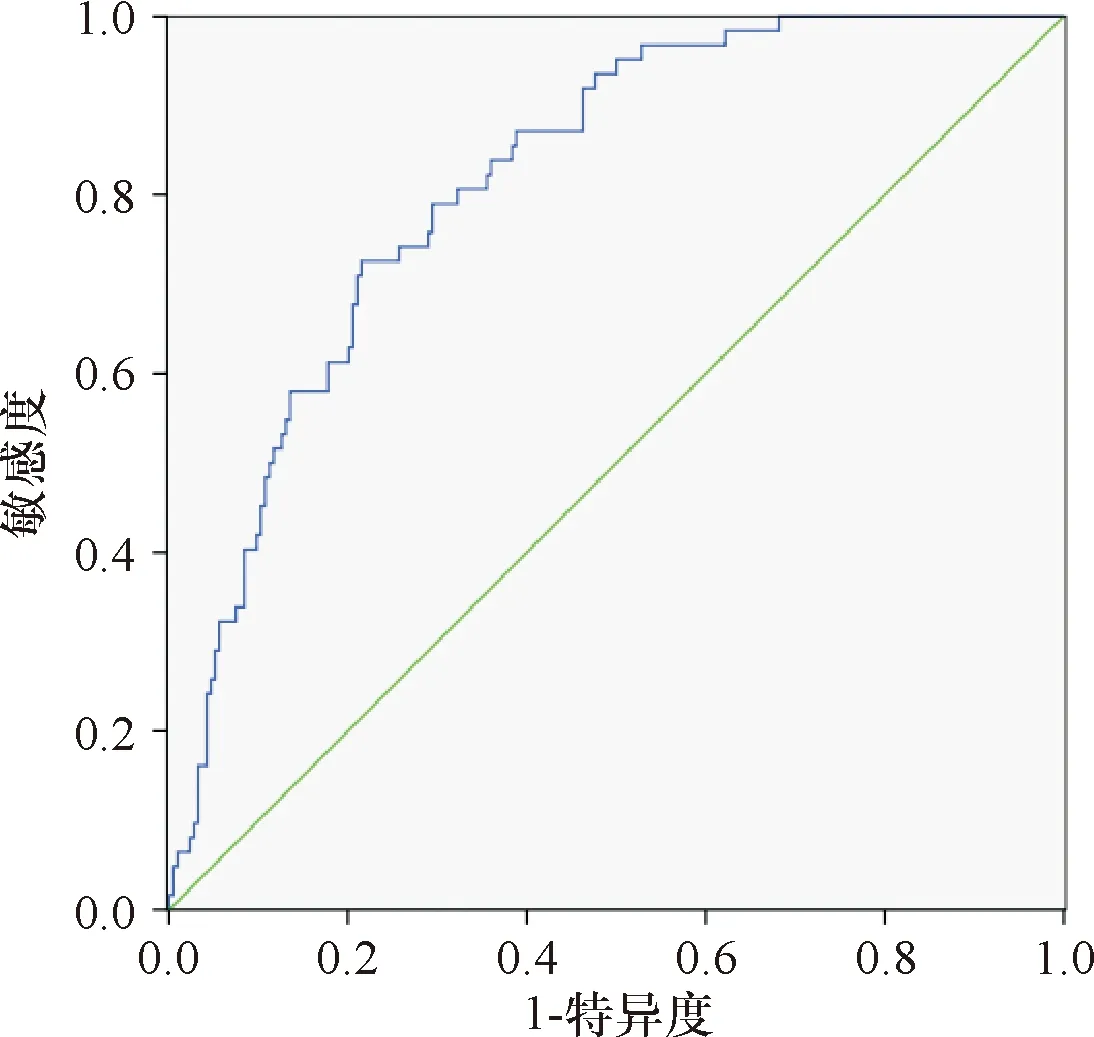
图1 回归方程预测肝硬化并感染性休克患者住院死亡的ROC曲线图
3 讨 论
感染性休克又称脓毒性休克,是由于持续的过度炎症反应引起的代谢紊乱、微循环障碍、多器官损伤等,患者病情进展快,院内死亡风险高[9]。肝硬化,特别是失代偿期肝硬化患者由于肝功能严重障碍,免疫球蛋白等合成减少,导致免疫功能低下,极易合并感染,若治疗不及时,可发展为感染性休克[10-11]。张健峰等[12]对81例感染性休克患者调查显示,住院期间死亡28例,病死率为34.57%。本研究175例肝硬化并感染性休克患者住院期间病死率为35.43%,与既往报道[13]相符。提示应警惕肝硬化患者发生感染性休克的风险,以降低院内病死率。
肝硬化并感染性休克多见于细菌感染,据报道可高达80%的肝硬化并感染性休克为细菌感染[13]。WBC、CRP及PCT均为反映炎症反应的常用指标,本研究死亡组CRP高于存活组,WBC与存活组比较差异无统计学意义,经多因素Logistic回归分析,二者均不是肝硬化并感染性休克患者住院期间死亡的危险因素,提示WBC、CRP并不能敏感反映肝硬化患者炎症状况,可能是失代偿期肝硬化患者多合并免疫抑制有关,且WBC受患者年龄、药物治疗的影响,特异性较差,而CRP明显升高多见于急性炎症、大面积组织损伤等。PCT是甲状腺C细胞释放的前体物质,一般情况下血液中含量降低。细菌感染时,PCT被大量合成并释放,其血液水平可迅速升高,并在感染后8~24 h血液浓度达峰值[15]。在细菌性感染及非细菌性感染的鉴别中,PCT不仅具有较高的敏感度和特异性,且可反映感染的严重程度[15-16]。既往文献[17]显示,随脓毒症病情加重血浆PCT逐渐升高,且其水平较高者预后较差。杨斌等[18]研究显示,感染性休克死亡患者血浆PCT更高。本研究死亡组PCT高于存活组,多因素Logistic分析显示PCT升高是肝硬化患者并感染性休克院内死亡的独立危险因素,PCT>5.50 μg/L者院内死亡风险是≤5.50 μg/L者的1.70倍,提示应密切监测其血浆PCT变化。
既往研究[19]认为,肝硬化导致的门脉高压导致胃肠道淤血,患者肠道及腹腔感染发生风险高。本研究结果显示,死亡组肺部感染比率高于存活组,且有肺部感染者院内死亡是无肺部感染者的1.98倍。肝硬化并感染性休克肺部感染的原因:①失代偿期肝硬化多出现腹腔积液,患者长期卧床引起坠积性肺炎,诱发肺部感染;②病原菌直接经呼吸道感染;③肺组织受上移的膈肌压迫,功能降低。肺部感染进一步降低肺功能,呼吸功能受限,引起代谢性酸中毒,增加死亡风险[13,20]。上消化道出血是肝硬化常见的并发症之一,其可增加患者感染风险,不利于短期康复[21]。本研究结果表明,出现上消化道出血是肝硬化并感染患者短期死亡的危险因素,与既往报道[22]一致。有研究[23]认为,预防性应用抗生素可降低上消化道患者感染、死亡风险,提示对白蛋白水平较低者可预防性给予抗生素治疗。
本研究单因素分析显示,死亡组RDW高于存活组,多因素logistic回归分析显示RDW>14.50%是肝硬化并感染患者住院死亡的危险因素。RDW可反映红细胞体积异质性,感染性休克患者由于过度的炎症反应可影响红细胞的成熟,导致红细胞异质性增加,另外,肾脏缺血导致促红细胞生成素分泌减少,使未成熟红细胞释放增多,导致RDW增加。脓毒症患者RDW增加,且随病情加重而升高[24]。赵静静等[25]研究表明,感染性休克死亡患者RDW高于存活患者,其与患者住院病死率呈正相关。高兰[26]研究发现,入院时RDW可有效预测脓毒症患者28d死亡风险。王喆等[27]研究显示,RDW升高的肺炎并感染性休克患者院内死亡的风险增加2.986倍,其预测效能ROC曲线的AUC为0.858,临界值为15.05%,与本研究结果相近。
乳酸为无氧糖酵解的代谢物质,可反映组织缺氧状况。正常情况下,乳酸的生成与代谢处于平衡状态,感染性休克由于微循环障碍,无氧代谢增强,其血乳酸升高与多器官衰竭关系密切[28]。国外报道[29]认为,血乳酸>4 mmol/L常提示患者短期死亡风险显著升高。APACHEⅡ评分是目前临床应用最广泛的危重病病情评估系统,可客观、准确、快速预测病情变化。有报道显示,危重症患者APACHEⅡ评分与PCT存在明显正相关,APACHEⅡ评分可用于危重症病情严重分级[30]。张健峰等[12]报道,感染性休克患者APACHEⅡ评分与乳酸清除率呈负相关,院内死亡患者血乳酸及APACHEⅡ评分均高于存活患者。周华涛[31]研究显示,血乳酸、APACHE II预测感染性休克院内死亡的AUC分别为0.743、0.765,血乳酸>5.25 mmol/L且APACHE II>26.5分的患者院内病死率为100%。目前,临床多认为APACHE II>20分提示患者病情较重,短期死亡风险较高[32]。本研究多因素分析显示乳酸>4.52 mmol/L、APACHEⅡ>20分是肝硬化并感染患者住院死亡的危险因素,与上述报道相符。此外,本研究多因素分析显示SOFA并非患者预后的影响因素,可能是SOFA评分侧重评估器官功能,对病情严重程度的评估较APACHEⅡ评分差。
本研究对多因素分析结果建立回归模型,ROC分析显示,回归方程预测肝硬化并感染性休克患者住院死亡的AUC为0.818,具有较高的预测价值。提示上述指标的筛查有助于临床对危重症患者的识别。
综上分析,肝硬化并感染性休克患者住院期间死亡风险较高,肺部感染、上消化出血、RDW>14.95%、PCT>5.50 μg/L、乳酸>4.52 mmol/L、APACHEⅡ>20分是其独立危险因素。临床应加大对上述高危人群的关注,以降低患者病死率,改善预后。但本研究为回顾性分析,且为单中心研究,其对实际临床工作中的意义需进一步研究证实。
