阿帕替尼联合TACE治疗肝癌疗效及对患者血管内皮生长因子和甲胎蛋白的影响
2020-02-03凌冰韩绪生杨勇赵东娇王玉荣蔡明城
凌冰,韩绪生,杨勇,赵东娇,王玉荣,蔡明城
原发性肝癌(primary hepatic carcinoma,PHC)是我国最常见恶性肿瘤之一[1],各类癌症致死率在全球排第3位,我国作为肝癌大国,肝癌发病及死亡例数约占世界总数的50%[2]。外科切除是治疗PHC最有效的方法,但多数患者早期无明显症状,在确诊时已达中晚期而失去了手术切除最佳时期[3]。肝动脉化疗栓塞术(transcather arterial chemoembolization,TACE)是针对中晚期肝癌最主要的姑息性疗法,但该术仍存在肿瘤灭活不彻底、侧支血管再生等不足,临床上多采用其他手段如微波消融、放射性粒子植入、靶向药物等进一步促进肿瘤细胞灭活[4-5]。阿帕替尼(apatinib)为目前较新的广谱抗肿瘤药物,其作用靶点为抗血管新生成达到抑制肿瘤细胞增殖的目的,阿帕替尼可经高度选择性竞争VEGF受体2(VEGFR-2)结合位点,而有效阻断下游信号传导,抑制酪氨酸激酶生成,继而抑制肿瘤组织新血管的生成,是一种多靶点的抗肿瘤药物,因此阿帕替尼联合TACE对中晚期肝癌有较好的疗效,可弥补单纯TACE的不足[6]。本文主要分析阿帕替尼联合TACE对肝癌的疗效与安全性。
1 资料与方法
1.1 资料
选取2017年1月至2019年3月于宿迁市人民医院介入科诊治的80例肝癌患者为研究对象。纳入标准:①经临床确诊为原发性肝癌,至少有1个可测量病灶,预计生存期>3个月;②不接受或拒绝外科手术切除,术前均未予以其他治疗;③巴塞罗那肝癌临床分期(BCLC)B~C期,肝功能Child-Pugh分级A~B级,卡氏评分>60分,且无远处转移。排除标准:①合并化疗禁忌症或严重凝血功能障碍者;②因难以耐受不良反应或其他原因停服药物超过1个月者;③合并严重心、肺、肝、肾功能障碍。随机分为观察组(n=40)、对照组(n=40),两组一般资料比较差异无统计学意义,见表1。所有患者均自愿签署知情同意书,且本研究经宿迁市人民医院伦理委员会批准。
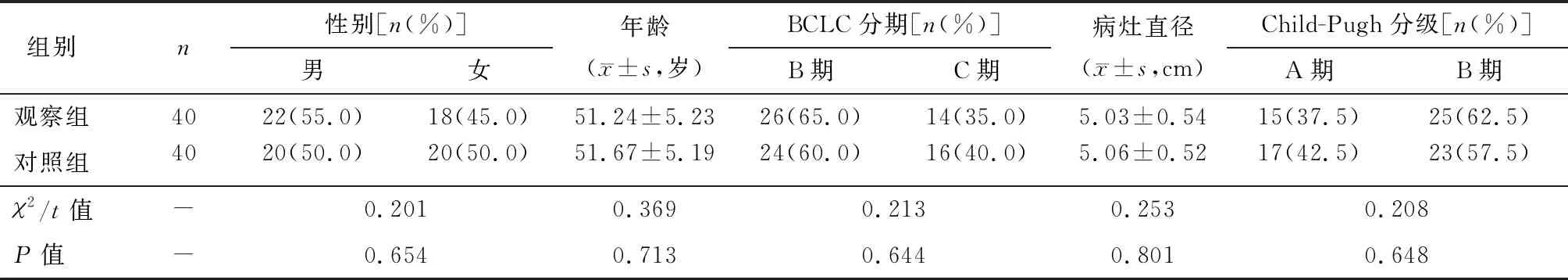
表1 两组一般资料比较
1.2 方法
对照组患者予以TACE治疗,观察组患者予以TACE联合阿帕替尼治疗。
1.2.1 TACE治疗
术前准备:完善DR、CT、MRI、超声影像学检查及实验室检查,明确肿瘤的部位、大小及数量,尤其需要重视肝、肾功能,凝血功能及肝炎病毒标志物的检查。签署手术知情同意书。准备好肝动脉造影导管、常用的化疗药物及栓塞剂等,右测腹股沟区备皮、消毒,术前20 min予以安定10 mg,地塞米松5 mg肌注。
TACE方法:患者平卧,采用Siemens Artis Zee数字平板为引导,穿刺点2%利多卡因局麻后,以Seldinger穿刺法置入5 F导管鞘,注入适量肝素盐水以预防血栓,导丝引导下引入RH导管,常规行腹腔干、肝总动脉,肠系膜上动脉造影,了解肿瘤的供血特点、分布及其滋养动脉情况,超选择插管至靶血管给予灌注化疗药物,然后注入碘油乳剂和(或)明胶海绵颗粒栓塞,直至肿瘤供血动脉血流中断并见肿瘤周围毛细门静脉显影,见图1。术中密切观察患者情况并询问其不适反应。术毕拔管压迫止血,加压包扎股动脉穿刺点,嘱其右下肢制动8 h,予以持续心电监护8 h,密切观察患者生命体征及足背动脉搏动情况。术后3 d大量补液,常规进行止吐、抑酸护胃、护肝治疗,术后30 d对影像学、实验室指标进行复查,若肿瘤有明确的血供,病灶有强化区域,需再次实施TACE。两组患者治疗后均随访12个月。
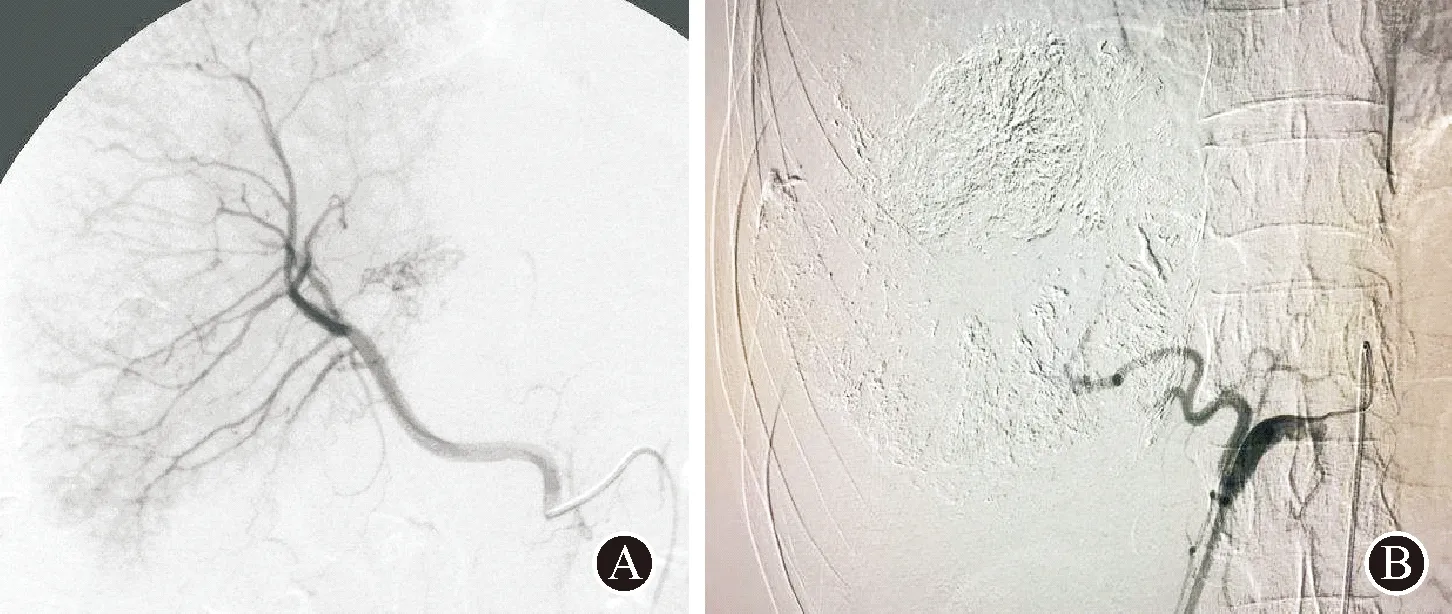
图1 TACE术 A:肝动脉造影 B:栓塞治疗后造影
1.2.2 阿帕替尼服用方法 TACE术后4 d开始口服阿帕替尼500 mg/d,在1~2周后依据患者的耐受情况调整药物剂量,若耐受性良好或不良反应轻则维持原来的剂量,若出现明显不良反应者则将阿帕替尼剂量减至250 mg/d继续观察或暂停服药,若不良反应降级或消失则可逐渐恢复原剂量,继续观察。停药时间≤1个月,下一周期TACE前4 d停服阿帕替尼,TACE术后4 d继续服用,以28 d为1个疗程。
1.3 观察指标
①依据修正的实体瘤疗效评价标准(mRECIST)评估两组治疗2个疗程后的临床疗效[7],完全缓解(CR):影像学检查动脉期无靶病灶强化征;部分缓解(PR):影像学检查发现动脉期内靶病灶组织无强化,病灶直径之和较治疗前缩小≥30%;疾病稳定(SD):影像学检查发现病灶直径之和缩小<30%,疾病进展(PD):影像学检查提示出现新病灶组织。客观缓解率=(CR+PR)/总例数×100%,疾病控制率=(CR+PR+SD)/总例数×100%。②收集患者治疗前、治疗后3个月、治疗后6个月空腹静脉血3 mL,离心分离血清,采用酶联免疫吸附试验测定血管内皮生长因子(VEGF)水平(试剂盒购自北京中杉金桥生物技术有限公司),应用E170全自动免疫分析仪(美国罗氏公司)以化学发光法测定甲胎蛋白(AFP)水平变化。③采用上述同样方法采集治疗前、治疗后6个月静脉血,采用深圳迈瑞BS-600全自动生化分析仪测定生化指标[总胆红素(TBiL)、丙氨酸转氨酶(ALT)、白蛋白(ALB)。④记录两组治疗后12个月内生存情况。⑤记录两组不良反应发生情况,包括栓塞后综合症(发热、腹痛、恶心呕吐等)及阿帕替尼相关不良反应(高血压、手足综合征、蛋白尿、腹泻、口腔溃疡、三叉神经痛等)。
1.4 统计学方法
采用SPSS21.0软件对数据进行处理。计数资料采用率%表示,采用2检验或Fisher精确概率法;计量资料在完成正态性检验后(不符合正态分布进行自然对数转化呈正态分布)以表示,行重复测量数据的方差分析、LSD-t检验、独立样本t检验、配对样本t检验;采用Log-rank检验分析两组间生存差异。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
治疗后6个月,观察组客观缓解率较对照组高(P<0.05),两组疾病控制率比较差异无统计学意义(P>0.05),见表2。
2.2 两组血清VEGF、AFP水平比较
治疗后两组血清VEGF、AFP水平均下降,且观察组治疗后3个月、6个月血清VEGF、AFP水平较对照组低,差异有统计学意义(P<0.05),见表3。

表2 两组治疗后6个月临床疗效比较[n(%)]

表3 两组血清VEGF、AFP水平比较
2.3 两组生化指标比较
治疗后6个月,两组TBiL、ALT均增加,而ALB下降(P<0.05),但观察组治疗后TBiL、ALT低于对照组,而ALB水平较对照组高,差异有统计学意义(P<0.05)。见表4。
2.4 两组近远期生存情况比较
两组6个月生存率均为100.00%,比较差异无统计学意义;观察组12个月生存率84.96%高于对照组62.57%(Log-rank2=4.166,P=0.041),见图2。
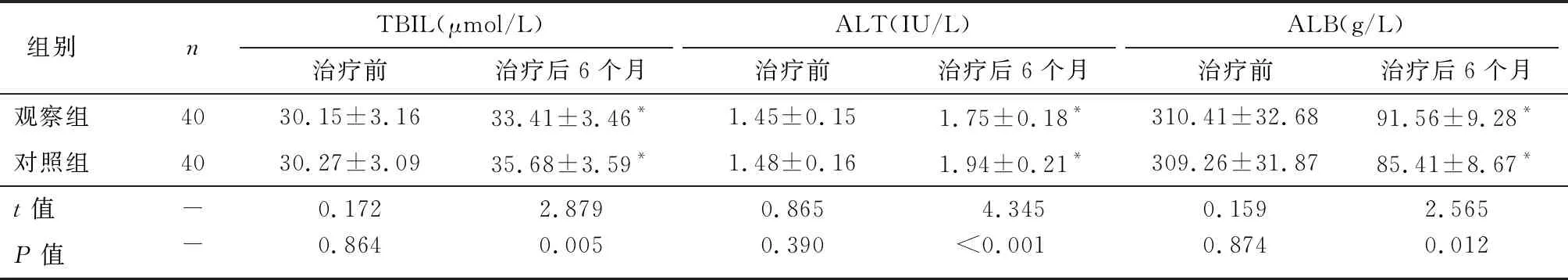
表4 两组生化指标比较
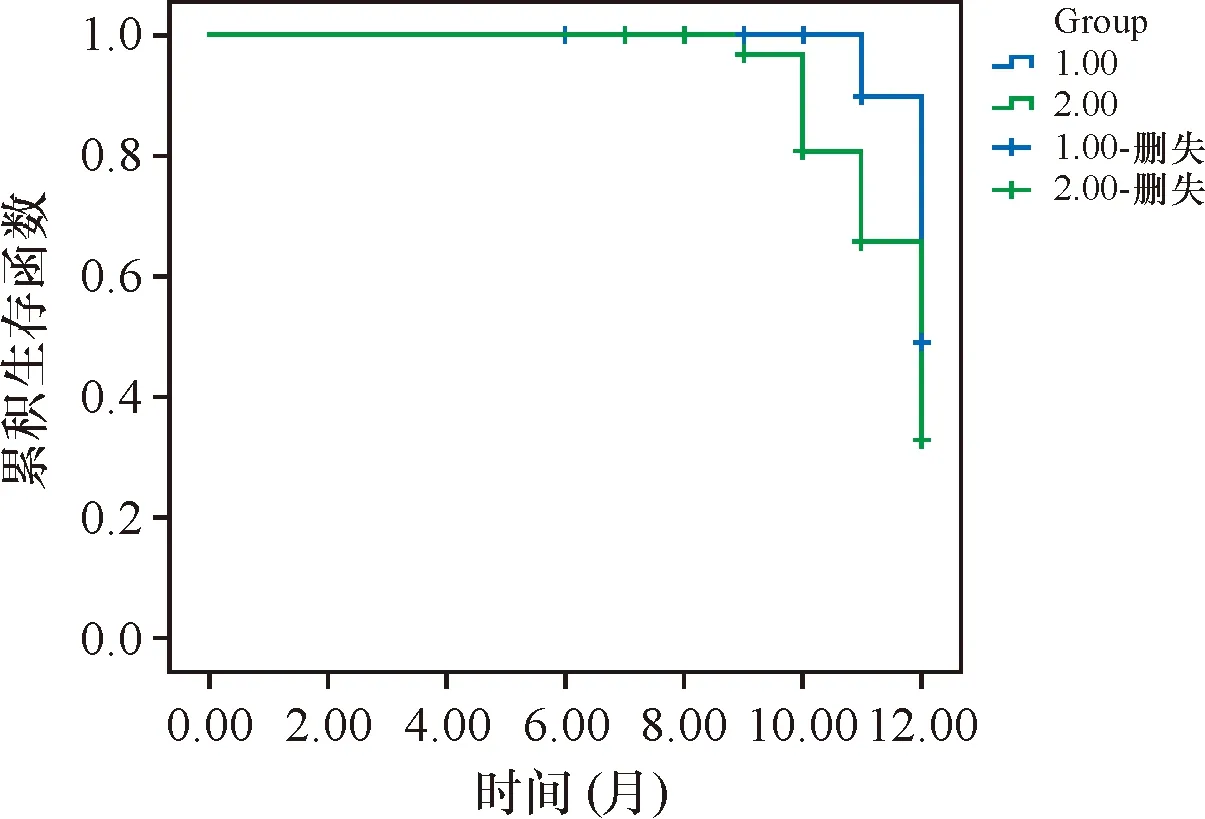
图2 两组生存曲线比较
2.5 两组不良反应发生率比较
两组栓塞后综合症比较差异无统计学意义(P>0.05);观察组的高血压、手足综合征、蛋白尿发生率较对照组高(P<0.05);两组腹泻、口腔溃疡、三叉神经痛发生率比较差异无统计学意义(P>0.05),见表5。所有不良反应予以对症治疗均缓解。
2.6 典型病例分析
患者女,58岁,原发性肝癌,接受TACE联合阿帕替尼治疗前后对比。见图3。
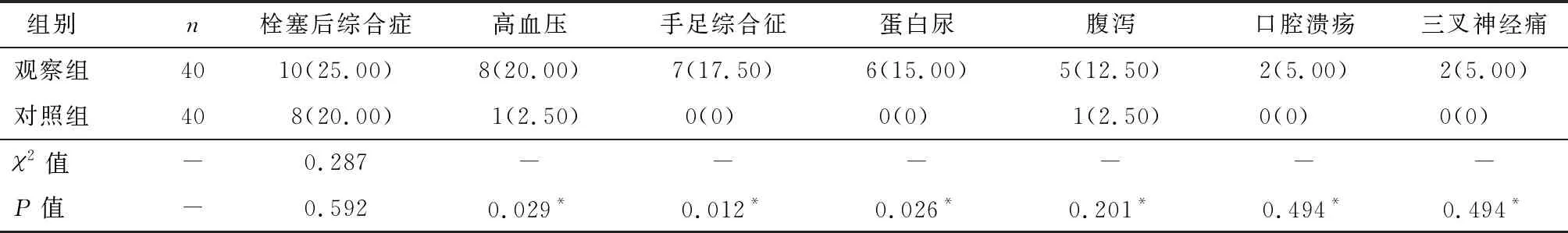
表5 两组不良反应发生率比较[n(%)]
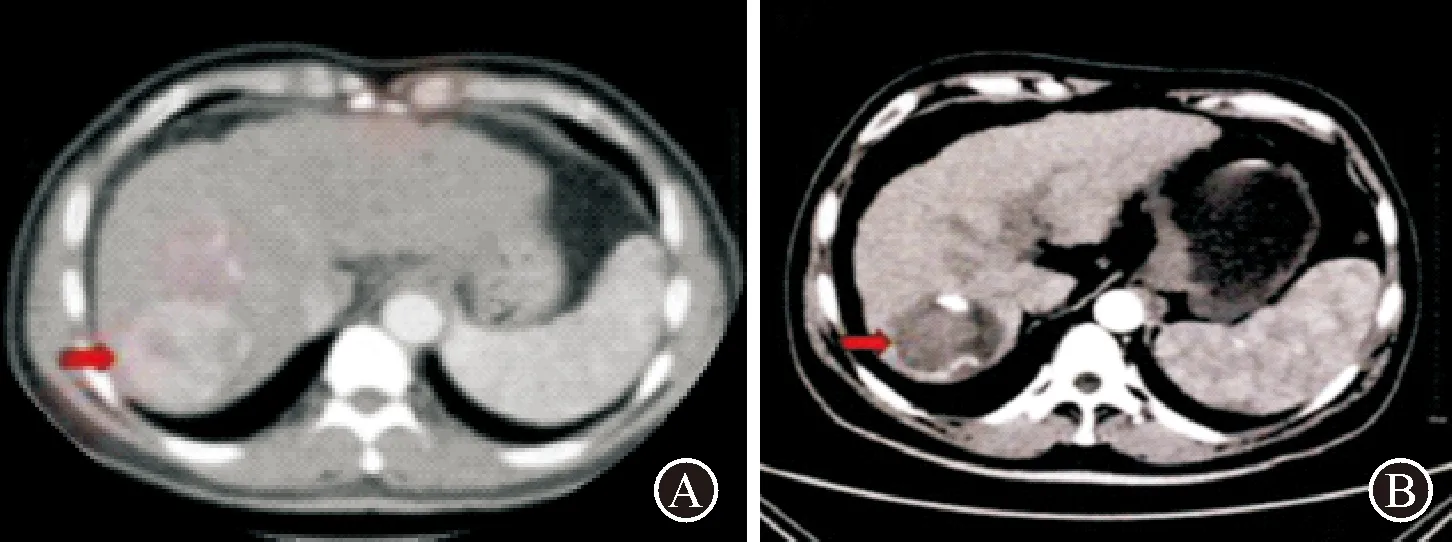
图3 肝癌TACE治疗前后影像比较 A:术前增强CT显示肝右叶5.8 cm×7.3 cm大小占位性病变(箭头所示),其内呈不均匀强化;B:治疗6个月后复查CT,结果显示病灶体积明显缩小,未见明确强化(箭头所示),疗效为PR
3 讨论
TACE是于DSA导引下将导管插入肿瘤供血动脉内,并注入化疗药与栓塞剂的微创疗法,其有创伤小、疗效显著、可重复优势,能明显抑制肿瘤进展,延长患者总生存期,由于肿瘤是多血供原因,单纯TACE抗肿瘤效果并非一劳永逸,多数患者术后因肝内残留病灶而复发,需多次接受TACE治疗或联合其他疗法[8]。TACE联合靶向药物是目前治疗肝癌的主流方式,其中索拉菲尼是世界公认治疗肝癌的抗血管药,能有效阻止肿瘤进展、延长患者生存周期,但部分肝癌患者对其并不敏感,较多患者不能承受且索拉菲尼高昂价格,因此寻找新型抗血管生成药物有重要意义[9]。阿帕替尼为我国自主研发的口服多靶点药物,服用方便,经阻断下游的信号转导,抑制酪酸激酶生成,这些机制也赋予阿帕替尼的靶向抗肿瘤且抑制肿瘤新生血管生成的作用[10],目前该药在胃癌[11]中开展了应用,因此考虑TACE联合阿帕替尼在肝癌中也有一定应用价值。
本研究显示,观察组治疗后6个月客观缓解率较对照组高,而疾病控制率组间比较差异无统计学意义,表明TACE联合阿帕替尼治疗肝癌可有效提高客观缓解率,与徐勤等[12]的报道结果不一致,可能与其观察时间(3个月)较本研究短有关。TACE术中肝动脉局部化疗药物灌注可促进肿瘤局部达到理想的药物浓度,而全身药物浓度低,可明显减轻化疗药所致的不良反应,此外经肿瘤供血动脉阻塞为肿瘤提供营养的血管,也有抑制肿瘤生长、灭活肿瘤组织及延长化疗药物接触时间作用,而联合应用阿帕替尼可选择性抑制VEGFR-2酪氨酸激酶的活性,使VEGF与受体结合的信号传导被阻断,肿瘤血管生成减少,从而发挥抗癌效力[13]。
单纯TACE术治疗肝癌疗效欠佳,主要是因为TACE术后肿瘤微环境处于缺血缺氧状态,AFP可在肝癌特定细胞周期下因低甲基化作用而表达开放,在VEGF、AFP等多种因子介导下使内皮细胞增殖、分裂及转移,从而促进肿瘤新生血管生长,最终引起肿瘤复发与进展[14-15]。本研究发现治疗后3个月、6个月,观察组血清VEGF、AFP水平明显低于对照组,这与黎莹等[16]报道的阿帕替尼联合TACE治疗肝癌患者后其AFP、VEGF水平低于对照组的结果一致,表明抑制外周血VEGF及AFP可能是阿帕替尼治疗肝癌的重要机制。
TBiL、ALT是反映患者肝功能的重要指标,在患者肝功能受损时,TBiL及ALT可明显增多,机体营养状态指标ALB下降[17]。本研究显示,治疗后两组TBiL、ALT均增加,而ALB下降,表明TACE术对肝癌患者生化指标有一定影响,而本研究也发现观察组治疗后TBiL、ALT低于对照组,ALB水平较对照组高,证实TACE联合阿帕替尼治疗肝癌后可明显减轻肝功能损伤,促进患者营养功能恢复,这与谢青云等[18]的研究结论相符。
对于生存情况,黄锐等[19]的研究发现,TACE联合阿帕替尼治疗中晚期肝癌后,观察组6个月、1年、2年生存率分别为93.3%、66.7%、38.6%,均高于对照组(单纯TACE术)83.3%、52.4%、15.0%,中位生存时间分别为14个月、19个月;曾广源等[20]的研究发现,阿帕替尼联合TACE治疗中晚期原发性肝癌后1年、2年生存率分别为86.84%、71.05%,高于对照组(单纯TACE术)的65.79%、52.63%。本研究发现,两组6个月生存率均为100.00%,比较差异无显著性,观察组12个月生存率(84.96%)高于对照组(62.57%),与上述报道结果略有差异,可能与研究对象样本量、观察时间等因素有关[21],但从总体上看本研究表明阿帕替尼联合TACE对提高肝癌患者远期生存有益。研究发现阿帕替尼治疗肝癌可能与其浓度依赖性上调人肝癌HepG2细胞抑癌基因p53、caspase-3、caspase-8表达,抑制人肝癌HepG2细胞生长及迁移愈合有关[22-23],因此关于阿帕替尼治疗肝癌的机制后期值得进一步研究。
本研究也发现,随访期间,两组栓塞后综合症比较差异无统计学意义,而观察组高血压、手足综合征、蛋白尿发生率高于对照组,经对症处理后缓解,与金鑫荔[24]报道的两组栓塞后综合症(发热、腹痛、恶心呕吐等)发生率比较差异无显著性,B组阿帕替尼相关不良反应发生率高于A组的结果基本一致,表明阿帕替尼联合TACE治疗肝癌安全可靠,不会引起严重不良反应,经对症处理后一般可缓解,一项分子生物学研究也发现,阿帕替尼口服给药后,于药效靶器官内有较高浓度分布,有效剂量下动物耐受性较好[25]。
综上所述,阿帕替尼联合TACE治疗肝癌可提高患者临床缓解率,调节其血清VEGF、AFP水平,改善生化指标,安全可靠,值得在临床推广实践。
