过表达FOXN3对食管癌细胞生物学的影响
2020-02-03李军胡涛周东生王青涛魏冬
李军,胡涛,周东生,王青涛,魏冬
食管癌是发生在食管上皮组织的恶性肿瘤,占所有恶性肿瘤的2%,全球每年约有30万人死于食管癌。中国是世界上食管癌的高发国家,也是世界上食管癌高死亡率的国家之一,平均每年病死约15万人[1]。叉头框蛋白家族(FOX)是一类DNA结合区具有翼状螺旋结构的转录因子,参与细胞周期进程的调控、胚胎的发育以及肿瘤的发生,在生物过程中发挥重要作用。近年来的研究发现,许多FOX蛋白与人类癌症有关,且可以作为药物靶标进行治疗[2]。叉头框蛋白N3(FOXN3)是FOX蛋白家族的一员,已有研究表明其在大多数恶性肿瘤中充当肿瘤抑制因子的角色[3]。例如FOXN3在骨肉瘤中下调并转录调节沉默信息调节因子6(SIRT6)抑制骨肉瘤细胞迁移和侵袭[4]。FOXN3过表达可能会抑制急性髓细胞白血病(AML)细胞系中的细胞增殖,诱导细胞周期S期停滞并促进OCI-AML3和THP-AML细胞凋亡[5]。而Wnt/β-catenin(β-连环蛋白)信号通路是最经典的致癌信号传导通路之一,该信号通路的过度激活通常会导致恶性肿瘤的发生,例如食管癌、肝癌、肺癌等[6]。目前,FOXN3在食管癌中的功能作用仍然未知,本研究通过探究FOXN3对食管癌细胞增殖、迁移、侵袭和凋亡的作用,并进一步研究相关机制,为探讨食管癌新的治疗方法提供一定实验依据。
1 材料与方法
1.1 主要试剂与仪器
RPMI 1640培养基、Lipofectamine 2000试剂(ThermoFisher公司),10%胎牛血清(Hyclone公司),食管癌细胞、食管上皮细胞HEEC(中国科学院上海生科院),pcDNA3.1载体质粒、pcDNA3.1-FOXN3载体质粒(上海吉玛制药技术有限公司),所有引物(广州锐博公司),Cell Counting Kit-8试剂盒(CCK-8,同仁化学研究所),V-FITC/PI细胞凋亡检测试剂盒(Sigma Aldrich公司),PI-RNase A试剂(FuDunBio公司),cleaved-Caspase-3兔单克隆抗体(ab32042)、Ki-67兔单克隆抗体(ab92742)、MMP-2兔单克隆抗体(ab92536)、Wnt1兔多克隆抗体(ab15251)、β-catenin兔单克隆抗体(ab32572)、GAPDH兔单克隆抗体(ab181602),山羊抗兔IgG二抗(ab6721,上海Abcam公司)。
FACS细胞仪、CellQuest软件3.3版(BD Biosciences公司),Transwell小室(上海生博生物公司),培养箱(ThermoFisher公司),化学发光成像仪(GENE GNOME)、酶联免疫检测仪(Thermo labsystem公司),IX71倒置显微镜、CellSens Dimension软件(Olympus公司)。
1.2 RT-qPCR检测Eca-109、KYSE-30和TE-1的表达水平
使用Trizol试剂提取来自食管上皮细胞HEEC、食管癌细胞Eca-109、KYSE-30和TE-1的总RNA。按照反转录试剂盒将总RNA合成cDNA,然后进行RT-qPCR扩增。反应条件:预变性95 ℃ 10 min,变性95 ℃ 15 s,退火56 ℃ 60 s,72℃延伸2 min,共循环35次。以GAPDH作为内参基因,采用2-ΔΔCt的方法进行相对定量分析。引物见表1。并选取FOXN3表达量最低的细胞进行后续的实验。
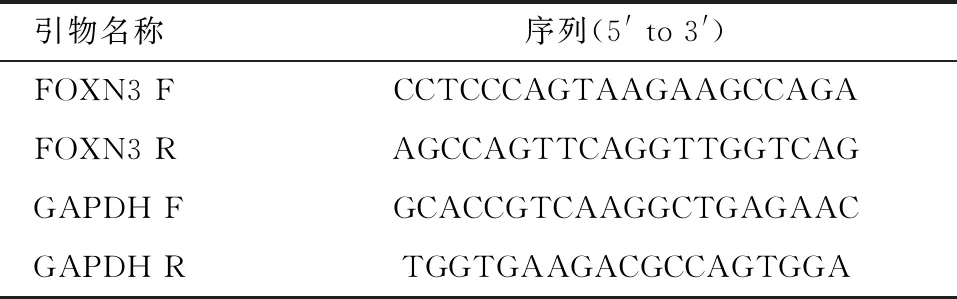
表1 Real-time PCR引物
1.3 细胞培养与转染
所有细胞均在含10%胎牛血清(FBS)的RPMI 1640培养基中,并在37 ℃ 5% CO2的培养箱中培养,3 d传代一次。将表达量最低的Eca-109细胞以2×105个/孔的密度接种到6孔组织培养板中,将细胞分为FOXN3过表达组、空载体对照组和对照组,其中对照组不做处理。用6 μg/mL的pcDNA3.1-FOXN3或pcDNA3.1转染Eca-109细胞转染,转染48 h后,将各组细胞转移至完全培养基继续培养,分别作为FOXN3过表达组和空载体对照组。收集对数期的细胞用于后续实验。
1.4 CCK8检测细胞增殖
将各组细胞悬浮液稀释至2×103个/mL,接种至96孔板(100 μL/孔)中。向每个孔中加入10 μL Cell Counting Kit-8溶液后,将板在培养箱中孵育1 h,并在450 nm处测量吸光度在24、48和72 h后用酶标仪读取。根据吸光度值绘制细胞增殖曲线。重复实验三次。
1.5 流式细胞仪检测细胞凋亡及细胞周期
收集转染后各组细胞,用PBS洗涤两次,调整细胞浓度为1×106个/mL,重悬于500 μL结合缓冲液中。加入Annexin V-FITC和PI溶液在避光条件下25 ℃孵育15 min。PBS洗涤两次后,用FACS细胞仪检测细胞凋亡的速率。收集细胞,用PBS洗涤两次,在-20 ℃下用75%乙醇固定细胞1 h。PBS洗涤后置于PI-RNase A试剂中,在室温下避光孵育25 min,PBS洗涤后用流式细胞仪检测细胞周期,重复实验三次。用CellQuest软件进行分析。
1.6 Transwell检测各组细胞侵袭水平
将8 μm膜孔径12孔的Transwell小室放入培养板中,上室加入接种在200 μL无血清RPMI-1640培养基中浓度为5×104个/孔的各组细胞悬液,下室加入600 μL含10% FBS的RPMI-1640培养基。培养24 h,清除未穿透的细胞,并将剩余的细胞在95%乙醇中固定15 min,然后用0.1%结晶紫染色15 min。在倒置显微镜(×200)下成像,并计数细胞数。重复实验三次。
1.7 细胞划痕实验检测各组细胞迁移水平
在培养皿的背面划过5条直线,间隔为0.5~1.0 cm。在培养皿中加入2 mL浓度为2.5×105个/ mL的各组细胞,培养24 h。使用无菌10 μL移液器吸头垂直于五根基线进行一次刮擦。然后,用PBS洗涤细胞并添加2 mL无血清培养基以观察细胞。通过Olympus IX71倒置显微镜在0、24 h捕获划痕图像,用Olympus CellSens Dimension软件分析划痕的宽度。重复实验三次。
1.8 Western blot检测cleaved-Caspase-3、Ki-67、MMP-2、Wnt1和β-catenin蛋白表达
转染后各组细胞,用RIPA裂解并提取细胞总蛋白,加入5×上样缓冲液,沸水浴后分装保存蛋白质样品。通过SDS-PAGE(10%)分离蛋白质样品,并与相应的一抗[cleaved-Caspase-3 (1∶1 000)、Ki-67 (1∶5 000)、MMP-2 (1∶5 000)、Wnt1 (1∶1 000)、β-catenin (1∶5 000)、GAPDH (1∶10 000)]在4 ℃下孵育过夜。第2天室温复温并漂洗后加入山羊抗兔IgG二抗(1∶10 000)孵育,在化学发光成像仪内显影。重复实验三次。
1.9 统计学方法
2 结果
2.1 FOXN3在食管癌细胞中的表达
食管癌细胞Eca-109、KYSE-30、TE-1中FOXN3的相对表达量较食管上皮细胞HEEC显著下降(P<0.05),其中Eca-109细胞FOXN3相对表达量最低,选取用于后续实验,见图1。
2.2 过表达FOXN3抑制Eca-109细胞增殖
与对照组和空载体对照组比较,FOXN3过表达组细胞增殖能力显著下降(P<0.05),Ki-67蛋白相对表达量显著下降(P<0.05),见图2。
2.3 过表达FOXN3促进Eca-109细胞凋亡
FOXN3过表达组细胞凋亡率较对照组和空载体对照组显著升高(P<0.05),且过表达FOXN3后,Eca-109细胞G0/G1期比例显著升高,S期比例显著下降(P<0.05),cleaved-Caspase-3蛋白相对表达量显著升高(P<0.05),见图3,提示过表达FOXN3阻滞Eca-109细胞周期,促进细胞凋亡。
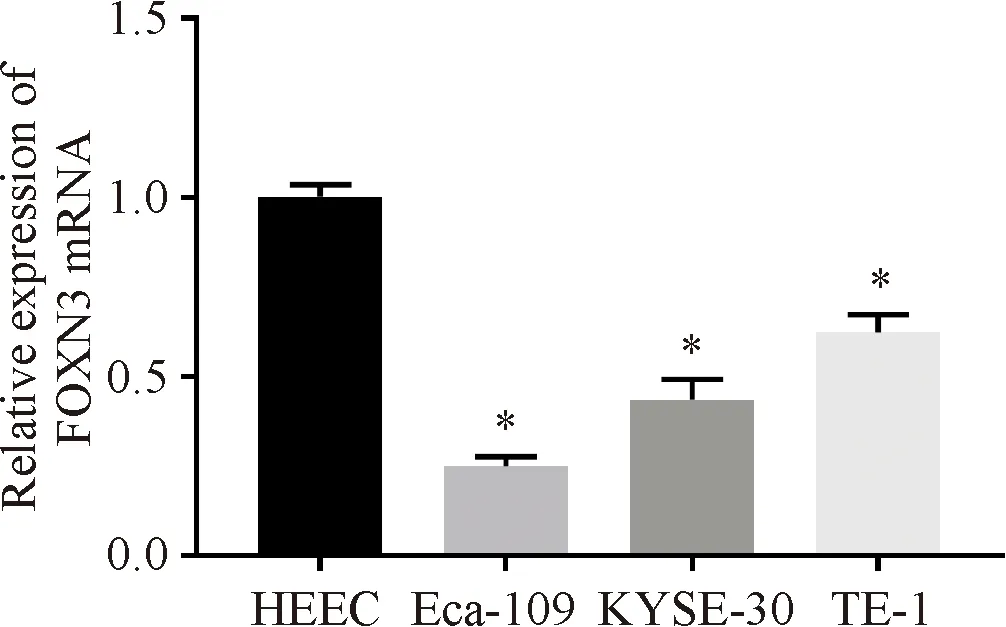
图1 FOXN3在食管癌细胞中的表达 与食管上皮细胞HEEC比较,*P<0.05
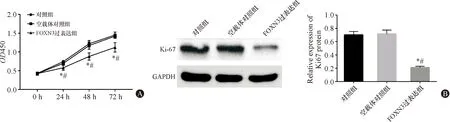
图2 过表达FOXN3抑制Eca-109细胞增殖 A:三组细胞增殖趋势;B:三组细胞Ki-67蛋白表达。与对照组比较,*P<0.05;与空载体对照组比较,#P<0.05
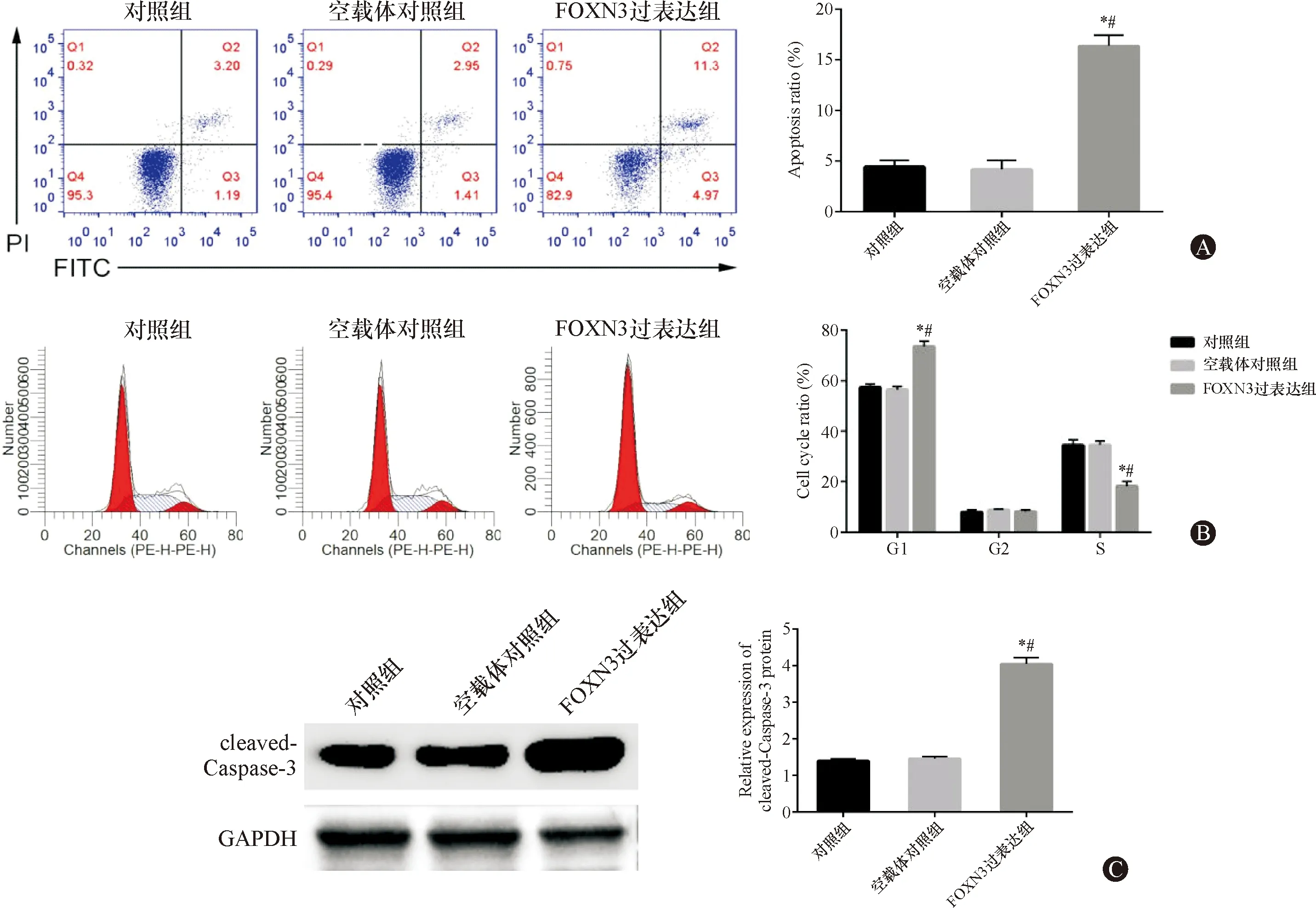
图3 过表达FOXN3促进Eca-109细胞凋亡 A:三组细胞凋亡结果图;B:三组细胞细胞周期图;C:三组细胞cleaved-Caspase-3蛋白表达。与对照组比较,*P<0.05;与空载体对照组比较,#P<0.05
2.4 过表达FOXN3抑制Eca-109细胞侵袭和迁移
FOXN3过表达组细胞侵袭能力以及MMP-2蛋白相对表达水平较对照组和空载体对照组显著下降(P<0.05),划痕宽度显著大于对照组和空载体对照组(P<0.05),提示过表达FOXN3抑制Eca-109细胞侵袭和迁移,见图4。
2.5 过表达FOXN3抑制Wnt信号通路
与对照组和空载体对照组比较,FOXN3过表达组Wnt1和β-catenin蛋白相对表达量显著下降(P<0.05),说明过表达FOXN3对Wnt信号通路起到抑制作用,见图5。
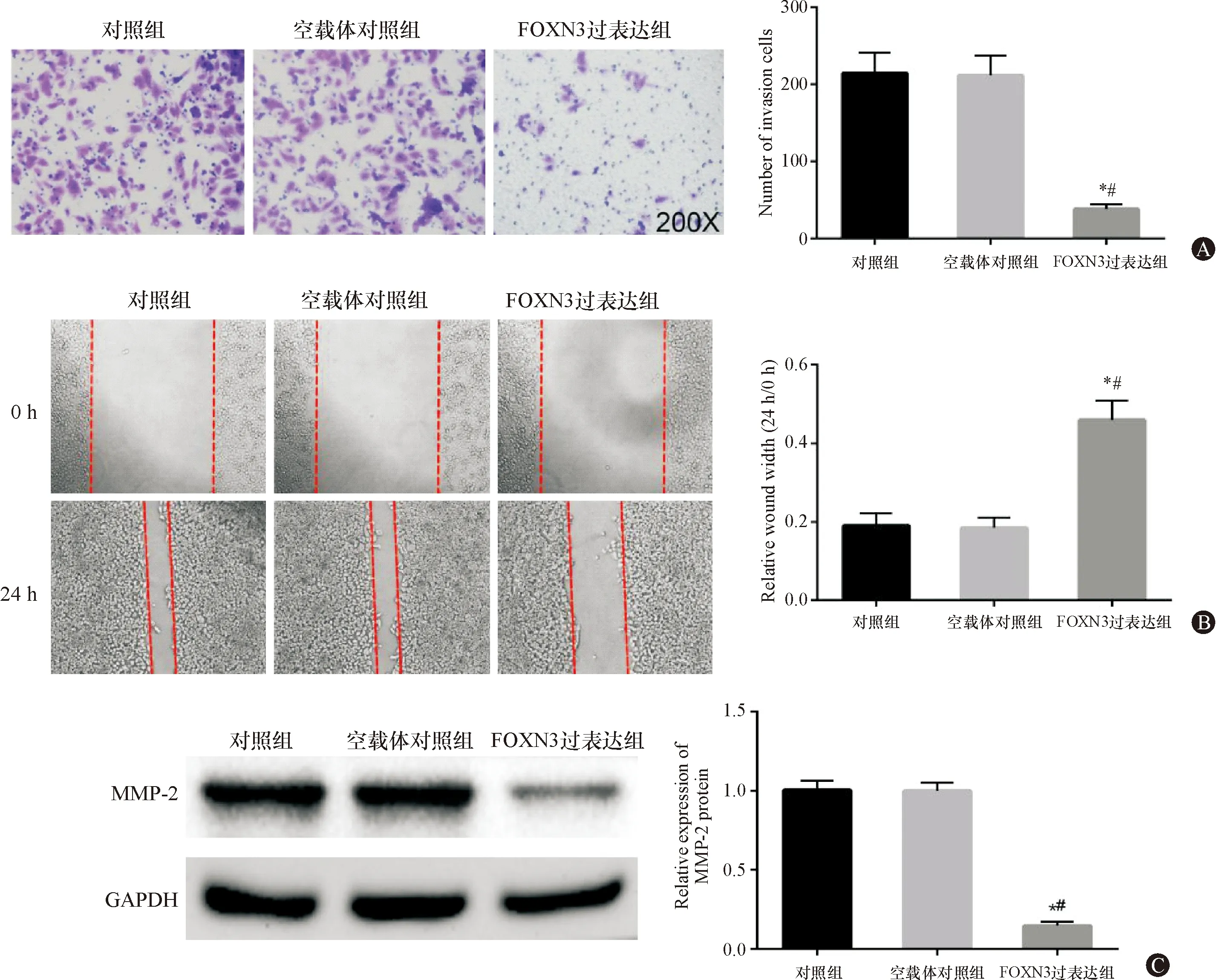
图4 过表达FOXN3抑制Eca-109细胞侵袭和迁移 A:三组细胞侵袭数目;B:三组细胞划痕宽度;C:三组细胞MMP-2蛋白表达。与对照组比较,*P<0.05;与空载体对照组比较,#P<0.05
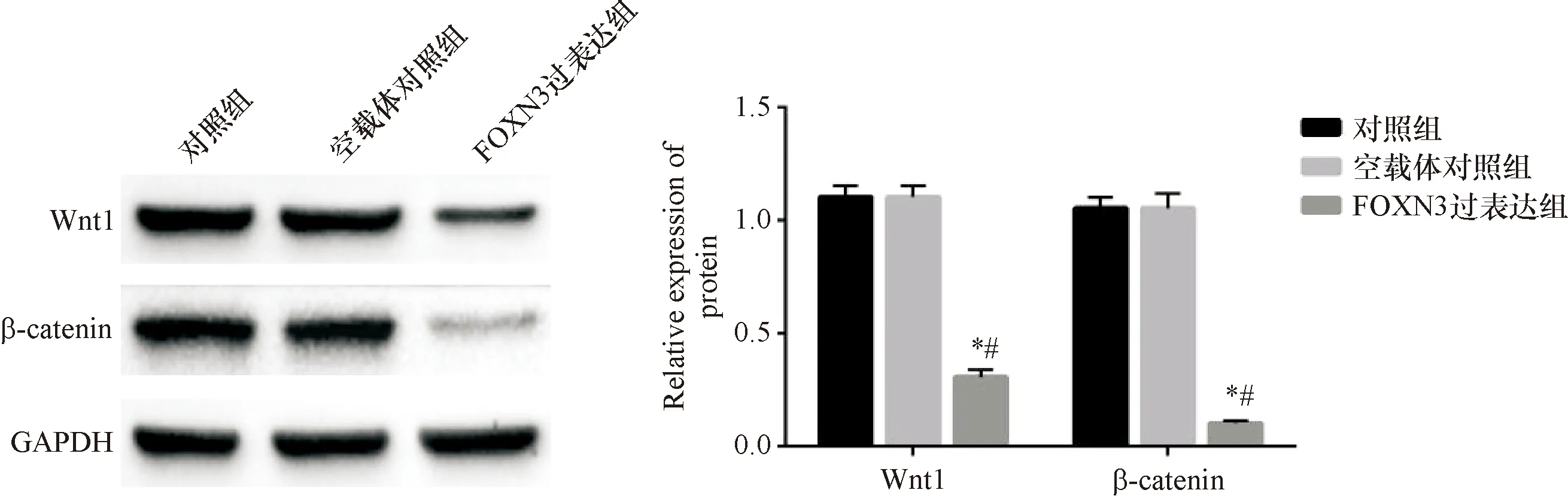
图5 过表达FOXN3抑制Wnt信号通路 与对照组比较,*P<0.05;与空载体对照组比较,#P<0.05
3 讨论
食管癌是原发于食管的恶性肿瘤,主要表现为吞咽食物时哽咽感、异物感、胸骨后疼痛或明显的吞咽困难。多数患者在诊断时已是晚期,化疗过程中易出现耐药,尽管目前对食管癌患者的管理和治疗有所改善,但总的预后依旧很差,食管癌切除术后5年生存率约15%~40%,因此需要寻找有效的生物靶点[7-8]。FOXN3在许多器官中广泛表达,包括肝、胰腺、肾脏、肺和骨髓;在胚胎发育、组蛋白修饰、DNA损伤反应、细胞周期进程、新陈代谢中起着不可或缺的作用[9-11]。越来越多的研究表明,FOXN3是癌症的潜在治疗靶标,可以通过致癌活性调节肿瘤的发生。Sun等[12]发现,FOXN3在体外抑制人原发性肝癌(HCC)的增殖,在体内抑制HCC的肿瘤发生,提示FOXN3在HCC中起着抑癌作用。Li等[13]发现, FOXN3促进体外乳腺癌细胞的侵袭和上皮-间质转化(EMT)进程,以及体内乳腺癌的扩散和转移,表明FOXN3可能是乳腺癌的致癌基因。Chen等[14]发现,miR-611通过靶向FOXN3促进舌鳞状细胞癌细胞的增殖、迁移和侵袭。本研究发现,FOXN3在食管癌细胞中表达较低。而过表达FOXN3使食管癌细胞增殖、迁移和侵袭能力减弱,且增殖相关蛋白Ki-67和侵袭相关蛋白MMP-2蛋白表达降低,而细胞凋亡相关蛋白cleaved-Caspase-3蛋白表达升高。表明FOXN3可能在食管癌中起肿瘤抑制作用。
Wnt/β-catenin信号通路涉及多种重要的细胞功能,并可通过调节癌细胞的增殖、凋亡和EMT过程促进肿瘤的发展和复发。β-catenin磷酸化被抑制可导致细胞内β-catenin积累和核易位,随后β-catenin作为转录共激活因子与T细胞因子(TCF)/淋巴增强因子(LEF1)转录因子复合,激活下游靶基因发挥功能[15-16]。在肿瘤发生过程中,Wnt/β-catenin信号通路的激活可以上调与细胞增殖和迁移有关的靶基因,例如c-myc和cyclin D1,从而促进细胞增殖和迁移,导致细胞癌变[17]。魏莉等[18]研究表明,敲减AT富集作用域2(ARID2)基因可促进Wnt/β-catenin信号通路活化,促进胰腺癌细胞生长和迁移。另外,FOXN3可以通过Wnt/β-catenin通路影响肿瘤细胞。Sun等[19]发现Wnt/β-catenin通路能通过抑制FOXN3表达,调节黑色素瘤的上皮-间质转化和转移,表明FOXN3与β-catenin相互作用,并可调节参与Wnt/β-catenin信号传导的蛋白质。Dai等[20]发现,结肠癌中FOXN3的丢失会激活β-catenin/TCF信号传导并促进癌细胞的生长和迁移。Zhao等[21]研究发现,FOXN3的过度表达抑制甲状腺乳头状癌细胞的增殖、集落形成、迁移和侵袭,并导致β-catenin、c-Myc和cyclin D1表达水平显著降低。另外,Wnt/β-catenin信号通路的激活逆转了FOXN3对甲状腺乳头状癌细胞的影响。上述研究均表明FOXN3对Wnt/β-catenin信号传导具有抑制作用。本研究发现,过表达FOXN3降低Wnt1和β-catenin的蛋白表达,抑制了细胞中Wnt/β-catenin通路的激活,从而抑制食管癌细胞增殖、迁移和侵袭,并促细胞凋亡。
综上所述,过表达FOXN3能够抑制食管癌细胞增殖、迁移和侵袭,并促细胞凋亡。这表明FOXN3在食管癌中发挥了抑制肿瘤活性的作用,可能是通过抑制Wnt/β-catenin信号通路实现的。这些发现为潜在的治疗策略提供了新的治疗选择。
